


2. 中山大学生命科学学院,广东 广州 510006;
3. 中山大学化学与化学工程学院,广东 广州 510275
2. School of Life Sciences, Sun Yat-sen University, Guangzhou 510006, China ;
3. School of Chemistry and Chemical Engineering, Sun Yat-Sen University, Guangzhou 510275, China
端粒是染色体末端的特异结构,在人类细胞中它是由DNA重复单位(TTAGGG/AATCCC)和结合于其上的端粒结合蛋白(shelterin)组成[1]。端粒保护着染色体末端免受各种酶的攻击,避免染色体与染色体之间的末端融合,抑制染色体的末端重组,在维持染色体结构和功能的稳定性、完整性方面起着至关重要的作用[1]。但是,由于线性DNA半保留复制中存在的“末端复制问题(end replication problem)”,端粒DNA在细胞分裂的每一个周期都会丢失一小段。在人类细胞中,细胞每分裂一次端粒DNA就会缩短50~300 bp[1]。当端粒DNA缩短到极限长度时,它就失去了保护染色体的功能,从而激活细胞内的DNA损伤信号,细胞进入衰老或凋亡程序。癌细胞的重要特征是能无限分裂,为了避免由端粒缩短引起的细胞衰老、凋亡,约85%癌细胞高表达端粒酶。端粒酶由逆转录酶hTERT及RNA模板hTR组成,能以自身RNA为模板合成TTAGGG的序列,添加到端粒末端,从而延长端粒(图 1A)[2]。Elizabeth、Carol和Jack 3位美国科学家因在关于端粒和端粒酶如何保护染色体方面的发现分享了2009年的诺贝尔生理学和医学奖。另外大约15%的癌细胞不表达端粒酶(端粒酶阴性肿瘤细胞),它们通过被称为端粒替代延伸机制(alternative lengthening of telomeres,ALT)来延伸端粒(图 1B),从而维持端粒长度[3]。
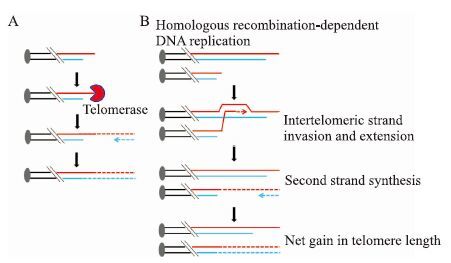
|
| Fig 1 elomere extension mechanisms of cancer cells A: Telomerase; B: Alternative lengthening of telomeres (ALT) |
1962年,美国科学家Gellert和Davies等发现,人体端粒富含鸟嘌呤(G)的3´-overhang DNA单链,在一定条件下可以由自身4个G通过Hoogsteen氢键自组装成G-四分体 (Fig 2A),多个G-四分体通过π-π堆积作用进而形成G-四链体DNA(G4-DNA)(Fig 2B)。与此同时,大量的研究表明,无论是端粒酶还是ALT,在延伸端粒时均需要以链状的端粒DNA序列为模板。这种G4-DNA的形成对端粒酶或ALT活性均具有明显的抑制作用。因此人体端粒G4-DNA被认为是潜在的抗癌药物重要新靶点[4]。自从人们发现人体端粒G4-DNA是潜在的抗癌靶点以来,该领域吸引了越来越多科研工作者的重视:大量的研究工作证实,体内G4-DNA的存在并具有非常重要的生物相关性,除了端粒保护外,可能还与 DNA 复制相关的疾病以及染色体的排列重组等有一定的关系[5]。同时许多能稳定该结构的小分子化合物被设计和合成[5-8]。这些小分子化合物能通过诱导端粒G4-DNA的形成并进一步的稳定该结构,从而抑制端粒酶/ALT活性和肿瘤细胞生长,最终达到抗癌效果。该文将结合我们的研究工作,对人体端粒G4-DNA稳定剂作为抗肿瘤药物的研究进展进行综述。
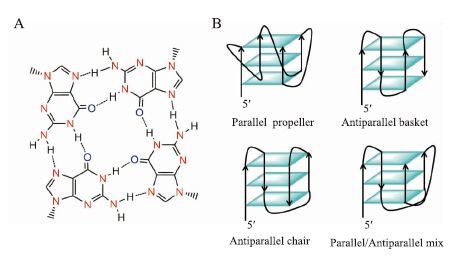
|
| Fig 2 G-tetrad (A) and different conformations of G-quadruplex (B) |
近年来,根据人体端粒G4-DNA 的结构特点及G4-DNA 与小分子相互作用时可能采取的作用模式,很多小分子化合物被设计和开发出来作为人体端粒G4-DNA的稳定剂。2,6-二酰胺蒽醌衍生物(2,6-diamidoanthraquinone)是第1例人体端粒G4-DNA稳定剂,并能有效地抑制端粒酶的活性(IC50 ≈23 μmol·L-1)[9]。从环圈链霉菌(streptomyces anulatus) 3533-SV4分离出来的天然产物端粒酶抑制素(telomestatin)不但对人体端粒G4-DNA具有很强的稳定能力,而且是目前最强的端粒酶活性抑制剂(IC50≈5 nmol·L-1)[10]。随后,越来越多的有机合成小分子化合物作为人体端粒G4-DNA稳定剂,进而发挥抗肿瘤效果被报道(图 3)[5-8]。例如:triazine12459 通过稳定人体端粒G4-DNA能够加速端粒长度的缩短[11];BRACO19通过诱导人体端粒3' G-overhang 形成稳定的G4结构,进而抑制端粒酶的活性(IC50≈0.06 μmol·L-1),同时能引起癌细胞快速的复制性衰老和相关DNA的断裂[12];吖啶类衍生物RHPS4能够诱导强烈的端粒DNA的损伤,动物实验表明,当其与紫杉醇联合用药时,可以有效地治疗小鼠的子宫癌[13]。360A能够有效地稳定人体端粒G4-DNA,虽然它不能有效地促使端粒的缩短,但是用360A处理ALT细胞时能够造成端粒末端的融合,导致癌基因的不稳定,进而达到抗肿瘤的效果[14];Pyridostatin 是一个非常优秀的人体端粒G4-DNA稳定剂,它能靶向性地稳定人体端粒G4-DNA,同时能够定点地在端粒处产生大量的DNA损伤,进而加速端粒的缩短速率,最终导致癌细胞的死亡[15];卟啉衍生物TMPyP4,对多种G4-DNA都具有很强的亲和力,但选择性不强:TMPyP4既能稳定端粒G4-DNA也能稳定c-myc启动子区域G4-DNA。TMPyP4对乳腺癌细胞MX-1和前列腺癌细胞PC-3表现出很好的抗癌活性和端粒酶活性抑制能力(IC50≈6.5 μmol·L-1)[16]。
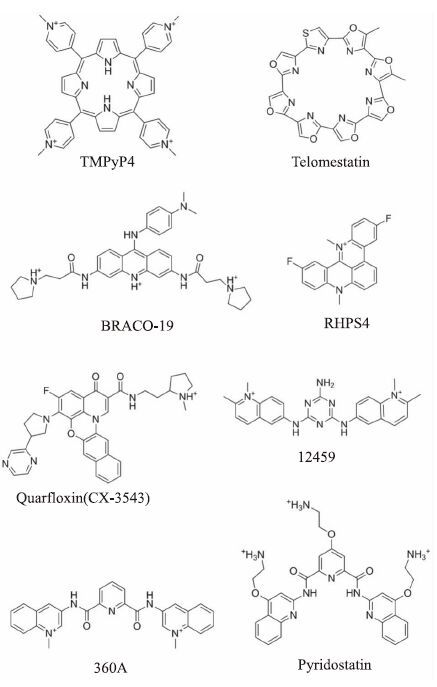
|
| Fig 3 The representative compounds of small organic molecules which act as G-quadruplex stabilizers |
通过对这些已报道的人体端粒G4-DNA稳定剂的结构的研究,我们发现除了天然产物端粒酶抑制素外,这些有机小分子大部分具有以下特征[5]:(1)一个较大的芳香性的平面,这有利于和G-四分体之间的π-π堆积作用; (2)带有末端是胺基(包括季胺盐)的短烷基侧臂,在生理pH条件下带正电荷,这有利于与G4-DNA上的沟槽区或loop区结合;(3)分子体积较小和分子本身均具有一定的柔韧性,因此化合物在与G4-DNA的作用过程中就可以适当地调整自身构象与之匹配,从而达到特异性识别人体端粒 G4-DNA,甚至对不同G4-DNA拓扑构型之间也有一定的识别。
2 无机金属配合物人体端粒G4-DNA 的诱导剂除了有单纯的有机小分子化合物 (占绝大部分)外,还有少量的金属配合物[7]。尽管与有机小分子相比较来说,金属化合物作为人体端粒G4-DNA 的稳定剂的研究开始比较晚,但是由于金属配合物具有很多有机小分子难以比拟的优点:更易获得,更丰富的几何结构及电化学性质,同时还具有光学、磁学以及催化等多种性能;其次在结合模式方面,除了常规的π-π 堆积作用之外,金属配合物还能通过与碱基或者磷酸骨架形成共价键的方式稳定 G4结构[17]。金属配合物所拥有的这些优势,使得无机金属配合物在人体端粒G4-DNA的稳定剂中占据了不容忽视的地位。G4-DNA 的金属稳定剂主要可以分为以下几大类:(1) 以大环化合物为配体的金属配合物,如金属-卟啉化合物、金属-酞菁化合物和金属-可咯(Corrole)化合物等;(2)以非大环平面分子为配体的金属配合物,如金属-salphen 配合物、金属-多吡啶配合物、金属-双喹啉配合物等;(3)金属超分子化合物;(4)与G4-DNA 共价结合的金属配合物;(5)能通过氧化还原反应损伤G4-DNA 的金属配合物等。其中卟啉类金属配合物(图 4A)(作为以大环化合物为配体的金属配合物中的一个典型代表)作为第一个被开发出来作为 G4-DNA 的稳定剂的金属配合物,通过大量的科研实验和计算机模拟实验发现该类配合物与G4-DNA的相互作用的方式主要为末端 π-π 堆积(与其配体卟啉相似)[18],且经过修饰(如连接上一些带正电荷的基团)的卟啉能增加金属卟啉对人体端粒G4-DNA的结合力和选择性之外,还能增加体外抑制端粒酶活性的能力。另一大类金属G4-DNA的稳定剂是以非大环类平面型化合物为配体的金属配合物,以Vilar R 课题组发表的 Ni-salphen 配合物为代表(图 4B)[19]。从结构上可知,该配合物除了具有良好的中心缺电子平面外还带有两个正电荷侧臂,实验数据显示,该配合物除了具有较优异的人体端粒G4-DNA 的稳定能力(ΔTm=33 ℃,1 μmol·L-1)外,同时还拥有不错的G4-DNA 的选择能力,其对G4-DNA的选择能力是双链 DNA 的50倍,此外还具有不错的体外端粒酶活性的抑制能力 (IC50=0.12 μmol·L-1)。随着越来越多的无机金属配合物被开发作为 G4-DNA 的稳定剂,除了普通的金属离子外,一些贵金属离子 (如Pt2+)也逐渐被采用。其中单边修饰邻菲咯啉铂(Ⅱ) 配合物(图 4C)是由Vilar R课题组报道的,尽管该配合物不但带有一个正电荷侧臂而且中心也拥有不错的平面性,但是总体来说:其拥有不错的体外G4-DNA 稳定能力 (ΔTm=20 ℃,1 μmol·L-1),较差的端粒酶活性抑制能力(IC50=49.5 μmol·L-1)[20]。除此之外,三联吡啶类化合物(图 4D)也是比较常见的多吡啶类 G4-DNA 的稳定剂,实验数据表明该配合物修饰了一个带正电荷的环状胺基侧链之后,不但增强了该配合物的水溶性,而且大大提高了配合物对 G4-DNA 的相互作用能力;实验结果表明,该配合物能有效地稳定人体端粒 G4-DNA和启动子c-myc G4-DNA,但是其对G4-DNA 和双链DNA之间的选择性并不高。金属超分子化合物则是利用超分子自组装的方法来构建能做为G4-DNA 的稳定剂的金属配合物[21]。图 4E是1例非常优秀的人体端粒G4-DNA的稳定剂——四核铂(Ⅱ)配合物,该配合物是Sleiman课题组通过 4´,4-联吡啶和乙二胺构建的四核铂(Ⅱ)配合物,计算机拟合和实验数据均表明该配合物能通过π-π末端堆积的方式很好的稳定端粒G4结构,同时具有优异的体外端粒酶活性抑制能力(IC50=0.2 μmol·L-1)[22]。除了Pt2+配合物外,Ru2+配合物也广泛的应用于G4-DNA稳定剂的研究[23]。图 4F 是国内计亮年教授课题组早年报道过的具有八面体构型的Ru(Ⅱ)多吡啶配合物,实验结果表明,在没有金属离子存在的情况下,该配合物能有效的诱导富G序列形成反平行结构的G4-DNA,荧光光谱证实该配合物对G4-DNA具有一定的选择性 (其对人体端粒G4-DNA 的结合常数要比双链DNA 高出一个数量级左右),计算机模拟推测该配合物与G4-DNA 是以1∶1 的末端堆积方式结合的。
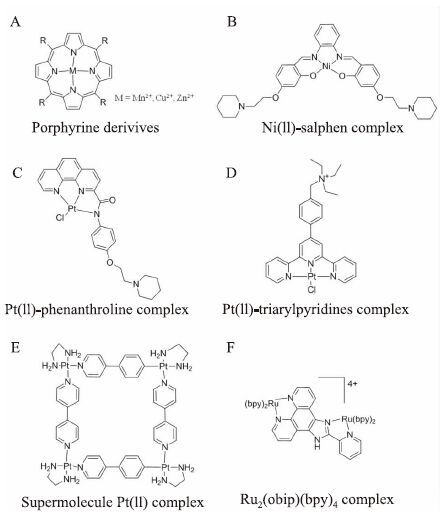
|
| Fig 4 The representative complexes of metal complexes which act as G-quadruplex stabilizers |
Fig 5中的一系列单核、双核、三核及四核铂(Ⅱ)配合物则是由我们课题组报道的,实验研究发现,通过改变桥联配体的尺寸以及侧臂辅助配体的亲疏水性,不但可以有效地提高此类配合物对人体端粒G4-DNA 的亲和力以及选择性,而且还可以有效地提高该类配合物对端粒酶活性的抑制能力。其中我们课题组报道的邻菲罗啉(Ⅱ)配合物能有效地稳定人体端粒G4-DNA[24]。紧接着我们课题组报道了1例带1个正电荷侧臂的铂(Ⅱ)三联吡啶配合物,该配合物对人体端粒G4-DNA具有很强的作用力,但是相对于双链DNA其选择性不高,所带的季铵盐侧链一方面增强了配合物的水溶性,另外其正电荷促进了配合物和G4-DNA之间的相互作用[25]。然后我们课题组合成了2个V形双核铂(Ⅱ)配合物,它们具有较强的人体端粒G4-DNA稳定能力(ΔTm=34.5℃,0.5 μmol·L-1)和较高的端粒酶活性抑制能力(IC50=360 nmol·L-1)[26]。为了进一步提高铂(Ⅱ)配合物对G4-DNA选择和稳定能力,我们还设计合成了一系列三核和四核铂(Ⅱ)配合物。结果表明,多核铂(Ⅱ)配合物拥有更高的抗肿瘤活性和更强的G4-DNA结合能力,特别是它们通过末端π-π堆积、沟槽和loop 的结合模式能有效地诱导人体端粒G4-DNA构型的转变;无论是对人体端粒G4-DNA的选择和稳定能力(ΔTm>34℃,0.2 μmol·L-1和Kb=108 mol·L-1·s-1),还是对端粒酶活性的抑制能力(IC50=25 nmol·L-1),都要远强于已报道的大多数配合物,具有良好的抗肿瘤活性[27-30]。以上只是例举了几种比较典型的金属配合物作为G4-DNA的稳定剂,除此之外,还有许多金属配合物被研究出来作为人体端粒G4-DNA的稳定剂。
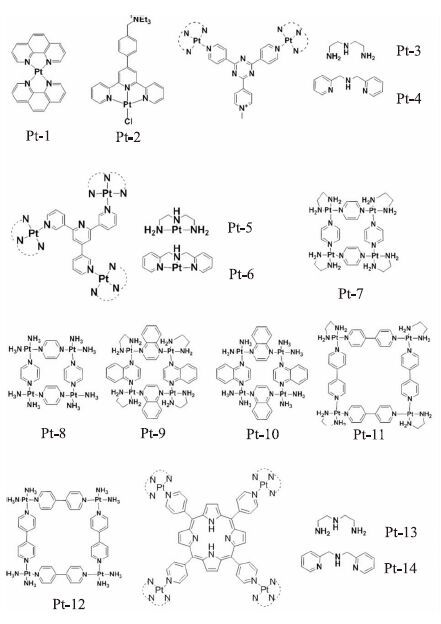
|
| Fig 5 A series of multinuclear Pt(Ⅱ) complexes as G-quadruplex stabilizers |
人体端粒G4-DNA的出现与许多重要的生理过程密切相关,以G4-DNA为抗肿瘤药物作用靶点对化合物进行筛选和结构设计是目前化学家和生物学家密切关注的热点。人体端粒G4-DNA是一种以核酸为基础的调控机制,调节端粒的长度和稳定性,同时还参与基因的转录、复制和翻译过程。因此以人体端粒G4-DNA为靶点的抗癌药物应该是最具发展前景的抗癌药物,因为此类药物可以从根本上抑制癌细胞的产生、 发展和增殖。与此同时,人体端粒G4-DNA作为具有特殊生物功能的DNA二级结构,以它为靶点来设计新的抗癌药物具有一定的合理性与优越性,主要体现在以下几方面:① 独特的生物学功能:不同于双链DNA是遗传信息的携带者,端粒G4-DNA具有其特殊的生物学功能,小分子化合物通过稳定、 解旋或改变其拓扑结构等,可以达到特异性的靶向肿瘤细胞,进而发挥抗肿瘤的效果;② 独一无二的结构:G4-DNA具有其结构的特殊性,使之可以很好的与普遍存在的双链DNA区别开来,如此特殊的结构可以为有选择性的小分子化合物提供良好的设计平台;③ G4-DNA的结构普遍存在于人体端粒末端。随着广大科研工作者对人体端粒G4-DNA及其相关领域的研究,人体端粒G4-DNA的结构的多样性以及不可缺少的生物学功能得到了不断的诠释和阐明。更重要的是,人体端粒G4-DNA在体内的真实存在及其重要的生物学功能已被大量的实验所证实,且已有少数以人体端粒G4-DNA为靶点设计的小分子作为新一代潜在的抗癌药物进入了临床研究。尽管现在针对人体端粒G4-DNA 的稳定剂的研究,绝大部分还停留在体外,但是随着人体端粒 G4-DNA结构和功能的不断诠释以及化合物与人体端粒G4-DNA 相互作用的探讨和研究方法的进步,人们有望开展更多的体内研究便于进一步研究开发出专一性的 G4-DNA的稳定剂,从而为发展新型抗肿瘤药物奠定了基础,同时也提供了机遇。
| [1] | Muller S, Rodriguez R. G-quadruplex interacting small molecules and drugs: from bench toward bedside[J]. Expert Rev Clin Pharmacol, 2014, 7 (5) : 663-79 . |
| [2] | Greider C W, Blackburn, E H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts[J]. Cell, 1985, 43 (2) : 405-13 . |
| [3] | Dunham M A, Neumann A A, Fasching C L, Reddel R R. Telomere maintenance by recombination in human cells[J]. Nat Genet, 2000, 26 (4) : 447-50 . |
| [4] | Bidzinska J, Cimino-Reale G, Zaffaroni N, Folini M. G-quadruplex structures in the human genome as novel therapeutic targets[J]. Molecules, 2013, 18 (3) : 12368-95 . |
| [5] | Il'inskii N S, Varizhuk A M, Beniaminov A D, et al. G-quadruplex ligands: mechanisms of anticancer action and target binding[J]. Mol Biol, 2014, 48 (6) : 891-907 . |
| [6] | 李燕梅, 沈晓燕. 具抑制端粒酶活性的G-四链体小分子配体研究进展[J]. 中国药理学通报, 2010, 26 (1) : 17-20 . Li Y M, Shen X Y. Progress in the study of G-quadruplex telomerase inhibitors[J]. Chin Pharmacol Bull, 2010, 26 (1) : 17-20 . |
| [7] | 孙静, 陈嘉曦, 陈伙炎, 毛宗万. 金属配合物与 G-四链体作用的研究进展[J]. 中国药理学通报, 2012, 28 (4) : 469-72 . Sun J, Chen J X, Chen H Y, Mao Z W. Interaction of metal complexes with G-quadruplex[J]. Chin Pharmacol Bull, 2012, 28 (4) : 469-72 . |
| [8] | 郑小辉, 穆舸, 谭彩萍, 等. G-四链体DNA稳定剂的研究进展[J]. 中国科学: 化学, 2014, 44 (4) : 484-94 . Zheng X H, Mu G, Tan C P, Cao Q, et al. The study of G-quadruplex stabilizers[J]. Sci China, Ser B, 2014, 44 (4) : 484-94 . |
| [9] | Sun D, Thompson B, Cathers B E, et al. Inhibition of human telomerase by a G-quadruplex-interactive compound[J]. J Med Chem, 1997, 40 (14) : 2113-6 . |
| [10] | Temime-Smaali N, Guittat L, Sidibe A, et al. The G-quadruplex ligand telomestatin impairs binding of topoisomerase Ⅲalpha to G-quadruplex-forming oligonucleotides and uncaps telomeres in ALT cells[J]. PLoS One, 2009, 4 (9) : e6919 . |
| [11] | Gomez D, Aouali N, Londono-Vallejo A, et al. Resistance to the short term antiproliferative activity of the G-quadruplex ligand 12459 is associated with telomerase overexpression and telomere capping alteration[J]. J Biol Chem, 2003, 278 (50) : 50554-62 . |
| [12] | Gunaratnam M, Greciano O, Martins C, et al. Mechanism of acridine-based telomerase inhibition and telomere shortening[J]. Biochem Pharmacol, 2007, 74 (5) : 679-89 . |
| [13] | Salvati E, Leonetti C, Rizzo A, et al. Telomere damage induced by the G-quadruplex ligand RHPS4 has an antitumor effect[J]. J Clin Invest, 2007, 117 (11) : 3236-47 . |
| [14] | Granotier C, Pennarun G, Riou L, et al. Preferential binding of a G-quadruplex ligand to human chromosome ends[J]. Nucleic Acids Res, 2005, 33 (13) : 4182-90 . |
| [15] | Lee Y R, Yu D S, Liang Y C, et al. New approaches of PARP-1 inhibitors in human lung cancer cells and cancer stem-like cells by some selected anthraquinone-derived small molecules[J]. PLoS One, 2013, 8 (2) : e56284 . |
| [16] | Seenisamy J, Rezler E M, Powell T J, et al. The dynamic character of the G-quadruplex element in the c-MYC promoter and modification by TMPyP4[J]. J Am Chem Soc, 2004, 126 (28) : 8702-9 . |
| [17] | Ma D L, Che C M, Yan S C. Platinum(Ⅱ) complexes with dipyridophenazine ligands as human telomerase inhibitors and luminescent probes for G-quadruplex DNA[J]. J Am Chem Soc, 2009, 131 (5) : 1835-46 . |
| [18] | Shi D F, Wheelhouse R T, Sun D, Hurley L H. Quadruplex-interactive agents as telomerase inhibitors: synthesis of porphyrins and structure-activity relationship for the inhibition of telomerase[J]. J Med Chem, 2001, 44 (26) : 4509-23 . |
| [19] | Reed J E, Arnal A A, Neidle S, Vilar R. Stabilization of G-quadruplex DNA and inhibition of telomerase activity by square-planar nickel(Ⅱ) complexes[J]. J Am Chem Soc, 2006, 128 (18) : 5992-3 . |
| [20] | Reed J E, Neidle S, Vilar R. Stabilisation of human telomeric quadruplex DNA and inhibition of telomerase by a platinum-phenanthroline complex[J]. Chem Commun, 2007, 43 (42) : 4366-8 . |
| [21] | Suntharalingam K, White A J, Vilar R. Synthesis, structural characterization, and quadruplex DNA binding studies of platinum(Ⅱ)-terpyridine complexes[J]. Inorg Chem, 2009, 48 (19) : 9427-35 . |
| [22] | Kieltyka R, Englebienne P, Fakhoury J, et al. A platinum supramolecular square as an effective G-quadruplex binder and telomerase inhibitor[J]. J Am Chem Soc, 2008, 130 (31) : 10040-1 . |
| [23] | 赵晓珑, 刘晓媛, 杨瑞波, 等. 钌配合物与G-四链体DNA 的相互作用研究进展[J]. 化学通报, 2015, 78 (10) : 873-81 . Zhao X L, Liu X Y, Yang R B, et al. Research Progress in Interaction between Ruthenium Complexes and G-quadruplex DNA[J]. Chem Online, 2015, 78 (10) : 873-81 . |
| [24] | Wang J T, Zheng X H, Xia Q, et al. 1,10-Phenanthroline platinum(Ⅱ) complex: a simple molecule for efficient G-quadruplex stabilization[J]. Dalton Trans, 2010, 39 (31) : 7214-6 . |
| [25] | Wang J T, Li Y, Tan J H, et al. Platinum(Ⅱ)-triarylpyridines complexes with electropositive pendants as efficient G-quadruplex binders[J]. Dalton Trans, 2011, 40 (3) : 564-6 . |
| [26] | Xu C X, Zheng Y X, Zheng X H, et al. V-shaped dinuclear Pt(Ⅱ) complexes: selective interaction with human telomeric G-quadruplex and significant inhibition towards telomerase[J]. Sci Rep, 2013, 3 : 2060 . |
| [27] | Xu C X, Shen Y, Hu Q, et al. Stabilization of human telomeric G-quadruplex and inhibition of telomerase activity by propeller-shaped trinuclear Pt(Ⅱ) complexes[J]. Chem Asian J, 2014, 9 (9) : 2519-26 . |
| [28] | Zheng X H, Cao Q, Ding Y L, et al. Platinum(Ⅱ) clovers targeting G-quadruplexes and their anticancer activities[J]. Dalton Trans, 2015, 44 (1) : 50-3 . |
| [29] | Zheng X H, Zhong Y F, Tan C P, et al. Pt(Ⅱ) squares as selective and effective human telomeric G-quadruplex binders and potential cancer therapeutics[J]. Dalton Trans, 2012, 41 (38) : 11807-12 . |
| [30] | Zheng X H, Chen H Y, Tong M L, et al. Platinum squares with high selectivity and affinity for human telomeric G-quadruplexes[J]. Chem Commun, 2012, 48 (61) : 7607-9 . |

