


2.江西中医药大学附属医院 肺病科,江西 南昌 330006
2. Dept of Respiratory Medicine,the Affiliated Hospital of Jiangxi University of Traditional Chinese Medicine,Nanchang 330006,China
动脉粥样硬化(atherosclerosis,AS)病变是心血管疾病的重要病理基础,其发病机制尚未完全明确。在AS病变过程中,从脂质条纹、纤维斑块和粥样斑块,到不稳定斑块的破裂及血栓形成,炎症反应及氧化应激损伤始终贯穿其中[1]。血管内皮细胞损伤被视为AS始动病理环节,受损的内皮细胞在炎症和氧化应激刺激下可吸附单核细胞,吞噬脂质成为成泡沫细胞,形成脂质斑块,使动脉管腔狭窄,管壁失去弹性形成AS[2]。PM2.5是大气中空气动力学直径≤2.5 μm的细颗粒物,也称可入肺颗粒物。研究表明,吸入PM2.5可加重炎症反应和氧化应激损伤而促进AS形成及发展。长期暴露在PM2.5环境可抑制载脂蛋白E基因敲除小鼠血浆高密度脂蛋白的抗炎能力,并明显增加肝脏丙二醛(malonaldehyde,MDA)和核转录因子Nrf2调控的抗氧化应激相关基因表达,而促进AS形成[3]。
大蒜素(allicin)是从葱科葱属植物大蒜(Allium Sativum)的鳞茎中提取的一种有机硫化合物,也存在于洋葱及其他葱科植物中。既往研究表明,大蒜素可通过抑制炎症因子分泌、清除自由基抗氧化应激损伤、调节脂质代谢抑制泡沫细胞形成等多途径发挥抗AS效应[4],但其机制尚未完全阐明。本实验观察PM2.5对EA.hy926型人脐静脉内皮细胞损伤的影响,加用大蒜素和细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)信号通路特异性阻滞剂PD98059干预,探讨大蒜素对PM2.5损伤EA.hy926细胞的干预作用及可能机制。
1 材料与方法 1.1 材料 1.1.1 细胞株EA.hy926内皮细胞株购自美国ATCC细胞库,增殖周期约为31 h,批号2922。
1.1.2 药品与试剂大蒜素购自北京索莱宝科技有限公司,纯品为无色油状物,相对分子质量为162,批号150603;二甲基亚砜(DMSO)和噻唑蓝(MTT)购自美国Sigma公司;胎牛血清和DMEM培养基购自美国Gibco公司;p-ERK1/2、Bcl-2、Bax和β-actin抗体购自美国Cell Signal Technology公司;Annexin V-FITC试剂盒购自美国Bio Vision公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒购自美国eBioscience公司;MDA、超氧化物歧化酶(superoxide dismutase,SOD)和乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所。
1.1.3 仪器ST16R型低温高速离心机、3111型恒温细胞培养箱和MK3型酶标仪购自美国Thermo公司;MiniVol型便携式PM2.5采样器购自美国Airmetrics公司;165-1801型电泳仪购自美国Bio-Rad公司;石英纤维滤膜购自美国Whatman公司;TY7350型流式细胞仪购自美国ACEA Biosciences公司;IX71型荧光倒置显微镜购自日本OLYMPUS公司。
1.2 方法 1.2.1 PM2.5的采集与制备参照广州市环保局发布的PM2.5监测数据,于空气质量指数5级及以上PM2.5严重超标的雾霾天气,在广州市距离地面约50 m高建筑楼顶用PM2.5采样器以流量为5 L·min-1进行24 h·d-1采样,连续采样3 d。将石英纤维滤膜剪成1 cm×3 cm大小置于去离子水,超声震荡30 min×3次,用6层无菌纱布过滤提取液,以10 000 r·min-1于4 ℃离心20 min,收集提取物真空冷冻,并干燥成干粉,称重,-20 ℃避光保存。加灭菌PBS配制成质量浓度分别为20、200、400 mg·L-1的PM2.5混悬液。
1.2.2 细胞分组及处理设PM2.5不同质量浓度组,分别以0、20、200、400 mg·L-1 PM2.5作用EA.hy926细胞24 h[5]。药物干预组设① 对照组;② PM2.5组:PM2.5混悬液200 mg·L-1染毒24 h;③~⑤ 分别为PM2.5+大蒜素低、中、高剂量组:大蒜素用DMSO溶解并分别以5、20、40 mg·L-1预处理细胞1 h[6]后,再加PM2.5 200 mg·L-1染毒24 h;⑥ PM2.5+PD98059组:PD98059 20 μmol·L-1预处理细胞30 min[7]后,再加PM2.5 200 mg·L-1染毒24 h。
1.2.3 MTT法检测细胞存活率EA.hy926细胞密度调至每孔1×104个,接种至96孔培养板,每组设6个复孔,培养24 h后撤去血清。PM2.5混悬液不同质量浓度染毒后加入20 μL MTT溶液(PBS溶解,浓度为5 g·L-1)室温培养4 h,每孔加150 μL DMSO使还原产物完全溶解,低速振荡10 min,酶标仪测波长570 nm处各孔吸光度A。细胞存活率/%=[A(实验组)-A(空白对照组)/A(对照组)-A(空白对照组)]×100%。
1.2.4 流式细胞术检测细胞凋亡EA.hy926细胞密度调至每孔2×105个接种至12孔培养板24 h,每组设6个复孔,加不含血清的培养液培养24 h。收集细胞,PBS洗涤5 min×2次,加Annexin V-FITC及PI双染,流式细胞术检测细胞凋亡。
1.2.5 EA.hy926细胞TNF-α、IL-6及MDA含量、SOD、LDH活性的测定取对数生长期的EA.hy926细胞以1×108·L-1接种于培养皿。收集细胞,以1 000 r·min-1离心10 min,去除培养液,以2 mL PBS洗1次后,加PBS 500 μL混悬。超声5 s×5次,使细胞破碎,黄嘌呤氧化酶法检测细胞裂解液中SOD活性。收集细胞上清液,ELISA法检测TNF-α及IL-6含量,硫代巴比妥法检测MDA含量,比色法检测LDH活性,操作步骤参照说明书进行。
1.2.6 Western blot法检测Bax、Bcl-2、p-ERK1/2蛋白水平提取EA.hy926细胞总蛋白,BCA法测定蛋白浓度,蛋白样品煮沸5 min后进行SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂牛奶封闭2 h,TBST洗膜3次,加一抗于4 ℃反应过夜,洗膜3次,加二抗于室温结合,化学发光检测。以β-actin做内参蛋白,Quantity One软件分析各条带吸光度。
1.2.7 统计学处理用SPSS 13.0软件分析数据,数据采用±s表示,多组间比较用单因素方差分析,组间比较采用Bonferroni法。
2 结果 2.1 PM2.5对EA.hy926细胞的影响 2.1.1 对EA.hy926细胞存活率的影响与对照组比较,200、400 mg·L-1 PM2.5染毒24 h均可明显降低EA.hy926细胞存活率(P<0.05),见Tab1。
2.1.2 对EA.hy926细胞凋亡的影响与对照组比较,200、400 mg·L-1 PM2.5染毒24 h均可明显诱导EA.hy926细胞凋亡(P<0.05),见Tab1。
| Group | Viability/% | Apoptosis/% | TNF-α/ng·L-1 | IL-6/ng·L-1 | MDA/μmol·L-1 | SOD/kU·L-1 | LDH/kU·L-1 |
| Control | 100 | 2.07±0.33 | 162.75±14.31 | 348.45±15.48 | 1.21±0.36 | 18.12±0.93 | 0.63±0.04 |
| 20 mg·L-1 | 98.71±0.57 | 2.10±0.36 | 164.51±13.92 | 351.34±15.96 | 1.23±0.39 | 18.09±1.08 | 0.63±0.05 |
| 200 mg·L-1 | 82.37±3.36* | 21.35±0.87* | 352.33±15.63* | 502.73±17.16* | 4.27±0.45* | 11.64±0.78* | 1.05±0.05* |
| 400 mg·L-1 | 63.42±3.69* | 42.07±1.62* | 408.20±16.77* | 564.59±18.03* | 5.46±0.42* | 8.43±0.63* | 1.45±0.05* |
| *P<0.05 vs control group | |||||||
与对照组比较,200、400 mg·L-1 PM2.5染毒24 h均可明显降低EA.hy926细胞内SOD活性(P<0.05),明显增加细胞上清液中TNF-α、IL-6、MDA含量及LDH活性(P<0.05),见Tab1。
2.1.4 对EA.hy926细胞内Bax、Bcl-2及p-ERK1/2蛋白水平的影响与对照组比较,200、400 mg·L-1 PM2.5染毒24 h均可明显增加EA.hy926细胞内Bax及p-ERK1/2蛋白水平,并明显减少Bcl-2蛋白水平,增加Bax/Bcl-2蛋白比率(P<0.05),见Fig1。

|
| Fig.1 Effects of different concentrations of PM2.5 on protein levels of p-ERK1/2,Bax and Bcl-2 in EA.hy926 cell(x±s,n=3) *P<0.05 vs control group |
与PM2.5组比较,20、40 mg·L-1大蒜素和20 μmol·L-1 PD98059对于PM2.5降低EA.hy926细胞存活率均有明显的拮抗作用(P<0.05),见Tab2。
| Group | Viability/% | Apoptosis /% | TNF-α /ng·L-1 | IL-6 /ng·L-1 | MDA /μmol·L-1 | SOD /kU·L-1 | LDH /kU·L-1 |
| Control | 100 | 2.05±0.36 | 162.43±14.04 | 349.56±15.42 | 1.22±0.36 | 18.15±0.96 | 0.63±0.04 |
| PM2.5 | 82.35±3.33* | 21.37±0.84* | 353.42±15.75* | 504.52±17.07* | 4.26±042* | 11.59±0.84* | 1.05±0.04* |
| PM2.5+allicin 5 mg·L-1 | 82.41±3.42* | 21.30±0.75* | 351.23±16.02* | 502.46±15.72* | 4.22±0.39* | 11.62±0.78* | 1.05±0.05* |
| PM2.5+allicin 20 mg·L-1 | 87.92±3.15*# | 15.16±0.84*# | 303.30±17.76*# | 448.02±14.61*# | 3.28±0.45*# | 14.63±0.93*# | 0.94±0.06*# |
| PM2.5+allicin 40 mg·L-1 | 91.32±2.13*# | 11.72±0.66*# | 242.18±16.74*# | 388.15±15.33*# | 2.21±0.33*# | 16.90±0.84*# | 0.75±0.05*# |
| PM2.5+PD98059 20 μmol·L-1 | 86.84±3.09*# | 16.96±0.63*# | 322.69±18.06*# | 462.64±16.08*# | 3.39±0.48*# | 13.98±0.81*# | 0.96±0.05*# |
| The concentration of PM2.5 was 200 mg·L-1. *P<0.05 vs control group;#P<0.05 vs PM2.5 group | |||||||
与PM2.5组比较,20、40 mg·L-1大蒜素和20 μmol·L-1 PD98059均可明显减少由PM2.5诱导的EA.hy926细胞凋亡(P<0.05),见Tab2。
2.2.3 对PM2.5影响EA.hy926细胞TNF-α、IL-6及MDA含量、SOD、LDH活性的干预作用与PM2.5组比较,20、40 mg·L-1大蒜素和20 μmol·L-1 PD98059均可明显增加EA.hy926细胞内SOD活性,明显降低细胞上清液中TNF-α、IL-6、MDA含量及LDH活性(P<0.05),见Tab2。
2.2.4 对PM2.5影响EA.hy926细胞内Bax、Bcl-2及p-ERK1/2蛋白水平的干预作用与PM2.5组比较,20、40 mg·L-1大蒜素和20 μmol·L-1 PD98059均可明显降低EA.hy926细胞内Bax及p-ERK1/2蛋白水平,并明显增加Bcl-2蛋白水平,减少Bax/Bcl-2蛋白比率(P<0.05),见Fig2。
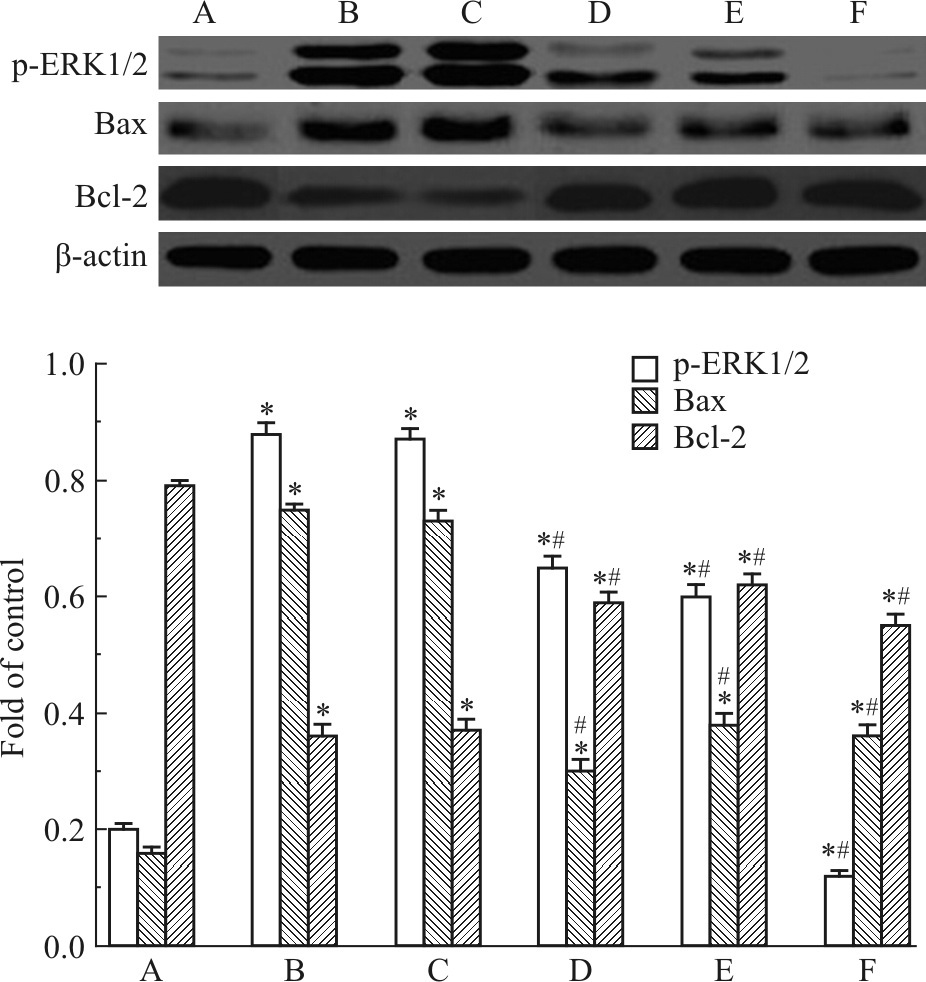
|
| Fig.2 Effects of different concentrations of allicin on protein levels of p-ERK1/2,Bax and Bcl-2 in EA.hy926 cell(x±s,n=3) A: Control group; B: PM2.5 200 mg·L-1 group; C: PM2.5 200 mg·L-1+allicin 5 mg·L-1 group; D: PM2.5 200 mg·L-1+allicin 20 mg·L-1 group; E: PM2.5 200 mg·L-1+allicin 40 mg·L-1 group; F: PM2.5 200 mg·L-1+PD98059 20 μmol·L-1 group.*P<0.05 vs control group;#P<0.05 vs PM2.5 group |
PM2.5主要来源于汽车尾气、石化燃料燃烧及香烟烟雾等,可长时间停留于大气中。PM2.5粒径小,富含大量有害有毒化学物质、细菌、病毒可经呼吸通过黏附作用穿过细胞膜迅速扩散至整肺,通过肺气血屏障进入毛细血管并渗透到血细胞内,扩散到心血管,随着循环系统扩散至微血管,作用于血管内皮。多中心、多种族临床对照试验证实,长期慢性暴露在高浓度PM2.5环境中,可通过炎症反应、氧化应激、交感神经兴奋性增加等机制,增加动脉内膜中层厚度、降低AS斑块稳定性,促进此人群AS的形成及发展[8, 9]。动物研究亦发现接触高浓度PM2.5可上调清道夫受体CD-36的表达,诱导粥样斑块内巨噬细胞内胆固醇堆积;促进炎症及氧化应激反应,增加内脏脂肪素表达,加速易损斑块的不稳定及破裂等,进而促进AS的形成[10, 11]。
氧化和抗氧化系统之间的平衡是维持内皮细胞功能的关键因素。SOD是细胞内的抗氧化酶,可通过清除超氧阴离子,减轻活性氧(reactive oxygen species,ROS)损害,从而保护内皮细胞,其活性的高低可反映机体抗氧化损伤能力。脂质在自由基作用下可发生过氧化反应,其不饱和脂肪酸氧化终产物为MDA,可引起核酸及蛋白质等生命大分子交联聚合,产生细胞毒性,MDA含量的高低可反映内皮细胞氧化损伤的严重程度。LDH存在于内皮细胞,当细胞受损时,细胞膜结构和细胞质内氧依赖性酶受到影响,细胞膜通透性增加,细胞外液LDH漏出量相应增加,因此LDH含量的高低可反映内皮细胞损伤程度。炎症反应可损伤内皮细胞,并促进AS发生及进展,其病理特征是在血管内皮,通过炎症信号途径完成炎症因子及黏附因子的释放,使炎性细胞浸润,并激活进一步级联式炎症反应[12]。TNF-α及IL-6在AS慢性炎症中扮演了重要角色,对巨噬细胞、单核细胞的迁移和激活起了调控作用,并能促进血管平滑肌细胞增殖,从而参与AS形成[13]。在Bcl-2基因家族蛋白中,促凋亡基因蛋白Bax和抑凋亡基因蛋白Bcl-2,Bax/Bcl-2比值的高低对细胞凋亡起了直接的调控作用[14]。本研究显示PM2.5染毒EA.hy926细胞后,可明显降低细胞内SOD活性,增加细胞上清液中TNF-α、IL-6、MDA含量及LDH活性,明显降低EA.hy926细胞存活率、增加细胞内Bax/Bcl-2蛋白比率以促进细胞凋亡,证实PM2.5可通过氧化应激损伤及炎症反应途径诱导EA.hy926细胞损伤。
炎症反应及氧化应激损伤均可激活细胞内的细胞凋亡信号级联通路以诱导细胞凋亡。ERK1/2通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)家族分支之一,在构建细胞骨架、维持细胞形态、调节细胞增殖及凋亡等生物学进程中起了重要作用,该通路的激活可通过增加血管平滑肌细胞增殖及炎性因子浸润等促进AS形成[15]。本研究显示PM2.5染毒可明显增加EA.hy926细胞内p-ERK1/2蛋白水平,证实PM2.5诱导EA.hy926细胞损伤可能与激活ERK1/2通路有关。
大蒜素可通过抑制核转录因子(nuclear factor kappa B,NF-κB)信号通路降低C反应蛋白(C-reactive protein,CRP)分泌而抑制炎症反应;清除ROS而抗氧化应激损伤;抑制胆固醇合成途径中的3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA还原酶)活性,阻断脂质过氧化而调节脂质代谢;抑制粥样斑块中巨噬细胞对低密度脂蛋白的降解及吸收,减少泡沫细胞的形成等多途径发挥抗AS作用[16, 17, 18],但大蒜素是否可通过抑制ERK1/2信号转导通路,减轻PM2.5诱导的内皮细胞损伤而抗AS尚不清楚。PD98059可抑制ERK的上游激酶,并与非活化形式的MAPK激酶(MAP kinase kinase,MKK)结合以抑制MKK的激活与磷酸化,发挥特异性阻断ERK1/2信号通路的作用。本研究结果证实,与PM2.5组比较,大蒜素及PD98059均可不同程度拮抗PM2.5降低EA.hy926细胞存活率、降低Bax/Bcl-2基因蛋白比率以抑制EA.hy926细胞凋亡、降低EA.hy926细胞内p-ERK1/2蛋白水平、增加EA.hy926细胞内SOD活性,降低细胞上清液中TNF-α、IL-6、MDA含量及LDH活性,提示大蒜素抗AS机制之一可能是通过抑制ERK1/2信号通路,减轻PM2.5诱导的氧化应激损伤及炎症反应,从而保护血管内皮细胞,此发现有望为大蒜素在AS防治中的应用提供新依据。大蒜素的抗AS作用机制及临床应用仍需进一步基础实验及临床研究得以明确。
(致谢:本实验主要在江西中医药大学的国家中药临床药理研究基地完成,感谢各位老师对本实验的帮助和指导。)
| [1] | Husain K,Hernandez W,Ansari R A,et al. Inflammation,oxidative stress and renin angiotensin system in atherosclerosis[J]. World J Biol Chem,2015,6(3):209-17. |
| [2] | Vanhoutte P M. Endothelial dysfunction: the first step toward coronary arteriosclerosis[J]. Circ J,2009,73(4):595-601. |
| [3] | Araujo J A,Barajas B,Kleinman M,et al. Ambient particulate pollutants in the ultrafine range promote early atherosclerosis and systemic oxidative stress[J]. Circ Res,2008,102(5):589-96. |
| [4] | 马丽娜,李峰杰,陈 坚,等. 大蒜主要活性成分及药理作用研究进展[J].中国药理学通报,2014,30(6):760-3. Ma L N,Li F J,Chen J,et al. Research advances in garlic′s main active ingredients and their pharmacological effects[J]. Chin Pharmacol Bull,2014,30(6):760-3. |
| [5] | Davel A P,Lemos M,Pastro L M,et al. Endothelial dysfunction in the pulmonary artery induced by concentrated fine particulate matter exposure is associated with local but not systemic inflammation[J]. Toxicology,2012,295(1-3):39-46. |
| [6] | Chen S,Tang Y,Qian Y,et al. Allicin prevents H2O2-induced apoptosis of HUVECs by inhibiting an oxidative stress pathway[J]. BMC Complement Altern Med,2014,14:321-8. |
| [7] | Zhang L,Ji Q,Liu X,et al. Norcantharidin inhibits tumor angiogenesis via blocking VEGFR2/MEK/ERK signaling pathways[J]. Cancer Sci,2013,104(5):604-10. |
| [8] | Kalsch H,Hennig F,Moebus S,et al. Are air pollution and traffic noise independently associated with atherosclerosis: the Heinz Nixdorf Recall Study[J]. Eur Heart J,2014,35(13):853-60. |
| [9] | Painschab M S,Davila-Roman V G,Gilman R H,et al. Chronic exposure to biomass fuel is associated with increased carotid artery intima-media thickness and a higher prevalence of atherosclerotic plaque[J]. Heart,2013,99(14):984-91. |
| [10] | Rao X,Zhong J,Maiseyeu A,et al. CD36-dependent 7-ketocholesterol accumulation in macrophages mediates progression of atherosclerosis in response to chronic air pollution exposure[J]. Circ Res,2014,115(9):770-80. |
| [11] | Wan Q,Cui X,Shao J,et al. Beijing ambient particle exposure accelerates atherosclerosis in ApoE knockout mice by upregulating visfatin expression[J]. Cell Stress Chaperones,2014,19(5):715-24. |
| [12] | 孙文佳,孙 杰,陈北冬,等. 银杏内酯B抑制高糖诱导内皮细胞TLR4及炎症蛋白表达[J]. 中国药理学通报,2015,31(5):636-40. Sun W J,Sun J,Chen B D,et al. Effect of ginkgolide B on TLR4 and inflammatory protein expression in high glucose treated human umbilical vein endothelial cells[J]. Chin Pharmacol Bull,2015,31(5):636-40. |
| [13] | Ahearn J,Shields K J,Liu C C,et al. Cardiovascular disease biomarkers across autoimmune diseases[J]. Clin Immunol,2015,161(1):59-63. |
| [14] | Besbes S,Mirshahi M,Pocard M,et al. New dimension in therapeutic targeting of BCL-2 family proteins[J]. Oncotarget,2015,6(15):12862-71. |
| [15] | 孙龙飞,安冬青. 炎性信号通路在动脉粥样硬化中的机制与中医药干预作用研究进展[J]. 中国动脉硬化杂志,2015,23(11):1177-81. Sun L F,An D Q. Research progress on mechanism of inflammatory signaling pathway in atherosclerosis and the intervention of traditional chinese medicine[J]. Chin J Arterioscl,2015,23(11):1177-81. |
| [16] | Wang S L,Liu D S,Liang E S,et al. Protective effect of allicin on high glucose/hypoxia-induced aortic endothelial cells via reduction of oxidative stress[J]. Exp Ther Med,2015,10(4):1394-400. |
| [17] | Elkayam A,Peleg E,Grossman E,et al. Effects of allicin on cardiovascular risk factors in spontaneously hypertensive rats[J]. Isr Med Assoc J,2013,15(3):170-3. |
| [18] | Gonen A,Harats D,Rabinkov A,et al. The antiatherogenic effect of allicin: possible mode of action[J]. Pathobiology,2005,72(6):325-34. |

