


缺血性脑损伤的病理过程极其复杂,其发病机制涉及脑组织能量代谢紊乱、兴奋性氨基酸毒性、细胞内钙超载、氧化应激损伤、炎症反应等诸多环节。最后,由于激活细胞凋亡基因导致细胞程序性死亡,使缺血半暗带区及梗死区融合。已经证实,在MCAO模型中,线粒体p53可通过转录依赖的机制来激活细胞的凋亡[1]。此外,脑缺血时钙离子在细胞内的大量聚集,引起大量兴奋性氨基酸及神经递质的释放,并且会激活大量的磷酸化酶,例如凋亡蛋白酶(caspase)[2],加速了神经细胞的凋亡。
CRMP2(collapsin response mediator protein 2)是胞质磷酸化蛋白CRMP1-5家族成员之一,可参与调解多种神经生理活动,如:微管动力学、轴突出芽及回缩、神经分化、树突/轴突特化、依赖驱动蛋白的轴突转运、钙离子内态稳定性、神经介质释放等[3, 4, 5]。研究证实,CRMP2可抑制凋亡前体基因p53的表达,调节Sema3A诱导的细胞凋亡[6, 7]。它还可调节NMDA受体的功能,与N型电压门控钙离子通道的α1B亚单位相互作用,稳定了钙离子内流[8, 9]。因此,我们推测CRMP2可能是一个通过调控凋亡反应起到脑缺血后神经保护作用的蛋白。
本实验采用立体定位方式向颅内注射CRMP2真核表达质粒,使大鼠缺血侧脑组织过表达CRMP2,再进一步观察CRMP2对大鼠缺血/再灌注损伤后神经细胞凋亡及神经功能的影响。
1 材料与方法 1.1 实验动物及材料Sprague-Dawley ♂大鼠192只(重医大动物实验中心提供),体质量220~270 g,(20~25)℃室温饲养,自然进水和食物。RT-PCR试剂盒(TaKaRa公司);兔抗CRMP2(美国CST);山羊抗兔二抗(Proteintech Group,Inc);TTC(美国Sigma);兔抗BDNF(美国Abcam);山羊抗兔二抗试剂盒(博士德)。
1.2 方法 1.2.1 真核表达质粒立体定位注射右侧侧脑室注射:以前囟为坐标0点,向右1.5 mm,向后1.2 mm,深4.5 mm。将带有GFP的空白质粒、真核表达质粒(160 mg·L-1)注射至大鼠侧脑室内,一次注射总量为4 μL,速度为0.3 μL·min-1,留针5 min。
1.2.2 MCAO/再灌注模型制作与分组采用随机数字的方法将192只大鼠随机分为sham组、MCAO组、MCAO+GFP组、MCAO+CRMP2/GFP组,每组6只。脑立体定位注射后1 d,参照本课题组前期的实验方法[10],采用Longa评分,1~3分的模型纳入实验,其余剔除,并从同批次实验模型大鼠中随机补齐。
1.2.3 Western blot检测将各组大鼠脑缺血区域皮质取下,液氮速冻,-80 ℃保存。参照碧云天蛋白提取试剂盒提取蛋白用于检测。蛋白样品在浓度分数为0.1的SDS-PAGE凝胶中分离并转移至0.45的PVDF膜上,浓度分数为0.05的脱脂奶粉封闭90 min,CRMP2(55~65 ku)一抗(1 ∶1 000)4 ℃过夜,山羊抗兔二抗(1 ∶2 000)37 ℃孵育1 h,采用fusion软件检测与分析。
1.2.4 RT-PCR检测灭酶器械取组织标本,参照RNA提取及逆转录试剂盒说明书处理得组织cDNA,-80 ℃保存。引物序列如下:CRMP2上游(21 bp)5′-TCCGGTCTGTTCTGGCTTTTTC-3′,下游(21 bp):5′-AGGGTCCGCTCAGGCTGTGTC-3′;p53上游(19 bp)5′-CTGGACGACAGGCAGACTT-3′,下游(19 bp)5′-CAGCGTGATGATGGTAAGGA-3′;BCL2上游(19 bp)5′-GGTGGACAACATCGCTCT-3′,下游(20 bp)5′-CAGCCAGGAGAAATCAAACA-3′;Caspase-3上游(20 bp)5′-AAAGGAATGACTGGGAGTGG-3′,下游(20 bp)5′-AATGACGACCTGGAACATCG-3′,Caspase-8上游(20 bp)5′-AGCCCA TCTTCACACTACGG-3′,下游(22 bp)5′-AGCACACATCAGTTAGGACACA-3′。用SYBR GREEN进行扩增反应。
1.2.5 免疫组化及TUNEL染色各组大鼠缺血/再灌注后48 h及1周,PBS加多聚甲醛(体积分数0.04)经升主动脉灌注取脑,固定24 h,脱水,冰冻切片(10 μm/片)。切片微波修复后进行BDNF一抗及相应的二抗孵育,中性树胶封片;用于检测TUNEL的组织,固定脱水后石蜡包埋切片,切片脱蜡后按照TUNEL染色试剂盒说明书进行染色,中性树胶封片。光镜400倍下,每个脑组织随机选取3个脑片,每个脑片的缺血半暗带随机选取5个区域,计算平均数。
1.2.6 TTC染色及神经功能评分各组大鼠缺血/再灌注48 h后断头取脑,脑组织纵向切成2 mm厚度的脑片,TTC浸泡染色20 min,拍照,软件分析脑梗死体积百分比。神经功能评估采用评分者单盲的方法,参照Garcia[10]的评分标准进行评分,最低3分,最高18分,得分越低表示神经功能缺损越严重。
1.3 统计学分析采用SPSS22.0对数据进行分析,结果以x± s 表示,多组间比较运用AVONA分析,两两比较行LSD检验。
2 结果 2.1 脑缺血/再灌注后各组大鼠CRMP2 mRNA及蛋白的表达脑缺血/再灌注48 h及1周后,检测CRMP2的表达,结果提示:缺血/再灌注48 h CRMP2的表达较假手术组降低(P <0.01),1周后CRMP2的表达较48 h时降低更明显(P <0.01)。真核表达质粒使缺血侧脑组织CRMP2的表达在两个时间点均明显上调,与MCAO和MCAO+GFP组比较差异具有统计学意义(P <0.01)(Fig 1)。
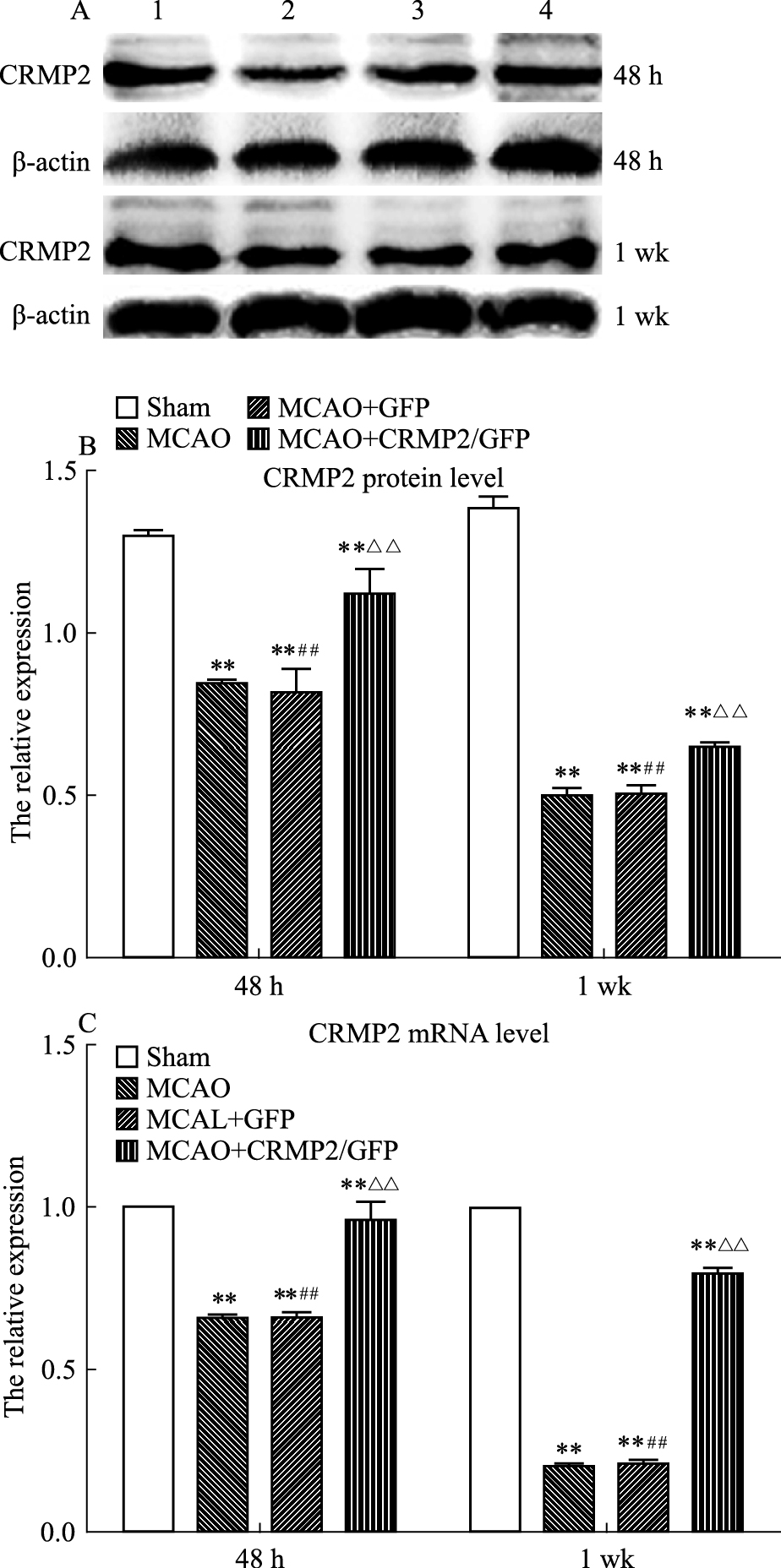
|
| Fig 1 Expression of CRMP2 at 48 h and 1 wk in ischemia penumbra of four groups A~B:Western blot assay of CRMP2 expression. C:The bar graph reflected CRMP2 mRNA expression; **P <0.01 vs sham group;##P <0.01 vs MCAO+CRMP2/GFP group;△△P <0.01 vs MCAO group;1:sham group;2:MCAO group;3:MCAO+GFP group;4:MCAO+CRMP2/GFP group |
脑缺血/再灌注48 h及1周,与sham组比较,缺血/再灌注后BCL2的mRNA的表达水平明显降低(P <0.01),而同时Caspase-3、Caspase-8以及p53的mRNA表达升高(P <0.01);与MCAO及MCAO+GFP组比,真核质粒干预脑缺血组织后升高了BCL2的mRNA水平(P <0.01),同时明显降低了p53、Caspase-3、Caspase-8的mRNA水平(P <0.01)(Fig 2)。
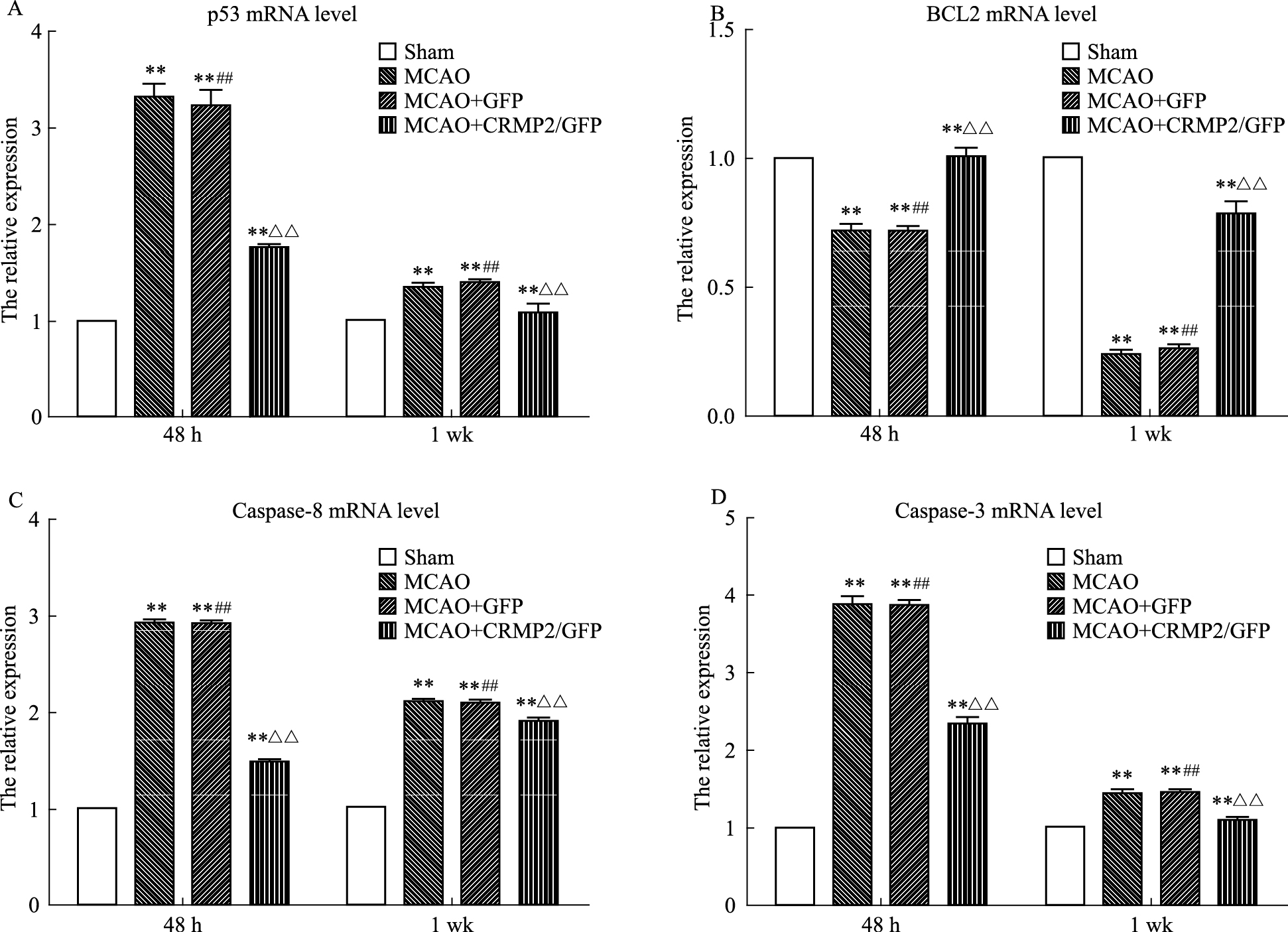
|
| Fig 2 Expression of BCL2,p53,Caspase-8 and Caspase-3 at 48 h and 1 wk in ischemia penumbra of four groups A~D:The bar graph reflected p53,BCL2,Caspase-8 and Caspase-3 mRNA expression. **P <0.01 vs sham group;##P <0.01 vs MCAO+CRMP2/GFP group;△△P <0.01 vs MCAO group. The bar graph refiected the expression of p53mRNA(A), BCl2 mRNA(B) Caspase-8 (C) and Caspase-3(D) |
在假手术组,缺血侧皮质有少量的凋亡细胞,而在缺血/再灌注48 h后,可见有大量的TUNEL阳性细胞存在。与MCAO及MCAO+GFP组比较,给予过表达CRMP2干预后,该部位TUNEL阳性细胞有所减少(P <0.01)(Fig 3)。
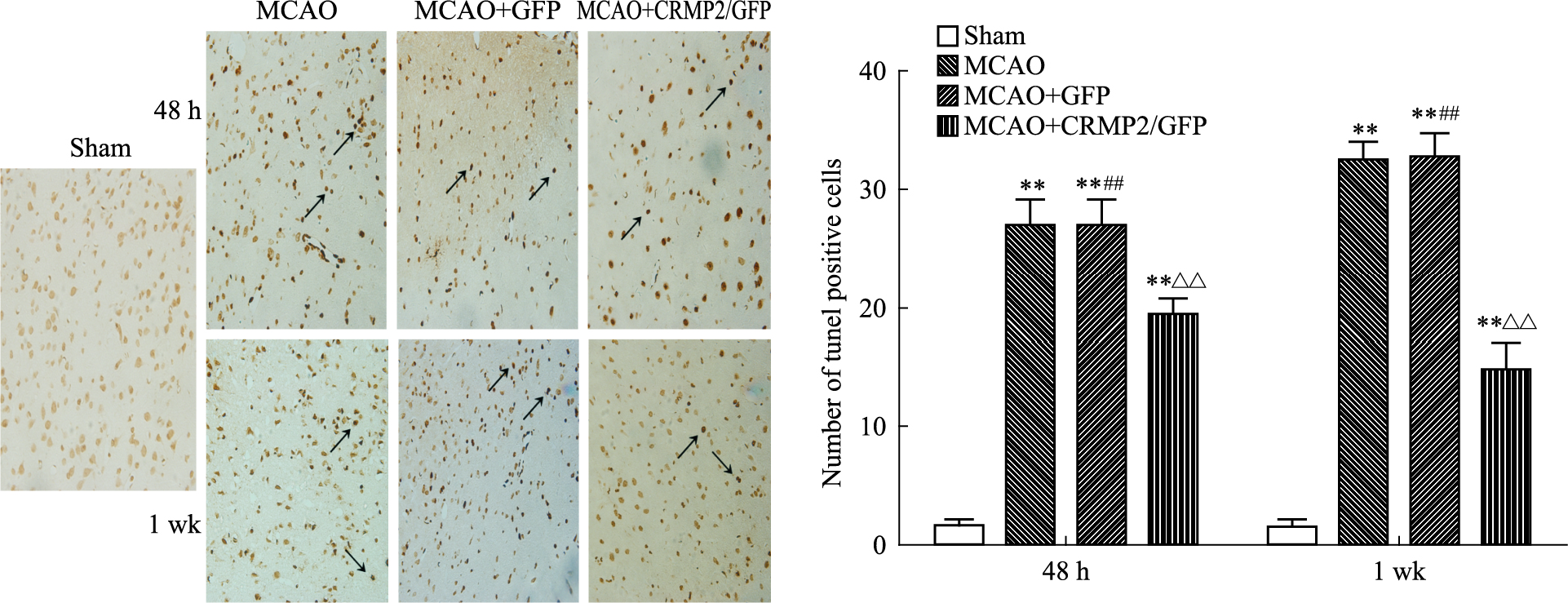
|
| Fig 3 Expression of TUNEL positive cells at 48 h and 1 wk in ischemia penumbra of four groups (400×) The black arrow for TUNEL positive cells.**P <0.01 vs sham group;##P <0.01 vs MCAO+CRMP2/GFP group;△△P <0.01 vs MCAO group |
大鼠缺血/再灌注之后48 h及1周,各组BDNF的表达均较假手术组升高(P <0.01);过表达CRMP2使该组BDNF的表达较另外两组明显升高(P <0.01)(Fig 4)。
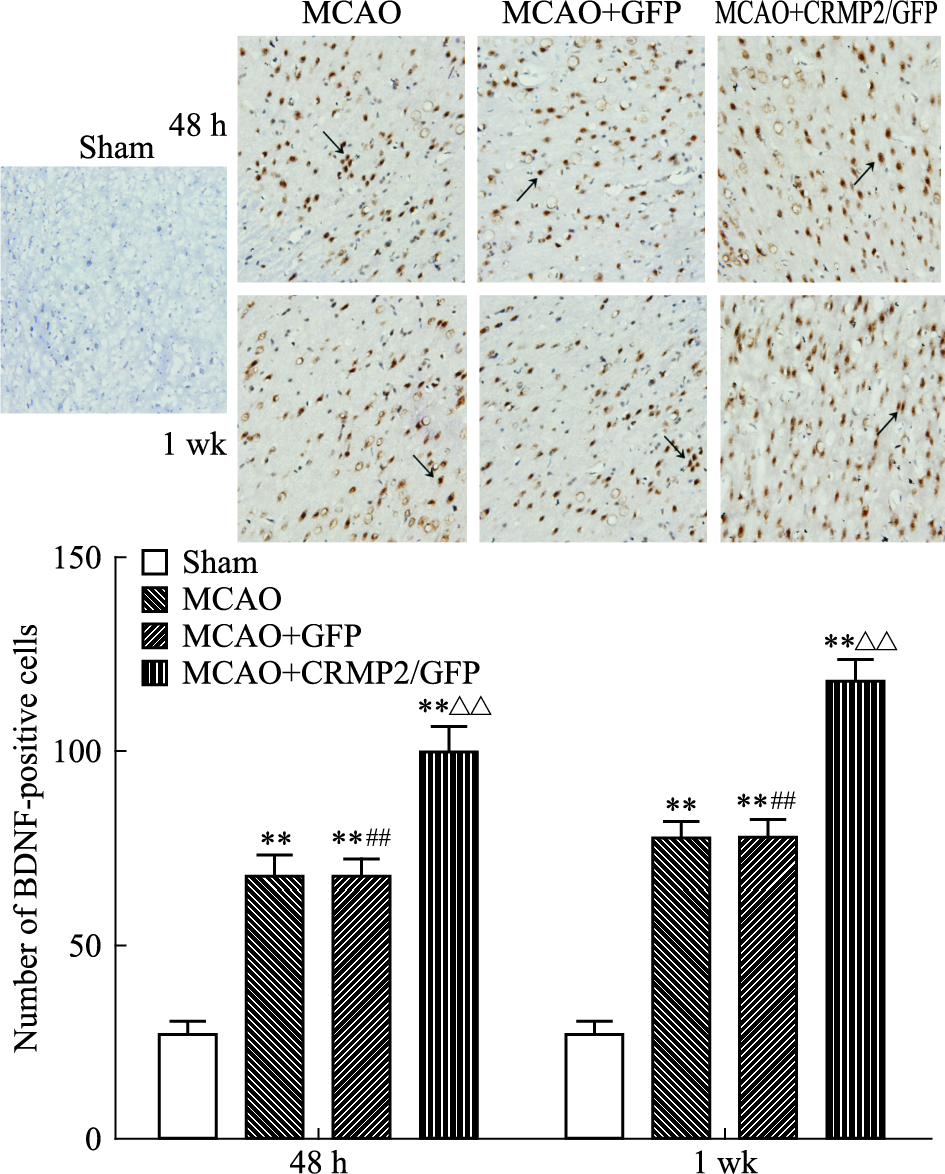
|
| Fig 4 Expression of BDNF positive cells at 48 h and 1 wk in ischemia penumbra of four groups (400×) The black arrow for BDNF positive cells.**P <0.01 vs sham group;##P <0.01 vs MCAO+CRMP2/GFP group;△△P <0.01 vs MCAO group |
再灌注后48 h,MCAO组及MCAO+GFP组大鼠缺血侧可见明显的梗死灶,并伴有严重的神经功能缺损(P <0.01);真核质粒干预后梗死灶明显缩小(P <0.01),神经功能缺损明显减轻(P <0.01)。1周后,缺血各组大鼠的神经功能均有所恢复,但MCAO+CRMP2/GFP组的神经功能评分明显高于其他两组(P <0.01)(Fig 5、Tab 1)。
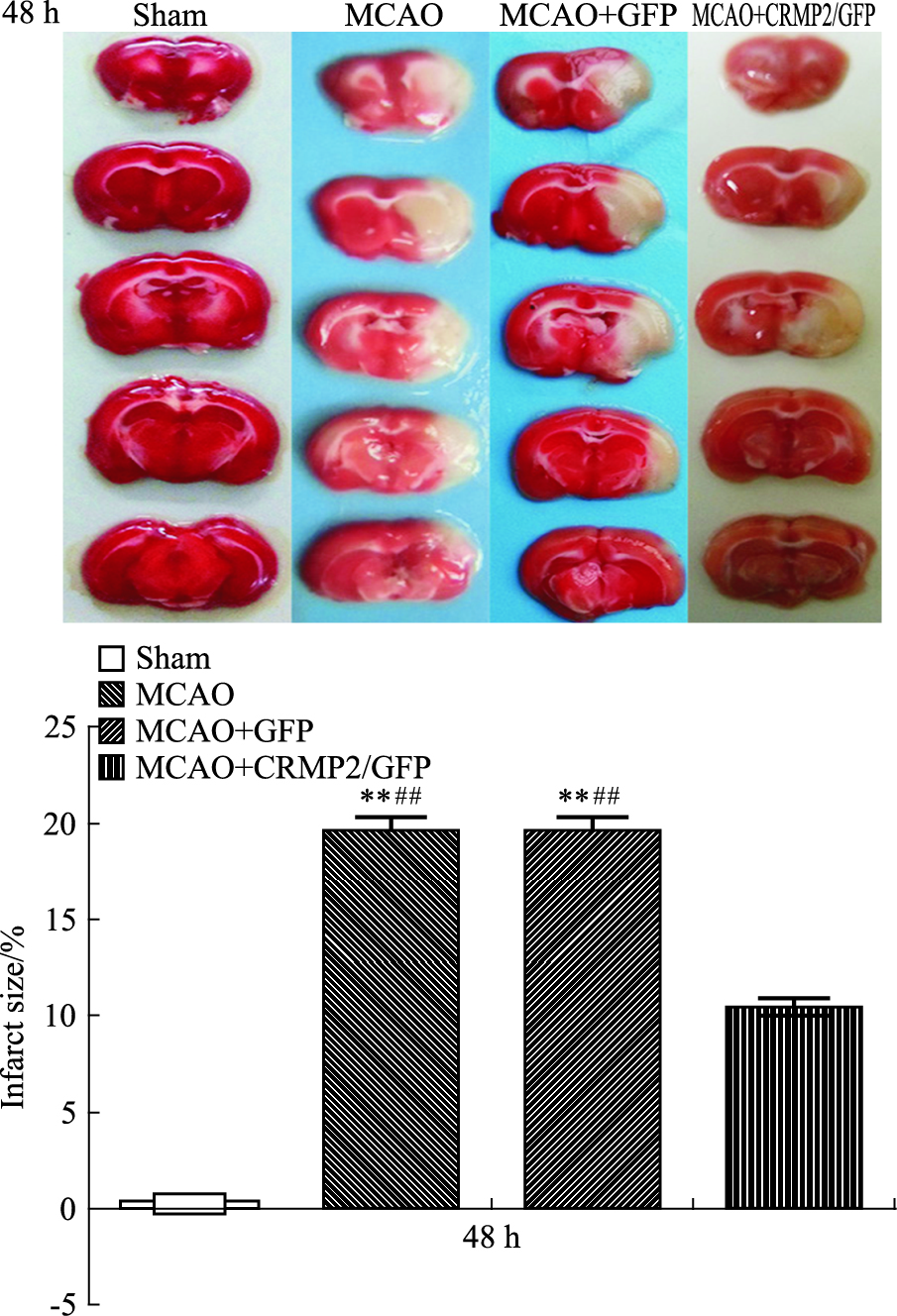
|
| Fig 5 The cerebral infarct volume of at 48h for four groups **P <0.01 vs sham group;##P <0.01 vs MCAO+CRMP2/GFP group |
| Group | 48 h | 1 wk |
| Sham | 14.9±0.220 | 14.95±0.168 |
| MCAO | 6.10±0.156** | 8.98±0.166* |
| MCAO+GFP | 5.97±0.147**## | 8.86±0.211**## |
| MCAO+CRMP2/GFP | 9.97±0.203**△△ | 11.96±0.135**△△ |
| **P <0.01 vs sham group; ##P <0.01 vs MCAO+CRMP2/GFP group;△△P <0.01 vs MCAO group | ||
脑缺血或者脑缺血/再灌注损伤的病理过程极为复杂,包括兴奋性氨基酸毒性、离子不平衡、氧化应激、炎症反应、自噬、凋亡及细胞坏死等[11]。研究证实,细胞程序性死亡在大鼠局灶性脑缺血的病理生理过程有重要的作用,导致大量神经细胞及传导束的损害[12]。脑缺血后大量神经细胞死亡,对神经功能产生严重的不良影响,而缺血半暗带区大部分神经细胞死亡以凋亡为主[13]。
大鼠脑缺血之后神经细胞的死亡通过坏死和凋亡两种机制进行[14]。在各种应激及损伤的情况下,线粒体内膜损伤释放出细胞色素C启动内源性线粒体凋亡通路,细胞色素C与凋亡蛋白酶激活因子结合,可促进Caspase-9前体的自身活化,之后激活Caspase-3前体,从而导致DNA降解,同时破坏维持细胞的完整性的必需物质[15]。线粒体凋亡途径也可以通过激活细胞膜表面死亡配体[16],如干扰素,诱导TNF相关凋亡诱导配体和Fas/FasL引起Fas相关死亡结构域蛋白的激活,后者依次激活Caspase-8及下游的Caspase家族[17],Caspase-8的激活使Bid裂开,导致线粒体膜电位瓦解并引起细胞凋亡[18]。本实验研究发现,脑缺血/再灌注后48 h及1周,过表达CRMP2使缺血侧脑皮质BCL2表达升高,而Caspase-3、Caspase-8及p53的表达降低。此外,过表达CRMP2使TUNEL阳性细胞减少,减少了脑梗死体积,并更大程度的减轻了神经功能的缺损。研究表明,p53能上调BAX并下调BCL2[15],而脑缺血组织中BCL2的表达升高可以调节线粒体膜上钙离子的内流,维持线粒体膜的完整性及调控氧化应激反应,从而改善细胞凋亡。因此,我们推测CRMP2可以通过调节内源性线粒体通路调控细胞凋亡。
同时,本实验还显示,CRMP2的过表达上调了BDNF的表达。已有研究证实,通过Slp1/Rab27B/CRMP-2/Kinesin-1通路募集TrkB传送到轴突终端是BDNF信号传输的关键[19]。BDNF可通过依赖ERK方式激活转录因子CREB和NFκB,从而增加抗凋亡基因Bcl2家族的表达,另一方面,BDNF可激活PKC,进一步调节GSK3的磷酸化。而GSK3的磷酸化是细胞存活还是死亡的重要平衡因子[20]。从而,我们推测CRMP2可能通过调节BDNF/CREB通路及BDNF/PLC/PKC/GSK3通路来影响细胞凋亡。此外,大量的钙离子在细胞内聚集,将激活凋亡蛋白酶(Caspase),引起细胞凋亡[15]。钙离子的内流受NMDA受体调控,而CRMP2又可调节NMDA受体的功能[8, 9]。因此,我们还推测,CRMP2通过BDNF/NMDA通路调节细胞内钙离子的内流,参与了对细胞凋亡的调控。这些假设将在后续的试验中进行论证。
综上所述,过表达CRMP2能够减轻脑缺血/再灌注损伤后脑组织神经细胞的凋亡反应,缩小脑缺血/再灌注后的脑梗死体积,促进神经功能的恢复。这可能与CRMP2参与调节内源性线粒体凋亡通路及BDNF相关通路(如CRMP2/BDNF/CREB、CRMP2/BDNF/PLC/PKC/GSK3以及CRMP2/BDNF/NMDA)有关。本课题组拟在今后的研究中继续探索CRMP2的神经保护作用并证实相关机制。
(致谢:本文实验在重庆医科大学神经病学重点实验室完成,在此表示感谢!)
| [1] | Liao J, Ye Z, Huang G, et al.Delayed treatment with NSC23766 in streptozotocin-induced diabetic rats ameliorates post-ischemic neuronal apoptosis through suppression of mitochondrial p53 translocation[J]. Neuropharmacology, 2014, 85(2014):508-16. |
| [2] | Sun C H, Lai X Q, Huang X Y, Zeng Y Y. Protective effects of ginsenoside Rg1 on astrocytes and cerebral ischemic-reperfusion mice[J].Biolog Pharma Bull, 2014, 37(12):1891-8. |
| [3] | Wang T, Wu X, Yin C, et al. CRMP-2 is involved in axon growth inhibition induced by RGMa in vitro and in vivo[J].Mol Neurobiol, 2013, 47(3):903-13. |
| [4] | Khanna R, Wilson S M, Brittain J M, et al. Opening Pandora's jar:a primer on the putative roles of CRMP2 in a panoply of neurodegenerative, sensory and motor neuron, and central disorders[J]. Future Neurol, 2012, 7(6):749-71. |
| [5] | Ip J P, Fu A K, Ip N Y. CRMP2:functional roles in neural development and therapeutic potential in neurological diseases[J]. Neuroscientist, 2014, 20(6):589-98. |
| [6] | Llanos S, Efeyan A, Monsech J, et al. A high-through-put loss-of-function screening identifies novel p53 regulators[J]. Cell Cycle, 2006, 5(16):1880-5. |
| [7] | Wang L H, Strittmatter S.A family of rat CRMP genes is differentially expressed in the nervous system[J]. J Neurosci, 1996, 16(19):6197-207. |
| [8] | Brittain J M, Chen L, Wilson S M, et al. Neuroprotection against traumatic brain injury by a peptide derived from the collapsin response mediator protein 2(CRMP-2)[J]. J Biol Chem, 2011, 286(43):37778-92. |
| [9] | Brittain J M, Pan R, You H, et al. Disruption of NMDAR-CRMP-2 signaling protects against focal cerebral ischemic damage in the rat middle cerebral artery occlusion model[J]. Channels(Austin), 2012, 6(1):52-9. |
| [10] | Guo J, Cheng C, Chen C S, et al. Overexpression of fibulin-5 attenuates ischemia/reperfusion injury after middle cerebral artery occlusion in rats[J]. Mol Neurobiol, 2015, Doi10.007/s/2035-015-9222-2. |
| [11] | Fisher M, Feuerstein G, Howells D W, et al.Update of the stroke therapy academic industry roundtable preclinical recommendations[J].Stroke, 2009, 40(6):2244-50. |
| [12] | Linnik M D, Zobrist R H, Hatfield M D. Evidence supporting a role for programmed cell death in focal cerebral ischemia in rats[J]. Stroke, 1993, 24(12):2002-8. |
| [13] | 宋修云, 胡金凤, 陈乃宏. 神经细胞凋亡与脑缺血疾病[J].中国药理学通报, 2012, 28(3):307-10. Song X Y, Hu J F, Chen N H. Neurons apoptosis and cerebral ischemia[J]. Chin Pharmacol Bull, 2012, 28(3):307-10. |
| [14] | Isenmann S, Stoll G, Schroeter M, et al. Differential regulation of Bax, Bcl-2, and Bcl-x proteins in focal cortical ischemia in the rat brain[J]. Brain Pathol, 1998, 8(1):49-63. |
| [15] | Saad M A, Abdel Salam R M, Kenawy S A, et al. Pinocembrin attenuates hippocampal inflammation, oxidative perturbations and apoptosis in a rat model of global cerebral ischemia reperfusion[J]. Pharmacol Rep, 2015, 67(1):115-22. |
| [16] | Ruiz-Ruiz C, López-Rivas A.Mitochondria-dependent and-independent mechanisms in tumour necrosis factor-related apoptosis inducing ligand(TRAIL)-induced apoptosis are both regulated by interferon-gamma in human breast tumour cells[J].Biochem J, 2002, 365(3):825-32. |
| [17] | de Veer M J, Holko M, Frevel M, et al.Functional classification of interferon-stimulated genes identified using microarrays[J].J Leukoc Biol, 2001, 69(6):912-20. |
| [18] | Chen Q, Gong B, Mahmoud-Ahmed A S, et al.Apo2L/TRAIL and Bcl2-related proteins regulate type Ⅰ interferon-induced apoptosis multiple myeloma[J].Blood, 2001, 98(7):2183-92. |
| [19] | Arimura N, Kimura T, Nakamuta S, et al. Anterograde transport of TrkB in axons is mediated by direct interaction with Slp1 and Rab27[J]. Dev Cell, 2009, 16(5):675-86. |
| [20] | Ortega F, Pérez-Sen R, Morente V, et al.NMDA and BDNF receptors converge on GSK3 phosphorylation and cooperate to promote survival in cerebellar granule neurons[J]. Cell Mol Life Sci, 2010, 67(10):1723-33. |

