


2. 浙江省中医药研究院, 浙江 杭州 310007
2. Zhejiang Academy of Traditional Chinese Medicine, Hangzhou 310007, China
肺癌是最常见的恶性肿瘤之一,严重危害人类的健康。尽管相关临床治疗方面研究取得重大进展,但其预后仍不理想。肿瘤转移是治疗失败的主要原因之一,临床上近一半患者在确诊时已是晚期,并发生远处转移[1]。因此,抑制转移的新药开发具有重要意义。
三叶青为葡萄科崖爬藤属植物三叶崖爬藤(Tetrastigma hemsleyanum Dielset),又名蛇附子、三叶对、金丝吊葫芦等。块根或全草入药,可清热解毒、祛风化痰、活血止痛,用于高热惊厥、肺炎、哮喘、咽痛、肝炎、风湿等症[2, 3]。抗肿瘤方面的作用也越来越受关注。三叶青对肿瘤细胞的凋亡作用有较多前期研究[4, 5],但其对肿瘤侵袭转移方面的研究尚未见报道。本研究探讨三叶青黄酮(radix tetrastigma hemsleyani flavone,RTHF)对肺癌A549细胞侵袭转移的抑制作用,为三叶青进一步开发和临床应用提供依据。
1 材料 1.1 细胞株A549细胞株由浙江省医学科学院提供,由浙江中医药大学实验室培养传代,实验中所用为生长状况良好的细胞。
1.2 药品与试剂三叶青购自浙江省中医药研究院,由浙江省中药新药研发重点实验室提取制备。Hyclone胎牛血清;RPMI 1640培养液:杭州吉诺生物医药技术有限公司。Transwell小室:美国Corning公司;Matrigel胶:美国BD公司。MMP-2、MMP-9、TIMP-2:美国CST公司。
1.3 仪器3111型CO2细胞培养箱:美国Thermo公司;3001型酶标仪:美国Thermo公司;蛋白印记检测系统:美国Bio-Rad公司;IX71型倒置显微镜:日本OLYMPUS公司。
2 方法 2.1 细胞培养培养液均为含10%胎牛血清的RPMI 1640培养液,培养条件为37℃、含5% CO2的细胞培养箱内。待细胞长满瓶底后,胰酶消化,分瓶培养,取对数生长期细胞用于实验。
2.2 MTT检测抑制率取对数生长期的A549细胞,计数细胞密度为5×107·L-1的细胞悬液,每孔100 μL细胞悬液接种于96孔板,贴壁后更换培养液并加不同浓度三叶青黄酮(0、0.5、1、5、10 g·L-1)分5组,每组6复孔;分别在24、48、72 h检测,570 nm为检测波长,统计每组各孔吸光度OD值。根据公式:抑制率/%=(1-加药组OD值/对照组OD值)×100%,计算三叶青黄酮对A549细胞的抑制率。
2.3 集落形成实验A549细胞以1 000个/孔密度接种于6孔板内,贴壁后加不同浓度三叶青黄酮(0、1、5、10 g·L-1),于37℃培养箱内培养10 d。经多聚甲醛固定,结晶紫染色10 min,蒸馏水充分清洗,在显微镜下对含50个细胞以上的克隆进行计数,并用相机对6孔板拍照。
2.4 划痕试验检测细胞迁移力将A549细胞接种于6孔板内培养,待细胞基本长满,用200 μL枪头于细胞层中纵向划痕,造成培养细胞缺损区域带,加入不同浓度的三叶青黄酮(0、1、5、10 g·L-1)继续培养24 h,倒置显微镜下观察划痕处细胞的覆盖情况。
2.5 Transwell侵袭实验检测A549细胞的侵袭力将Matrigel胶铺到transwell上室。A549细胞(2×104个细胞/孔)悬浮于含不同浓度三叶青黄酮(0、1、5、10 g·L-1)的无血清培养基中并接种在上室;下室中加含10%胎牛血清的培养基作为趋化,5% CO2、37℃孵育16 h,培养结束时,用棉签擦去上室上面的非侵袭细胞和Matrigel胶,经多聚甲醛固定,0.1%结晶紫染色。显微镜下计数细胞,取均值。
2.6 Western blot检测侵袭转移相关蛋白冰上操作,快速刮下细胞,移至1.5 mL离心管。每瓶细胞加250~500 μL RIPA裂解液,1 200 r·min-1离心5 min,收获蛋白,测定蛋白浓度。用SDS-PAGE电泳分离蛋白,将蛋白转移至PVDF膜上。5%脱脂奶粉室温下封闭1 h,一抗室温孵育2~3 h,二抗室温孵育1 h。室温下,ECL混合液滴加在PVDF膜上,避光反应3~5 min,放入蛋白印记检测系统的暗箱内,在暗室中,曝光、显影,以β-actin作为内参进行分析。
2.7 统计学方法用SPSS 13.0统计软件分析处理。统计描述:计量资料数据用x±s表示。组间比较采用方差分析。
3 结果 3.1 三叶青黄酮对A549细胞增殖的影响不同浓度三叶青黄酮作用不同时间后,A549细胞的增殖抑制率见Tab 1,各浓度对A549细胞有明显的抑制作用,随着药物浓度的增加、时间延长,其抑制作用逐步增强,呈明显的浓度、时间-效应关系。各组间差异有统计学意义(P < 0.01)。
| Time/h | Concentrations of RTHF/g·L -1 | |||
| 0.5 | 1 | 5 | 10 | |
| 24 | 4.45±0.52 ** | 8.12±2.18 ** | 25.60±3.18 ** | 57.42±2.03 ** |
| 48 | 8.97±1.05 ** | 24.91±1.17 ** | 44.80±0.66 ** | 67.60±1.23 ** |
| 72 | 25.95±0.90 ** | 46.32±0.94 ** | 68.55±0.28 ** | 72.04±0.82 ** |
| ** P < 0.01 vs control goup | ||||
与空白对照组比较,随药物浓度增加,细胞集落数量明显减少,与MTT结果相符(Fig 1)。
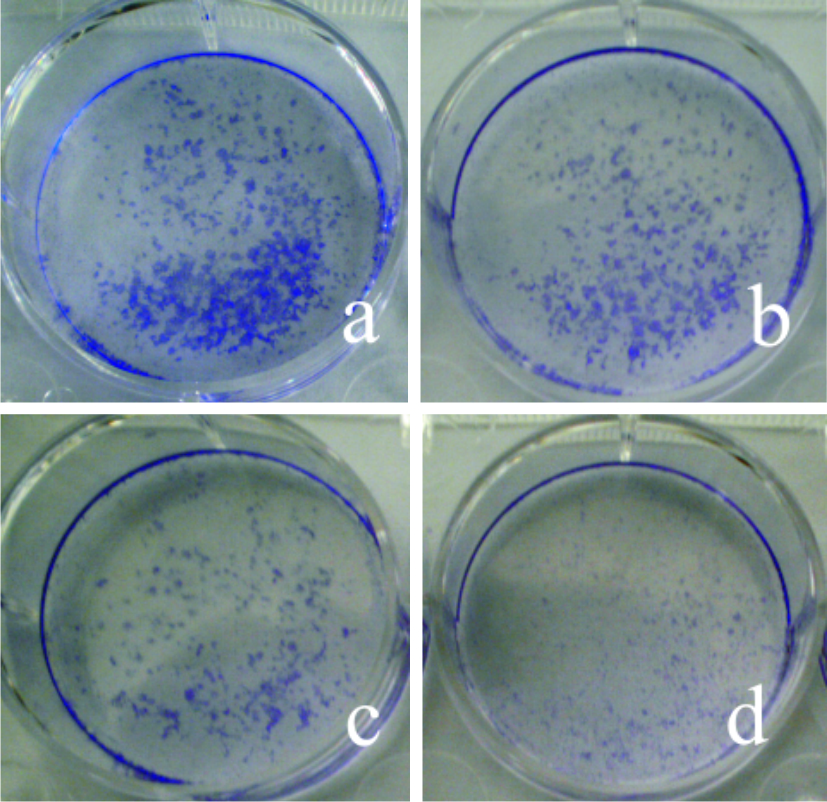
|
| Fig 1 Effects of RTHF on colone formation of A549 cells a: Control group; b: 1 g·L-1; c: 5 g·L-1; d: 10 g·L-1 |
与对照组比较,24 h时各组划痕区均出现不同程度的变窄;随着药物浓度的增高,A549细胞向划痕区的迁移速度不断减慢,10 g·L-1组细胞划痕区变窄不明显。可见三叶青黄酮抑制A549细胞的迁移存在一定的剂量依赖性(Fig 2)。

|
| Fig 2 Effects of RTHF on migration of A549 cells(40×) |
随三叶青黄酮浓度增加,侵袭的细胞明显减少,呈一定浓度依赖性。与对照组比较,三叶青黄酮1 g·L-1时侵袭A549细胞减少到65%,10 g·L-1时细胞减少到39%,差异有显著性(Fig 3)。结果表明,三叶青黄酮可明显抑制A549细胞侵袭转移。
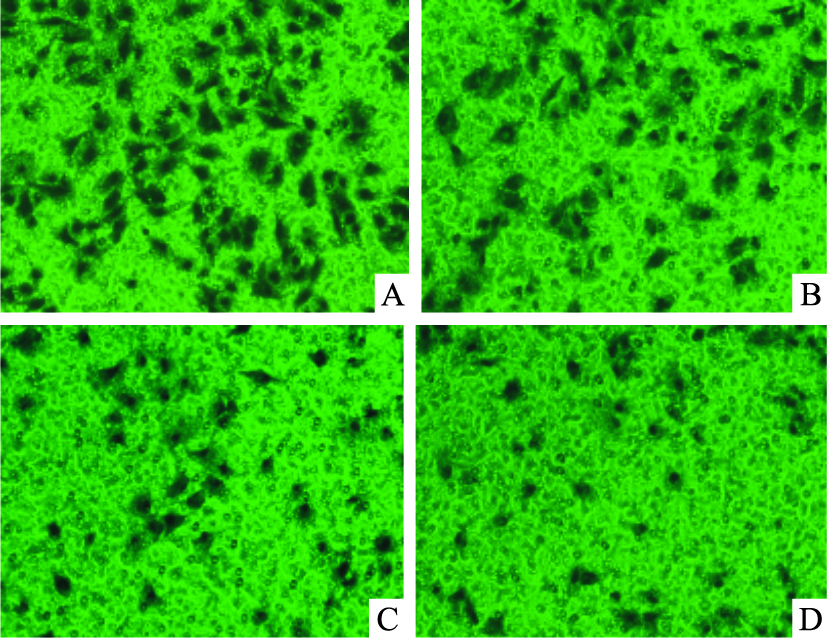
|
| Fig 3 Effects of RTHF on invasion of A549 cells(200×) A: Control group; B: 1 g·L-1; C: 5 g·L-1; D: 10 g·L-1 |
不同浓度三叶青黄酮处理A549细胞48 h后,与空白对照组相比,随着药物剂量增加,MMP-2、MMP-9蛋白表达逐渐降低;TIMP-2蛋白逐渐升高,差异明显(Fig 4)。
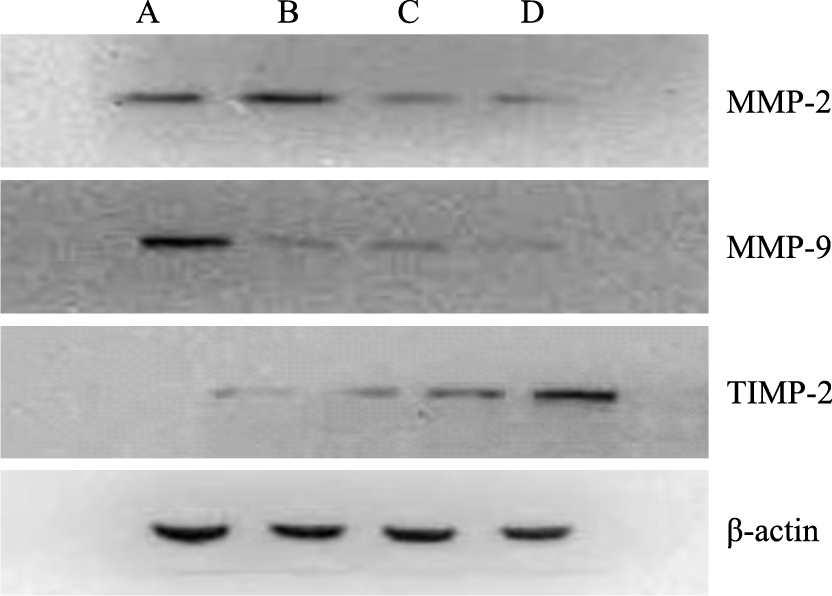
|
| Fig 4 Effects of RTHF on expressionsof MMP-2, MMP-9, and TIMP-2 in A549 cells A: Control group; B: 1 g·L-1; C: 5 g·L-1; D: 10 g·L-1 |
肿瘤治疗失败的主要原因之一是转移,控制转移是决定患者预后的关键因素之一。肿瘤转移的发生包括细胞增殖、黏附、侵袭等方面,机制复杂[6]。目前中药的抗癌机制研究受到关注,在促进凋亡、抑制增殖、侵袭转移等方面已取得突破。三叶青具有清热解毒、祛风化痰、活血化瘀、抗炎镇痛等作用;抗肿瘤方面亦具有良好治疗效果。因此,本实验深入研究三叶青抗肺癌的机制具有重要意义。
本实验通过体外实验MTT证实:三叶青黄酮能抑制人肺癌细胞株A549的增殖,且具有浓度、时间依赖性。药物浓度为10 g·L-1、作用时间72 h时,对细胞的抑制率最高,表明三叶青黄酮能够明显抑制肺癌细胞的增殖。肿瘤转移过程中,肿瘤细胞穿过细胞外基质是肿瘤细胞发生侵袭转移的重要环节[7];肿瘤细胞的侵袭有赖于细胞迁移能力的强弱。本研究通过划痕实验,显示三叶青黄酮能够抑制肺癌A549细胞的迁移,且与浓度呈正相关性。在显微镜下观察经结晶紫染色后穿透Transwell小室的A549细胞数量,随着三叶青黄酮浓度增加,细胞数量明显减少,差异有显著性。本研究证实三叶青黄酮可以明显抑制A549细胞的增殖和侵袭转移。
肿瘤细胞中存在多种蛋白水解酶降解细胞外基质(ECM)[8],金属蛋白酶家族(MMPs)在细胞外基质降解,促进肿瘤细胞迁移和转移等过程中发挥了关键作用[9],其中MMP-2和MMP-9是肿瘤细胞分泌的两个主要的蛋白酶[10]。有研究证实,抑制MMP-2可明显抑制胃癌细胞侵袭和转移[11]。MMP-9可特异性降解细胞外基质中的IV型胶原,在细胞侵袭和迁移中起到重要作用。TIMPs是内源性抑制剂,能阻断MMPs的活性。MMPs和TIMPs之间的平衡决定MMP总体活性。TIMPs的过表达被证实可减少转移,TIMP-1和TIMP-2分别与MMP-9和MMP-2有很高的亲和力[12]。研究发现,TIMP-2的高表达能抑制体内和体外内皮细胞和肿瘤细胞的侵袭[13, 14]。本实验通过Western blot检测结果显示,与对照组相比,随三叶青黄酮浓度增加,MMP-2和MMP-9蛋白表达降低,TIMP-2蛋白表达增加,提示三叶青黄酮通过调节MMPs抑制A549细胞侵袭转移。
综上所述,三叶青黄酮对肺癌A549细胞具有抑制增殖和侵袭转移作用。通过降低MMP-2和MMP-9蛋白,增强TIMP-2蛋白表达可能是其调节机制之一。
| [1] | Coleman M P, Forman D, Bryant H, et al. Cancer survival in Australia, Canada, Denmark, Norway, Sweden, and the UK, 1995-2007(the International Cancer Benchmarking Partnership):an analysis of population-based cancer registry data[J]. Lancet, 2011, 377(9760):127-38. |
| [2] | 郑军献, 胡轶娟, 梁卫青, 等.紫外可见分光光度法测定三叶青中总黄酮含量[J].中国中医药科技, 2009, 16(5):386-7. Zheng J X, Hu Y J, Liang W Q, et al. Determination of the content of total flavonoids in Radix Tetrastigma Hemsleyani by ultraviolet visible spectrophotometry[J]. Chin Med Sci Technol, 2009, 16(5):386-7. |
| [3] | Xu C J, Ding G Q, Fu J Y, et al. Immunoregulatory effects of Ethyl-acetate fraction of extracts from Tetrastigma Hemsleyanum Diels et. Gilg on immune functions of ICR mice[J]. Biomed Environm Sci, 2008, 21(4):325-31. |
| [4] | 魏克民, 丁刚强, 浦锦宝, 等.中草药三叶青抗肿瘤作用机制实验研究和临床应用[J].医学研究杂志, 2007, 36(11):41-3. Wei K M, Ding G Q, Pu J B, et al. Study on the anti-tumor mechanism and the clinical application of tetrastigma hemsleyanum Diels et. Gilg[J]. J Med Res, 2007, 36(11):41-3. |
| [5] | 钟良瑞, 魏克民.三叶青黄酮对肺癌A549细胞生长抑制与MAPKs通路关系的研究[J].中国药理学通报, 2014, 30(1):101-4. Zhong L R, Wei K M. Radix tetrastigma hemsleyani flavone suppresses human lung carcinoma A549 cell by regulating MAPKs pathway[J]. Chin Pharmacol Bull, 2014, 30(1):101-4. |
| [6] | Fidler I J. The organ microenvironment and cancer metastasis[J].Differentiation, 2002, 70(9-10):498-505. |
| [7] | Bogenrieder T, Herlyn M. Axis of evil:molecular mechanisms of cancer metastasis[J]. Oncogene, 2003, 22(42):6524-36. |
| [8] | Bohle A S, Kalthoff H. Molecular mechanisms of tumor metastasis and angiogenesis[J]. Langenbecks Arch Surg, 1999, 384(2):133-40. |
| [9] | Yang C, Dai L, Liu X G, et al. Effect of transforming growth factor betal/Smad signaling pathway on the expression and enzymatic activity of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 in cultured rat mesangial cells[J]. Chin J Pathol, 2003, 32(6):553-7. |
| [10] | Lu Z, Lu N, Li C, et al. Oroxylin A inhibits matrix metalloproteinase-2/9 expression and activation by up-regulating tissue inhibitor of metallo-proteinase-2 and suppressing the ERK1/2 signaling pathway[J]. Toxicol Lett, 2012, 209(3):211-20. |
| [11] | Guo J, Xiao B, Liu Q, et al. Suppression of C-myc expression associates with anti-proliferation of aloe-emodin on gastric cancer cells[J]. Cancer Invest, 2008, 26(4):369-74. |
| [12] | Joo Y E, Seo Y H, Lee W S, et al. Expression of tissue inhibitors of metallo-proteinases(TIMPs) in hepatocellular carcinoma[J]. Korean J Intern Med, 2000, 15(1):171-8. |
| [13] | Kim M H, Bodenstine T M, Sumerel L A, et al. Tissue inhibitor of metalloproteinases-2 improves antitumor efficacy of a replicating adenovirus in vivo[J]. Cancer Biol Ther, 2006, 5(12):1647-53. |
| [14] | Simeone A M, McMurtry V, Nieves-Alicea R, et al. TIMP-2 mediates the anti-invasive effects of the nitric oxide-releasing prodrug JS-K in breast cancer cells[J]. Breast Cancer Res, 2008, 10(3):R44. |

