


2. 中国中医科学院中药研究所, 北京 100070
霍海如(1960-),女,博士,研究员,研究方向:中药药理和药性,E-mail:hairuh@icmm.ac.com
 , WANG De-feng1, ZHOU Hai-yu2, ZHAN Hong-dan2, DAI Yi-fei2, ZHOU Wei-wei2, DAI Li2, SUI Feng2
, WANG De-feng1, ZHOU Hai-yu2, ZHAN Hong-dan2, DAI Yi-fei2, ZHOU Wei-wei2, DAI Li2, SUI Feng2
 , HUO Hai-ru2
, HUO Hai-ru2
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
TRPV1通道又被称为辣椒素受体,是瞬变感受器电位离子通道蛋白 (transient receptor potential ion channel protein,TRP) 家族中的第一个被发现和克隆的成员,由432个氨基酸组成,也是目前研究得最多的 TRP家族成员之一[1, 2]。TRPV1通道组织分布广泛,表达于背根神经节和三叉神经节的小型神经元等外周感觉神经元以及上皮、表皮以及角质细胞等组织中。其功能复杂、配体多样,可被辣椒素、树胶脂毒素(RTX)、炎性介质(如花生四烯酸代谢物)、组织损伤刺激物等激活[3]。另外,热(>43℃)、酸(pH < 5.3)、细胞外渗透压的改变、细胞内、胞内氧化还原状态等均可敏化或激活该通道[4]。现已明确,TRPV1通道与炎症、疼痛等多种病症相关,近年已成为医药界研究的热点[5]。但限于该通道的表达主要在外周感觉神经元,原代取材繁琐,操作精细,很难获得一定量的高纯度和活度的表达TRPV1受体的原位细胞。因此本研究以人胚胎肾细胞HEK 293T细胞为载体,通过瞬时转染的方式构建 TRPV1通道的异源性表达载体,为进一步探讨 TRPV1通道的功能及其分子机制,以及进一步筛选出高选择性激动剂或抑制剂打下技术和方法学基础。
1 材料 1.1 细胞与试剂HEK 293T细胞,中国医学科学院基础医学研究所。TRPV1质粒 DNA和脂质体转染试剂 Lipofectamin 2000,广州复能基因公司;DMEM培养基和新生牛血清,美国 Gibco公司;质粒大提试剂盒,美国 Omega 公司;TRPV1多克隆抗体和羊抗兔 IgG,武汉博士德公司;其余试剂均为市售分析纯。
1.2 主要仪器TE 2000-U 荧光显微镜,日本 NIKON公司;HT-300电泳仪,北京鸿涛基业科技发展有限责任公司;共聚焦显微成像系统为日本奥林巴斯,OLYMPUS公司产品;HERA Cell 150i 二氧化碳培养箱,美国 Thermo Scientific 公司;医用净化工作台,北京半导体设备一厂;BDS 260 电热三用水箱,北京医疗设备厂。
2 方法 2.1 质粒的抽提与细胞转染将质粒 DNA转化至DH5α感受态大肠杆菌中,接种到含100 mg·L-1氨苄青霉素(Amp)的LB平板上,将平板倒置于37 ℃恒温培养箱过夜。挑取单个菌落于含100 mg·L-1 Amp的 LB液体培养基,180 r·min-1,37℃过夜培养。使用试剂盒进行DNA的抽提。转染前24 h细胞接种于35 mm2平皿,细胞融合至约50%时使用脂质体转染试剂Lipofectamine 2000进行转染,每皿加质粒2 μg与脂质体4 μL。6 h后将含脂质体的培养基换成含100 mL·L-1新生牛血清、无抗生素的DMEM培养基,24 h后倒置荧光显微镜观察[6]。
2.3 Western blot 检测蛋白表达转染后24 h,用三去污裂解液提取转染细胞的总蛋白,测定浓度并分装,分别取总蛋白20 μg和40 μg与5×SDS上样缓冲液混合,进行80 g·L-1的SDS-PAGE电泳,随后电转至PVDF膜上,用含50 g·L-1脱脂奶粉的封闭液室温封闭1.5 h。用 TRPV1多克隆一抗(1:200)4℃孵育过夜。用辣根过氧化物酶(HRP)标记的羊抗兔IgG(1:1 500)室温孵育1 h,随后进行显影[7]。
2.4 共聚焦显微成像细胞转染后24 h,将细胞用质量分数为2.5 g·L-1胰酶消化,接种于事先用多聚赖氨酸处理过的共聚焦专用皿上,将培养皿放在激光共聚焦显微镜的载物台上,选定荧光显色好的细胞视野,再用氩离子激光预扫描,再根据预扫描的结果选取最清晰的焦平面进行扫描,然后随机圈定细胞,进行动态观察,同步记录背景荧光值。记录每个细胞的荧光强度变化并随机软件自动分析,细胞内[Ca2+]i 浓度变化以荧光强度值(intensity)表示,此数值与细胞[Ca2+]i变化呈正相关。所有试剂在有效剂量范围内都经证明不产生荧光干扰,染色条件和激光扫描参数在整个实验中不变[8, 9]。
3 结果 3.1 荧光显微镜观察转染HEK 293T细胞24 h后,荧光显微镜观察结果显示,在转染的HEK 293T细胞中有荧光蛋白的表达,可以认为该目的基因已成功转入细胞,见Fig1。
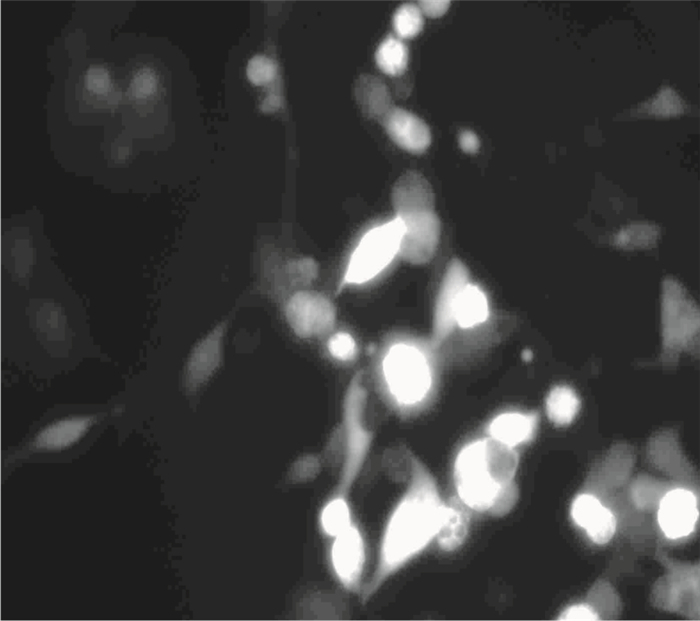
|
| Fig 1 Fluorescence site indicatestransfected HEK 293T cells(200×) |
以DRG神经组织为阳性对照,以未转染TRPV1通道的HEK 293T细胞为阴性对照(HEK 293T-),上样量40 μg,进行了蛋白印迹检测分析,结果表明,转染后的HEK 293T细胞(HEK 293T+)在100 ku左右处有一清晰条带,而空白对照组不具备此条带,如Fig2所示,蛋白印迹实验表明质粒转染成功。
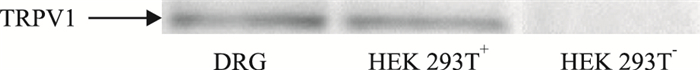
|
| Fig 2 SDS PAGE for TRPV1 channel protein |
TRPV1通道激动剂辣椒素(2 μmol·L-1)给药后,共聚焦显微镜下可见,TRPV1通道转染成功的HEK 293T细胞胞内荧光强度逐渐变强,约20 s后到达到荧光强度的最高点,然后开始下降,至给药后的150 s左右荧光强度回到给药前的状态(Fig3)。没有转染TRPV1基因的HEK 293T细胞在受到辣椒素刺激后,胞内的荧光强度未见明显变化(Fig4)。以上的研究结果提示,转染后的TRPV1通道介导钙离子的功能正常,能够通过胞内钙信号的变化执行特定的生物学效应。
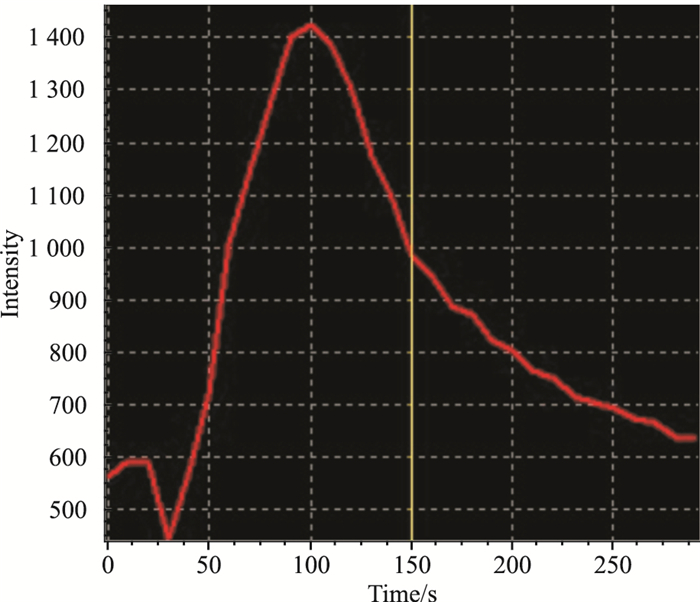
|
| Fig 3 Changing curves of intracellular fluorescence of HEK 293T+ cells post-stimulation by TRPV1 agonist |
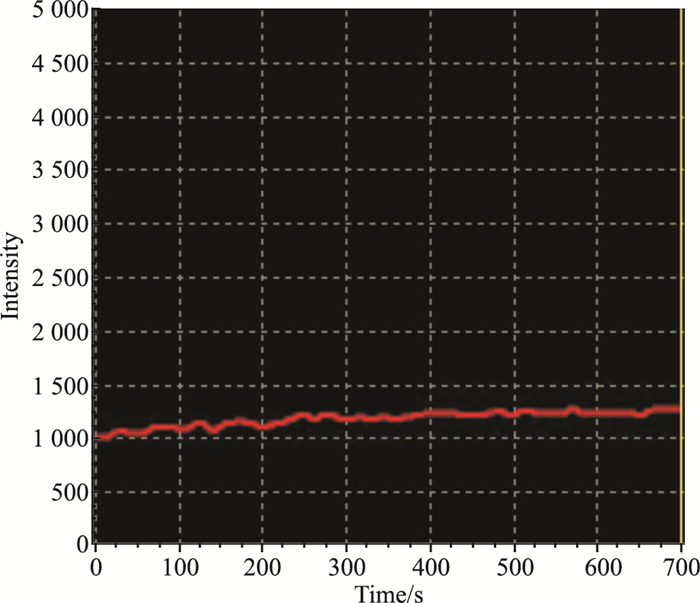
|
| Fig 4 Changing curves of intracellular fluorescenceof HEK 293T- cells post-stimulated by TRPV1 agonist |
TRPV1是目前研究最多、机制较为清楚的 TRPV亚家族成员之一,主要存在于背根神经节(DRG)和三叉神经节的较小直径细胞中[10]。近年研究表明,TRPV1通道在痛觉的产生及痛觉敏感性增强的病理发生过程中扮演着重要角色[11]。基于此,TRPV1通道业已成为止痛新药研究的新的关注药靶。有关TRPV1通道的研究,传统的方式是通过分离大鼠的背根神经节,纯化后获得一定纯度表达有一定丰度TRPV1通道的DRG神经元,我们由于实验需要,前期建立了表达TRPV1通道原代培养体系,但该方法操作繁杂、工作量大,且较难获得高纯度和高活度的神经元,不适于药物的广泛筛选研究[12]。因此,本研究通过基因转染的方式,建立了TRPV1通道的异源表达体系。研究结果显示,在HEK 293T细胞上转染TRPV1通道转染率高、蛋白表达丰度高,且功能活性良好。利用该 TRPV1的异源表达体系,系统地开展TRPV1通道激动剂或阻断剂的筛选研究,或利用该体系,对其调控和功能做进一步研究,将有助于更深入地了解TRPV1通道的功能特性,为寻找特异性的TRPV1通道功能调节相关药物奠定了基础。
(致谢:本实验在中国中医科学院中药研究所中药理论与本草文献研究中心实验室由李文兰、王德凤、周海玉、詹红丹、戴逸飞、周炜炜、戴丽、隋峰和霍海如等共同参与完成。)
| [1] | Benham C D, Davis J B, Randall A D.Vanilloid and TRP channels:a family of lipid-gated cation channels[J].Neuropharmacology, 2002, 42(7):873-88. |
| [2] | Turner H, Fleig A, Stokes A, et al.Discrimination of intracellular calcium store subcompartments using TRPV1(transient receptor potential channel, vanilloid subfamily member 1) release channel activity[J].Biochem J, 2003, 371(Pt 2):341-50. |
| [3] | Abdelhamid R E, Kovács K J, Honda C N, et al.Resiniferatoxin (RTX) causes a uniquely protracted musculoskeletal hyperalgesia in mice by activation of TRPV1 receptors[J].J Pain, 2013, 14(12):1629-41. |
| [4] | Mitchell K, Lebovitz E E, Keller J M, et al.Nociception and inflammatory hyperalgesia evaluated in rodents using infrared laser stimulation after Trpv1 gene knockout or resiniferatoxin lesion[J].Pain, 2014, 155(4):733-45. |
| [5] | Iadarola M J, Mannes A J.The vanilloid agonist resiniferatoxin for interventional-based pain control[J].Curr Top Med Chem, 2011, 11(17):2171-9 |
| [6] | Han S N, Sun X Y, Zhang Z, Zhang L R.The protease inhibitor atazanavir blocks hERG K(+) channels expressed in HEK293 cells and obstructs hERG protein transport to cell membrane[J].Acta Pharmacol Sin, 2015, 36(4):454-62. |
| [7] | Rodríguez-Penas D, Feijóo-Bandín S, García-Rúa V, et al.The adipokine chemerin induces apoptosis in cardiomyocytes[J].Cell Physiol Biochem, 2015, 37(1):176-192. |
| [8] | Sui F, Zhang C B, Yang N, et al.Anti-nociceptive mechanism of baicalin involved in intervention of TRPV1 in DRG neurons in vitro[J].J Ethnopharmacol, 2010, 129(3):361-6. |
| [9] | Sui F, Zhang C B, Yang N, et al.Emodin down-regulates expression of TRPV1 mRNA and its function in DRG neurons in vitro[J].The Am J Chin Med, 2010, 38(4):789-800. |
| [10] | Lin J G, Hsieh C L, Lin Y W.Analgesic effect of electroacupuncture in a mouse fibromyalgia model:roles of TRPV1, TRPV4, and pERK[J].PLoS One, 2015, 10(6):e0128037. |
| [11] | Ryskamp D A, Redmon S, Jo A O, Kriăaj D.TRPV1 and endocannabinoids:emerging molecular signals that modulate mammalian vision[J].Cells, 2014, 3(3):914-38. |
| [12] | 隋峰, 杜新亮, 张畅斌, 等.一种培养和纯化大鼠DRG神经元的新方法[J].中国药理学通报, 2009, 25(7):971-97. |
| [13] | Sui F, Du X L, Zhang C B, et al.A new method for primarily culturing DRG neurons of rats[J].Chin Pharmacol Bull, 2009, 25(7):971-3. |