


2. 新疆维吾尔自治区维吾尔医药研究所毒理研究室, 新疆乌鲁木齐 830049;
3. 新疆维吾尔自治区维吾尔医医院医疗设备科, 新疆乌鲁木齐 830049
李治建(1982-), 男, 硕士, 副研究员, 研究方向: 药理毒理学, 通讯作者, E-mail: lizhijian0220@sina.com
2. Xinjiang Institute of Traditional Uighur Medicine, Urumqi 830049, China;
3. Uighur Medicine Hospital of Xinjiang Autonomous Region, Urumqi 830049, China
真菌感染或真菌病按照侵犯部位可分为浅部真菌病和深部真菌病,是一种常见病、多发病,近年来呈逐渐上升的趋势,引起该病的病因比较复杂,当人体免疫力低下时,浅部真菌感染还会导致深部真菌感染。深部真菌感染一般由念珠菌、隐球菌、曲霉菌等引起,虽不如浅部真菌感染发病多,但危害性大,如不及时治疗可导致死亡[1]。鞣花酸(ellagic acid,EA)是一种没食子酸二聚衍生的天然多酚,具有抗菌、抗病毒、抗肿瘤、抗氧化、抗炎、清除自由基等作用[2, 3, 4, 5, 6, 7, 8, 9],课题组从地锦草(Euphorbia humifusa Willd)中分离得到鞣花酸,地锦草是维吾尔医经典名方“夏塔热方剂”中的君药,抗皮肤真菌作用已十分明确,用于治疗头癣、体癣、足癣、花斑癣等疾病,疗效显著[10, 11]。最近亦有国外学者报道,鞣花酸具有抗致病真菌、细菌作用[12],但仅限于体外抑菌作用的观察,未进行抗真菌药物敏感性试验筛选和体内抗真菌作用研究。本研究根据美国国家临床实验室标准化委员会(NCCLS)推荐的《酵母菌的液基稀释法抗真菌药物敏感性试验方案》(M27-A)[12],测定鞣花酸的最低抑菌浓度值(MIC)来考察其体外抗真菌活性,筛选出对其敏感的真菌菌株,进一步建立白色念珠菌感染小鼠模型,探讨鞣花酸对白色念珠菌感染动物的治疗作用。
1 材料与方法 1.1 药品与实试剂EA(上海源叶生物科技有限公司,批号:YY13933);氟康唑氯化钠注射液(fluconazole,Flu,河北天成药业股份有限公司,批号:B13070605);环磷酰胺(cyclophosphamide,Cyc,江苏恒瑞医药股份有限公司,批号:12091625);三氮吗啡琳丙磺酸(MOPS),美国Amresco公司,批号:0670;RPMI 1640培养基(含L-谷氨酰胺,不含碳酸氢钠),Invitrogen 公司,批号:31800-022;马铃薯培养基(PDA),碧迪医疗器械有限公司,批号:2263097;总超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测定试剂盒,购自南京建成生物工程研究所;二甲基亚砜(DMSO),天津永晟精细化工有限公司,批号:20120330;氢氧化钠,分析纯,天津化学试剂三厂,批号:20120802;0.9%氯化钠注射液,四川科伦药业股份有限公司,批号:20121220。
1.2 菌种光滑念珠菌(C.glabrata)1株,热带念珠菌(C.tropicalis)1株,由新疆维吾尔自治区中医院提供;白色念珠菌(C.albicans,ATCC 90028)1株,购自美国模式菌种收集中心(ATCC)。
1.3 动物昆明种小鼠60只,♀♂各半,6周龄,体质量(25±2) g左右,由新疆维吾尔自治区实验动物中心提供,动物生产许可证号:SCKK(新)2011-0001。
1.3 体外抗真菌试验 1.3.1 培养基的配制 1.3.1.1 RPMI1640培养基的配制将34.5 g MOPS粉末和10.4 g RPMI1640粉末溶于900 mL蒸馏水中,充分搅拌至完全溶解,用1.0 mol·L-1 NaOH溶液调整其pH至7.0(25 ℃),加蒸馏水定容至1.0 L,滤过灭菌,存于4 ℃冰箱备用。
1.3.1.2 PDA培养基的配制称取PDA 粉末38.0 g,加入1 000 mL蒸馏水中,摇匀,加热煮沸溶解,121℃高压灭菌20 min,分装于无菌试管,4 ℃保存,备用。
1.3.2 菌种活化将来自菌株挑取1~2个菌落,以划线接种法接种于新制备的马铃薯培养基(PDA)试管斜面中央,36℃培养48 h后进行药敏实验。
1.3.3 最低抑菌浓度值的测定根据美国国家临床实验室标准化委员会(NCCLS)推荐的《酵母菌的液基稀释法抗真菌药物敏感性试验方案》(M27-A)[13],测定鞣花酸抗真菌的最低抑菌浓度值(MIC)。
1.3.3.1 抗真菌药物储备液、稀释液的制备称取鞣花酸50.0 mg,用1 mL DMSO溶解,制成浓度为50 000 mg·L-1的储备液,存于-70 ℃冰箱备用;吸取氟康唑氯化钠注射液800 μL,加入3 200 μL RPMI1640培养液,制成浓度为400 mg·L-1的储备液,存于-70 ℃冰箱备用。
临用前将鞣花酸、氟康唑储备液,分别用RPMI-1640培养基倍比稀释成2倍试验终浓度,鞣花酸、氟康唑的2倍终浓度由高向低依次为:200、100、50、25、12.5、6.25、3.125、1.5625 mg·L-1。
1.3.3.2 菌接种液的制备将受试的念珠菌接种于PDA斜面上,36 ℃培养48 h。挑取1-2块菌落,加入2 mL无菌的0.9%的NaCl溶液中,用0.5# McFarland standard比浊管比浊,用RPMI1640液基稀释100倍后,再稀释至2倍终浓度。
1.3.3.3 接种与培养将100 μL的2倍终浓度的药液分别加入96孔细胞培养板中,并设真菌生长对照孔和空白对照孔;然后将调好的菌接种液100 μL,分别加入相应的微孔内。鞣花酸、氟康唑的试验终浓度由高向低依次为:100、50、25、12.5、6.25、3.125、1.5625、0.7813 mg·L-1。于36 ℃恒温培养箱孵育48 h读结果。
1.4 对小鼠白色念珠菌感染模型的治疗作用 1.4.1 试验分组昆明种小鼠60只,♀♂各半,6周龄,体质量(25±2) g,每组12只,按体重、性别随机分为5组。即空白组、模型组、阳性对照药氟康唑组(Flu,80 mg·kg-1·d-1)、鞣花酸高剂量(80 mg·kg-1·d-1)、鞣花酸低(40 mg·kg-1·d-1)剂量组。
1.4.2 动物模型的建立与给药白色念珠菌感染小鼠模型的建立[14, 15]:小鼠造模前3 d腹腔注射100 mg·kg-1·d-1环磷酰胺(Cyc),d 4腹腔注射1 mL 0.4×109~5×109 cfu·L-1白色念珠菌,造模后连续给药7 d(Tab 1)。观察各组小鼠一般状况及死亡情况,每天记录动物体重变化、存活时间,计算存活率。最后1次给药结束24 h后,称体重,计算死亡率。取血、离心10 min(4 000 r·min-1),按试剂盒操作测定血清中超氧化物歧化酶(SOD)、丙二醛(MDA)含量。小鼠尸体全部浇乙醇火烧处理。
| Group | Days | ||
| 1~3 | 4 | 5~11 | |
| EA:Ellagic acid; Flu:Fluconazole; Cyc:Cyclophosphamide; NS:Normal saline; OS:0.4×109~5×109 cfu·L-1 C.Albicans suspension | |||
| Control | NS 20 mL·kg-1 | ||
| Model | Cyc 100 mg·kg-1·d-1 | Cyc 100 mg·kg-1·d-1+OS 1 mL | NS 20 mL·kg-1 |
| Fluconazole | Cyc 100 mg·kg-1·d-1 | Cyc 100 mg·kg-1·d-1+OS 1 mL | Flu 80 mg·kg-1·d-1 |
| EA 80 mg·kg-1 | Cyc 100 mg·kg-1·d-1 | Cyc 100 mg·kg-1·d-1+OS 1 mL | EA 80 mg·kg-1·d-1 |
| EA 40 mg·kg-1 | Cyc 100 mg·kg-1·d-1 | Cyc 100 mg·kg-1·d-1+OS 1 mL | EA 40 mg·kg-1·d-1 |
各组小鼠处死后,取各组相同部位肝小叶,10%甲醛溶液中固定72 h后,石蜡包埋,切片厚3 μm,进行常规苏木精-伊红(HE)染色后镜检。
1.5 统计学分析应用统计软件SPSS 18.0进行统计学分析,数据以x ± s表示,组间差别用以F检验表示。
2 结果 2.1 体外抗真菌药物敏感性试验鞣花酸对白色念珠菌(C.albicans)MIC值为25 mg·L-1、光滑念珠菌(C.glabrata)大于100 mg·L-1、热带念珠菌(C.tropicalis) 为75 mg·L-1;氟康唑对C.albicans平均MIC值为12.5 mg·L-1、C.glabrata为25 mg·L-1、C.tropicalis为25 mg·L-1(Tab 2)。
| Fungi strains | Drugs | MIC/mg·L-1 |
| C.glabrata | EA | >100 |
| fluconazole | 25 | |
| C.albicans | EA | 25 |
| fluconazole | 12.5 | |
| C.tropicalis | EA | 75 |
| fluconazole | 25 |
正常对照组小鼠实验过程中均较活泼,饮食正常,皮毛整齐。模型组接种白色念珠菌后d 2开始出现皮毛不整、无光泽,倦缩驼背,活动和进食量减少,精神不振、体重下降等现象。阳性药氟康唑组和鞣花酸高剂量组小鼠生长状况给药5 d后症状有所改善,氟康唑组小鼠状况最为接近正常对照组,无死亡现象。与模型组比较,鞣花酸高剂量组小鼠体重有明显升高(P<0.01),鞣花酸低、高剂量组死亡率明显低于模型组,但剂量关系不明显(Tab 3)。
| Group | Death/n | Deathrate/% | Weight/g |
| **P<0.01 vs control;#P<0.05, ##P<0.01 vs model | |||
| Control | 0 | 0 | 30.99±0.72 |
| Model | 4 | 33.3 | 21.94±0.85** |
| Fluconazole 80 mg·kg-1 | 0 | 0 | 25.57±0.90# |
| EA 80 mg·kg-1 | 2 | 16.7 | 26.02±1.10## |
| EA 40 mg·kg-1 | 1 | 8.3 | 23.47±0.82 |
正常组小鼠血清MDA含量与模型组比较有明显降低(P<0.01),鞣花酸高、低剂量组MDA含量与模型组比较均有降低,其中鞣花酸高剂量组较为明显(P<0.05),阳性药氟康唑组MDA含量与模型组比较差异有统计学意义(P<0.01)。与模型组比较,各给药组小鼠血清中SOD均升高,其中鞣花酸高、低剂量组、氟康唑组SOD活性与模型组比较明显升高(P<0.01)(Tab 4)。
| Group | MDA/μmol·L-1 | SOD/kU·L-1 |
| *P<0.05, **P<0.01 vs control;#P<0.05,##P<0.01 vs model | ||
| Control | 7.90±0.18 | 180.98±2.87 |
| Model | 10.06±0.19* | 67.68±3.68** |
| Fluconazole 80 mg·kg-1 | 8.56±0.18## | 172.38±1.64## |
| EA 80 mg·kg-1 | 9.07±0.09# | 124.18±3.56## |
| EA 40 mg·kg-1 | 9.50±0.31 | 82.83±4.53 |
除空白对照组外,各组均具有一定程度的病变,模型组中肝组织结节状坏死,灶内肝细胞大量消失,被大量上皮样细胞、大量炎症细胞代替,可见造模较成功。阳性药氟康唑组与鞣花酸高剂量组均为略微点状坏死,肝细胞基本正常,表明炎症较轻;鞣花酸低剂量组结节状坏死,炎细胞浸润。由组织病理学观察,鞣花酸高剂量组与氟康唑组治疗效果相当,见Fig 1。
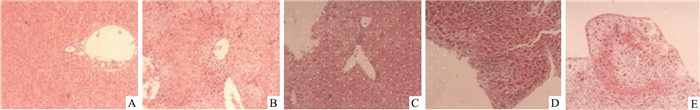
|
| Fig 1 Pathological changes of liver of each group after treatment(HE, ×400) A: Control group; B: Model group; C: Fluconazole group; D: EA 80 mg·kg-1; E: EA 40 mg·kg-1 |
随着广谱抗生素、肿瘤化疗药物、糖皮质激素和免疫抑制剂在临床的广泛应用、器官移植及导管技术的开展、艾滋病患者的不断增多,免疫功能低下患者日益增加,致病真菌引起的深部感染已经成为上述免疫功能低下患者的主要死亡原因之一,日益受到医学界的关注[16]。另外,致病真菌对现有药物的耐药性日趋严重,使得真菌感染易于发生并难于控制。因此,新型抗真菌药物的研发受到越来越多的关注。现在临床上应用的抗真菌药物在一定程度上和一定范围内起到了控制致病真菌感染的作用,但还存在许多缺点与不足,有一定副作用产生,如两性霉素B有严重的肾毒性,氮唑类药物存在严重的肾毒性与肝毒性[17]。因此,新型高效低毒抗真菌药物的研发受到越来越多的关注。
国内外文献报道,地锦草提取物和鞣花酸均有不同程度的抗真菌作用[10, 11, 12]。本试验针对鞣花酸对3株临床常见念珠菌的进行了体外抗真菌作用研究,结果鞣花酸体外抗白色念珠菌活性较好;体内鞣花酸高剂量组对小鼠白色念珠菌感染模型有明显的治疗作用,从动物死亡只数看,鞣花酸低、高剂量组分别死亡1只和2只,并无明显差异,结合其MDA、SOD结果,鞣花酸高剂量组SOD活性与模型组比较明显升高、MDA明显降低,且组织病理学观察鞣花酸高剂量组可使造模小鼠肝脏组织病理学明显改善。因此,虽然鞣花酸低、高剂量组在动物死亡只数剂量关系不明显,但结合各方面结果综合分析,鞣花酸高剂量对造模小鼠的治疗作用优于低剂量组。总之,鞣花酸体内外抗白色念珠菌作用明显。本研究为从天然药物中寻找新型抗真菌先导化合物提供一定的实验依据。
(致谢:本实验在新疆维吾尔自治区维吾尔医药研究所药理毒理实验室完成,感谢实验室老师的帮助。)
| [1] | Odds F C.Pathogenesis of Candida infections[J].Am Acad Dermatol, 1994, 31(suppl 3):2-5. |
| [2] | Edderkaoui M, Odinokova I, Ohno I, et al.Ellagic acid induces apoptosis through inhibition of nuclear factor κB in pancreatic cancer cells[J].World J Gastroenterol, 2008, 14(23):3672-80. |
| [3] | Liu N, Liu J T, Zhang Q Z.Ellagic acid-induced hypercoagulable state in animals:a potentially useful animal hypercoagulable model for evaluation of anticoagulants[J].Chin Med Sci, 2010, 25(4):237-42. |
| [4] | Panichayupakarananta P, Issuriyal A, Sirikatithaml A, Wang W.Antioxidant assay-guided purification and LC determination of ellagic acid in pomegranate peel[J].J Chromat Sci, 2010, 48(6):456-9. |
| [5] | 韩凤梅, 张晓雷, 陈勇.齐墩果酸、鞣花酸与拉米夫定体外联合抗HBV作用研究[J].湖北大学学报(自然科学版), 2009, 31(4):426-9. Han F M, Zhang X L, Chen Y.The inhibitory action of lamivudine combined with oleanolic acid or ellagic acid against hepatitis B virus in vitro[J].J Hubei Univ(Nat Sci), 2009, 31(4):426-9. |
| [6] | Soh P N, Witkowski B, Olagnier D, et al.In vitro and in vivo properties of ellagic acid in malaria treatment[J].Antimicrob Agents Chemother, 2009, 53(3):1100-6. |
| [7] | Chatterjeel A, Chatterjeel S, Das S, et al.Ellagic acid facilitates indomethacin-induced gastric ulcer healing via COX-2 up-regulation[J].Acta Biochim Biophys Sin, 2012, 44(7):565-76. |
| [8] | Aiyer H S, Gupta R C.Berries and ellagic acid prevent estrogen-induced mammary tumorigenesis by modulating enzymes of estrogen metabolism[J].Cancer Prev Res, 2010, 3(6):727-37. |
| [9] | 丁运生, 孙小虎, 李有桂, 朱凯.鞣花酸及其衍生物研究进展[J].合肥工业大学学报(自然科学版), 2008, 31(11):1809-12. Ding Y S, Sun X H, Li Y G, Zhu K.Recent progress of ellagic acid and its derivatives[J].J Hefei Univ Technol, 2008, 31(11):1809-12. |
| [10] | Li Z J, Guo X, Dawuti G, Aibai S.Antifungal activity of ellagic acid in vitro and in vivo[J].Phytotherapy Res, 2015, 29(7):1019-25. |
| [11] | 安慧霞, 古丽娜·达吾提, 李治建, 斯拉甫·艾白.地锦草有效部位抗真菌作用及其机制研究[J].中国药理学通报, 2010, 26(9):1162-5. An H X, Gulnar D, Li Z J, Silafu A.Active component of Euphorbia humifusa antifungal activity and mechanism[J].Chin Pharmacol Bull, 2010, 26(9):1162-5. |
| [12] | Bakkiyaraj D, Nandhini J R, Malathy B, Pandian S K.The anti-biofilm potential of pomegranate(Punica granatum L.) extract against human bacterial and fungal pathogens[J].Biofouling, 2013, 29(8):929-37. |
| [13] | National Committee for Clinical Laboratory Standards.Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts:Approved Standard M27-A2[P].USA, 2002. |
| [14] | Fidel P L Jr, Barousse Y, Espinosa T, et al.An intravaginal live candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis[J].Infeet Immun, 2004, 72(5):2939-46. |
| [15] | 王建钊, 王英, 顾军, 等.深部克柔念珠菌感染脉鼠模型的建立及致病性初步研究[J].临床皮肤科杂志, 2004, 33(6):331-3. Wang J Z, Wang Y, Gu J, et al.The establishment of guinea pig model infection with Candida krusei and preliminarily study[J].J Clin Dermatol, 2004, 33(6):331-3. |
| [16] | Ruddock P S, Liao M, Foster B C, et al.Garlic natural health products exhibit variable constituent levels and antimicrobial activity against Neisseria gonorrhoeae, Staphylococcus aureus and Enterococcus faecalis[J].Phytother Res, 2005, 19(4):327-34. |
| [17] | Su F W, Perumalswami P, Grammer L C.Acute hepatitis and rash to fluconazole[J].Allergy, 2003, 58(11):1215-56. |

