


2. 仁和医院, 三峡大学第二临床医学院, 湖北宜昌 443001
 , YUAN Ding1, 2, ZHOU Zhi-yong1, LIU Chao-qi1, WANG Ting1, XIANG Ting-ting1, ZHANG Chang-cheng1
, YUAN Ding1, 2, ZHOU Zhi-yong1, LIU Chao-qi1, WANG Ting1, XIANG Ting-ting1, ZHANG Chang-cheng1

2. Renhe Hospital, the Second College of Clinical Medical Science, China Three Gorges University, Yichang Hubei 443001, China
竹节参为五加科植物竹节参Panax japonicus.C.A.Mey.的根状茎及肉质块根,是我国名贵中草药,具有补虚强壮、活血祛瘀、止血祛痰等功效。竹节参的主要有效成分为竹节参皂苷,竹节参皂苷提取物主要以竹节参齐墩果烷皂苷(chikusetsu oleanane saponin,COS)为主,尚有少量达玛烷型皂苷。药理研究显示,竹节参总皂苷具有抗炎等多种药理作用[1, 2, 3],但是COS及其抗炎机制的研究报道甚少。本研究在前期研究基础上,拟建立LPS致RAW264.7细胞炎症模型,探讨COS对RAW264.7细胞的SIRT1活性影响及其抗炎作用,为竹节参的临床应用提供理论基础和实验依据。
1 材料 1.1 药品与试剂竹节参采购于湖北省恩施椿木营竹节参种植基地,经三峡大学湖北省天然产物研究与利用重点实验室邹坤教授鉴定为五加科人参属植物Panax japonicus C.A.Mey。D101大孔吸附树脂(上海勤实科技有限公司);人参皂苷Re(纯度>98%,成都植标化纯生物技术有限公司);小鼠RAW264.7细胞系购于中国科学院上海细胞库;DMEM高糖培养基(Gibco公司);胎牛血清(Scien Cell公司);脂多糖(LPS,Sigma公司);一氧化氮(NO)试剂盒(碧云天生物公司);蛋白预染marker、RIPA细胞裂解液、BCA蛋白定量试剂盒(北京普利莱基因技术有限公司);化学发光剂ECL(碧云天生物技术研究所);Triton X-100(Solarbio公司);DAPI(武汉科瑞生物技术);NF-κB p65抗体(美国Cell Signaling公司);β-actin、TNF-α、IL-1β抗体(美国Santa Cruz公司);SIRT1抗体(美国Millipore公司);PE标记山羊抗小鼠、FITC标记山羊抗兔(美国Santa Cruz公司)。
1.2 主要仪器NU-4750E型二氧化碳培养箱(Nu Aire公司),CKX41倒置显微镜(日本,Olympus公司),NIKON TP1020倒置荧光显微镜(上海衡桥仪器有限公司),CT15RT高速冷冻离心机(上海天美生化仪器设备工程有限公司),Thermo全波长酶标仪(芬兰,Tecan Inpinifetm 200)。
2 方法 2.1 COS制备将1 kg竹节参药材粉碎,加入10倍量体积分数为0.65的乙醇浸泡2 h,加热回流提取3次,每次2 h,合并、减压回收、浓缩得竹节参醇提物;水溶提取物,用正丁醇萃取直到正丁醇层几乎无色为止,分离、合并、减压回收、浓缩得到正丁醇萃取物,将萃取物上样到D101大孔吸附树脂上,用体积分数为0.95的乙醇进行梯度洗脱,将所得到的洗脱物减压浓缩干燥,即得COS,得率为16.8%。精确称取干燥的COS粉末和人参皂苷Re标准品各0.1 g,置于容量瓶中,精密加入甲醇8 mL,超声溶解,再加入甲醇定容至10 mL,摇匀过滤,加入到HPLC分析瓶中,记录COS的HPLC。应用HPLC进行指纹图谱分析,并且应用标准品进行成分鉴定。实验前用DMSO溶解配成400 g·L-1的母液,再用培养基稀释至所需质量浓度。
2.2 COS的HPLC分析色谱条件:色谱柱为YMC-pack ODS-AQ柱(250 mm×4.6 mm,粒径5 μm);流动相为乙腈(A)- 0.4%磷酸水溶液(B);柱温30 ℃;洗脱方式为梯度洗脱(0~5 min,5%~5% A;5~20 min,5%~30% A;20~30 min,30%~30% A;30~50 min,30%~85% A;50~60 min,85%~85% A);检测波长203 nm;进样量10 μL;流速1.0 mL·min-1。
2.3 细胞培养RAW264.7细胞用含10%胎牛血清的高糖DMEM培养基培养,放置于 37 ℃、5% CO2培养箱中,取对数期细胞用于实验。
2.4 COS对RAW264.7细胞生长的影响RAW264.7细胞悬液以5×104/孔接种于96孔板,每孔100 μL,贴壁4 h后,设置正常对照组(细胞+培养基)、模型LPS组(细胞+LPS)、阴性对照组(细胞+DMSO)、实验组(细胞+COS),每组4个复孔。COS给药质量浓度为25、50、100、150、200、300、400 mg·L-1,20 h后吸取上清液,在每孔中加入终浓度为0.5 g·L-1 MTT(5 g·L-1,PBS配制)10 μL,继续培养4 h后弃上清,每孔加入150 μL DMSO,置摇床上低速震荡10 min,在570 nm处测量各孔的吸光度。
2.5 不同浓度COS对LPS诱导的RAW264.7细胞释放NO的检测RAW264.7细胞悬液按2×105/孔接种于96孔板中,每孔50 μL,贴壁4 h后,加入25 μL不同浓度的COS(正常对照组或LPS模型组加入25 μL培养基)孵育2 h,给药质量浓度为 50、100、150、200、300 mg·L-1,每组4个复孔,再加入25 μL终浓度为1 mg·L-1的LPS刺激(正常对照组加入25 μL培养基)20 h,Griess法测定上清液中NO含量。
2.6 Western blot法检测RAW264.7细胞TNF-α、IL-1β表达RAW264.7细胞悬液按1×106/孔接种于6孔板,每孔1 mL,4 h贴壁后,先加入100、200、300 mg·L-1的COS 500 μL(正常对照组或LPS模型组加入500 μL培养基)孵育2 h,再加入1 mg·L-1 LPS 500 μL刺激(正常对照组加入500 μL培养基)20 h后,提细胞总蛋白,采用BCA蛋白定量法检测各组细胞蛋白浓度,95℃灭活蛋白5 min,SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉封闭1 h,一抗孵育4℃过夜,二抗室温孵育1 h,ECL显色。
2.7 SIRT1、NF-κB的免疫荧光分析取对数期RAW264.7细胞悬液(调细胞密度为1×106/孔)每孔1 mL接种于6孔板内无菌盖玻片上,待细胞贴壁50%即可给予300 mg·L-1的COS 500 μL干预(正常对照组或LPS模型组加入500 μL培养基),孵育2 h后加入1 mg·L-1 LPS 500 μL刺激(正常对照组加入500 μL培养基)12 h后,弃去培养基,在6孔板中将已经爬好细胞的爬片用PBS浸洗3次,每次5 min;4%多聚甲醛固定爬片20 min,PBS浸洗3次,每次5 min;1%Triton X-100(PBS配制)37℃通透30 min,PBS浸洗3次,每次5 min;滴加5%山羊血清37℃封闭1 h,弃掉封闭液,直接加入一抗(1 ∶100,PBS稀释)4℃过夜;24 h后PBS浸洗3次,每次5 min,再加入荧光二抗(1 ∶200,PBS稀释)37℃避光孵育1 h,PBS浸洗3次,每次5 min;滴加DAPI避光孵育5 min,PBS浸洗3次,每次5 min,甘油封片,激光共聚焦显微镜下观察采集图像。
2.8 统计学处理采用GraphPad Prism 5软件,Western blot结果采用Image J软件分析,计量资料采用x±s,n=6表示,全部数据采用SPSS 18.0统计软件进行分析,以单因素方差分析进行多组比较。
3 结果 3.1 HPLC图谱结果将竹节参皂苷提取物再经过大孔树脂进一步分离,并进行HPLC图谱分析。竹节参提取物主要含5个皂苷成分,即人参皂苷Re、竹节参皂苷Ⅴ、竹节参皂苷Ⅱ、竹节参皂苷Ⅳ和竹节参皂苷Ⅳa[4]。Fig 1中达玛烷型人参皂苷Re已经几乎没有,而其它4种齐墩果烷型皂苷含量较高,未见多糖吸收峰。因此得出,体积分数为0.95的乙醇洗脱大孔树脂所得的皂苷是COS,即竹节参皂苷Ⅴ、竹节参皂苷Ⅱ、竹节参皂苷Ⅳ和竹节参皂苷Ⅳa。
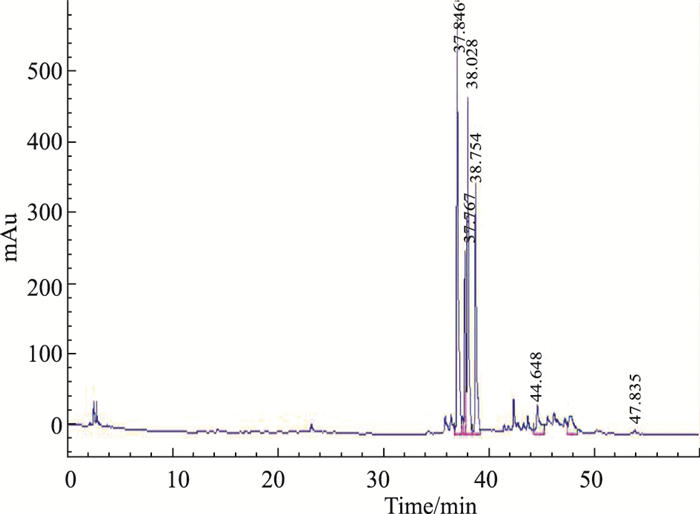
|
| Fig 1 90% ethanol elution of Panax japonicus saponins by HPLC analysis |
当COS在25~300 mg·L-1与 1 mg·L-1LPS共培养时,与正常对照组相比,对RAW264.7细胞生长无明显影响;400 mg·L-1时,表现出明显的细胞生长抑制效应,即细胞活力明显下降至53.2%,见Fig 2。

|
| Fig 2 Effect of COS on viability of RAW264.7 cells #P<0.05 vs control |
如Fig 3所示,与正常对照组相比,1 mg·L-1LPS刺激24 h后,RAW264.7细胞释放NO的量明显增加,表明LPS能明显诱导 RAW264.7细胞释放NO;与LPS组相比,COS能较好地抑制NO释放,并呈良好的剂量依赖性。
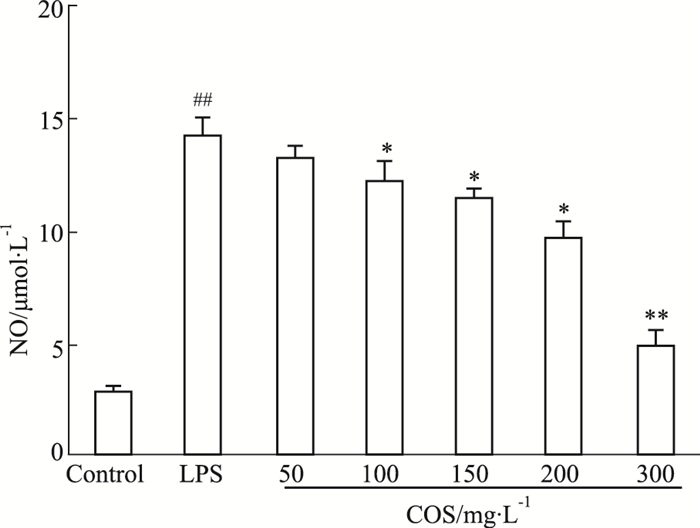
|
| Figure 3 Effect of NO release after intervention of COS in RAW264.7 cells stimulated by LPS ##P<0.01 vs control; *P<0.05, **P<0.01 vs LPS group |
与正常组相比,LPS组的TNF-α表达升高,IL-1β表达明显升高(P<0.01),而在COS组分存在时,TNF-α和IL-1β的表达则受到明显抑制,并表现一定的剂量依赖性关系,见Fig 4。
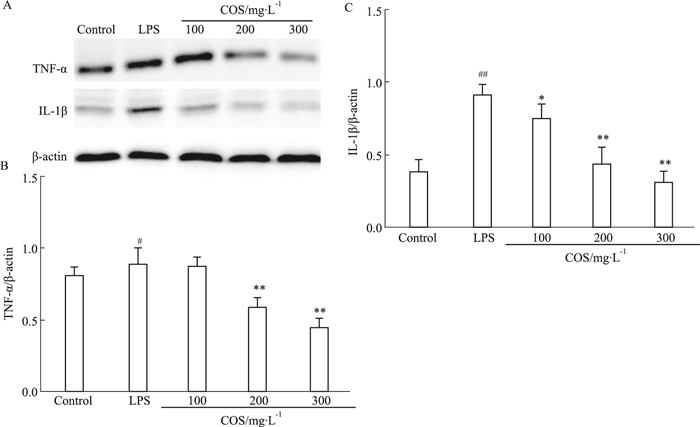
|
| Fig 4 Effect of TNF-α and IL-1β expression after intervention oon after intervention of COS in RAW264. 7 cells stimulated by LPS #P<0.05 ,##P<0.01 vs control; *P<0.05, **P<0.01 vs LPS group |
如Fig 5所示,DAPI将细胞核染成蓝色,染成红色的为NF-κB阳性细胞,及将图片叠加的结果。对于NF-κB来说,正常对照组中几乎所有细胞中NF-κB主要集中在胞质部位,使胞质染色较深,反映NF-κB为无活性状态;LPS组NF-κB阳性主要集中在胞核部位,反映NF-κB为活化状态;COS组NF-κB活化细胞明显少于LPS组。
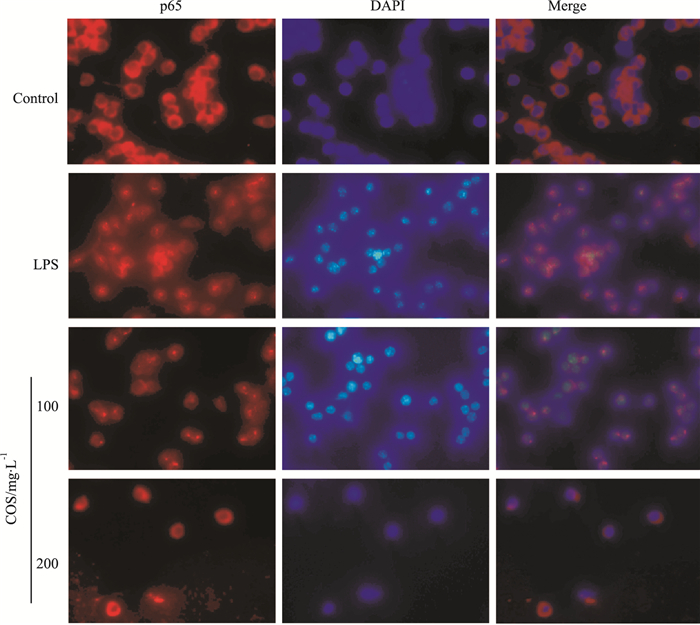
|
| Fig 5 Effect of COS on NF-κB p65 translocation in RAW264.7 cells observed under LSCM |
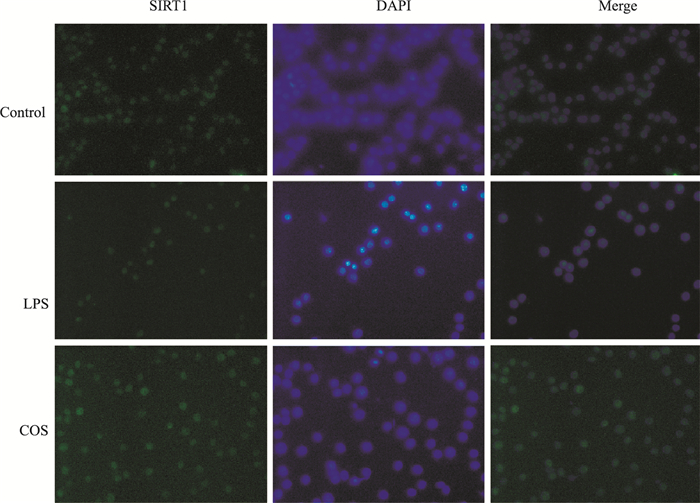
如Fig 6所示,染成蓝色的是细胞核,染成绿色的为SIRT1,第3列图片均为前两张重合的结果。和正常对照组相比,LPS组中SIRT1的表达降低,COS处理后,SIRT1的表达增加。由此得出,LPS诱导可使细胞表达SIRT1蛋白降低,COS可以促进SIRT1蛋白的表达。
|
| Fig 6 Effect of COS on SIRT1 translocation in RAW264.7 cells observed under LSCM |
炎症是机体对外界刺激的适应性反应,是十分常见而又重要的基本病理过程,具有防御和损伤双重效应。巨噬细胞是主要的炎性细胞,LPS即革兰氏阴性菌细胞壁组成成分,是引发机体炎症的重要物质。研究发现,当巨噬细胞受到LPS刺激时活化TLR4受体,会释放NO、IL-1β、TNF-α等重要的炎症细胞因子[3, 5, 6]。TNF-α和IL-1β是由单核-巨噬细胞和内皮细胞分泌产生的一种重要的前炎细胞因子,是早期炎症的标志物,介导炎症反应。NF-κB是一种介导细胞内信号转导的早期核转录因子,NF-κB p65是NF-κB转录因子家族的重要成员,在炎症反应中发挥关键作用。炎症反应各阶段的很多分子都受NF-κB的调控。在静息状态下,NF-κB与其抑制因子IκB形成复合体,使NF-κB以无活性的形式存在于胞质中。当受到刺激后,IκB激酶复合体(Iκ kinase,IKK)活化,使IκB磷酸化而酶解,从而能使NF-κB与IκB解离,游离的NF-κB迅速易位到细胞核,与DNA相关元件结合,诱导TNF-α、IL-1β的细胞因子的产生,介导炎症反应。
SIRT1是一种依赖烟酰胺腺嘌呤二核苷酸的组蛋白去乙酰化酶,与细胞衰老、炎症反应、抗氧化应激和能量代谢调节等细胞多种功能活动有关。越来越多的研究发现,NF-κB的活性受SIRT1的调节,SIRT1可直接去乙酰化NF-κB的p65亚基第310位的赖氨酸残基,RelA/p65亚单位不能与IκBα结合,从而使NF-κB进入核内,诱导相关基因表达。进而抑制NF-κB的活性,从而抑制下游基因的表达[7]。
研究发现,齐墩果烷型皂苷经水解后可产生齐墩果酸,齐墩果酸具有抗炎、抗氧化[8, 9]等多种生物活性。本实验通过对竹节参回流提取、正丁醇萃取所得竹节参总皂苷提取物进行进一步分段(体积分数为0.95的乙醇洗脱物),应用HPLC对其进行指纹图谱分析,并且应用标准品进行成分鉴定,发现体积分数为0.95的乙醇洗脱物主要成分为COS。有研究报道,齐墩果烷皂苷具有抗炎活性[10]。本研究发现,经LPS诱导的RAW264.7细胞SIRT1表达减少,使入核的NF-κB蛋白增加。COS可以促进SIRT1蛋白的表达,抑制NF-κB的核移位,从而减少TNF-α、IL-1β等炎症因子的产生。本实验结果提示,COS可以激活SIRT1,对LPS诱导的RAW264.7细胞具有保护作用,其机制可能是SIRT1通过去乙酰化作用于NF-κB的p65亚基第310位的赖氨酸残基,抑制NF-κB的核移位,进而减少TNF-α、IL-1β等炎症因子的产生。由此我们相信SIRT1可作为抗炎治疗的靶点。
(致谢:本实验完成于三峡大学医学院国家中医药管理局中药药理科研三级实验室。感谢医学院实验中心和肿瘤微环境与免疫治疗湖北省重点实验室对本课题提供的支持与帮助,感谢本课题组全体老师和同学对我实验的帮助。)
| [1] | 代艳文, 袁丁, 万静枝, 等.竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究[J].中国中药杂志, 2014, 39(11):2076-80.Dai Y W, Yuan D, Wan J Z, et al.Study on protective effect of total saponins of Panax japonicus on LPS-induced RAW264.7 cell inflammation through NF-kappaB pathway[J].Chin J Chin Mat Med, 2014, 39(11):2076-80. |
| [2] | 代艳文, 杨莉, 万静枝, 等.竹节参醇提物对LPS诱导RAW264.7细胞炎症的保护作用[J].中国实验方剂学志, 2014, 20(2):163-6.Dai Y W, Yang L, Wan J Z, et al.Protective effect of panax japonicus ethanol extract on the inflammation of RAW264.7 cells induced by LPS[J].Chin J Exp Tradit Med Form, 2014, 20(2):163-6. |
| [3] | Wang T, Dai Y, Dun Y, et al.Chikusetsusaponin V inhibits inflammatory responses via NF-κB and MAPK signaling pathways in LPS-induced RAW 264.7 macrophages[J].Immunopharmacol Immunotoxicol, 2014, 36(6):404-11. |
| [4] | 李玉洲, 何毓敏, 孙志伟, 等.不同栽培年限竹节参中主要成分含量的动态变化[J].安徽农业科学, 2011, 39(33):20411-3.Li Y Z, He S M, Sun Z W, et al.Study on the dynamic variation of the main constituents of P.japonicas in different cultivating years[J].J Anhui Agri, 2011, 39(33):20411-3. |
| [5] | 李晓红, 齐云, 蔡润兰, 等.芦荟大黄素对LPS诱导的RAW264.7细胞NO生成及iNOS表达的影响[J].中国药理学通报, 2010, 26(4):488-92.Li X H, Qi Y, Cai R L, et al.Effect of lipopolysaccharide-induced expression of inducible nitric oxide synthase by aloe-emodin in RAW264.7 cells[J].Chin Pharmacol Bull, 2010, 26(4):488-92. |
| [6] | 蔡海兰, 黄晓君, 聂少平, 等.铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响[J].中国药理学通报, 2012, 28(11):1553-6.Cai H L, Huang X J, Nie S P, et al.Effects of polysaccharides from dendrobium officinale on the production of TNF-α by RAW264.7 cells[J].Chin Pharmacol Bull, 2012, 28(11):1553-6. |
| [7] | Jung Y J, Lee J E, Lee A S, et al.SIRT1 overexpression decreases cisplatin-induced acetylation of NF-κB p65 subunit and cytotoxicity in renal proximal tubule cells [J].Biochem Biophys Res Commun, 2012, 419(2):206-10. |
| [8] | 张明发, 沈雅琴.齐墩果酸和熊果酸的抗炎及其抗变态反应[J].抗感染药学, 2011, 8(4):235-40.Zhang M F, Shen Y Q.Anti-inflammation and anti-allergy of oleanolic acid and ursolic acid[J].Anti Infect Pharm, 2011, 8(4):235-40. |
| [9] | 唐初, 陈玉, 柏舜, 等.齐墩果酸的结构修饰与生物活性研究进展[J].有机化学, 2013, 8(1):46-65.Tang C, Chen Y, Bai Y, et al.Advances in the study of structural modification and biological activities of oleanolic acid[J].J Org Chem, 2013, 8(1):46-65. |
| [10] | Li W, Yan X T, Sun Y N, et al.Anti-inflammatory and PPAR transactivational effects of oleanane-type triterpenoid saponins from the roots of pulsatilla koreana[J].Biomol Ther (Seoul), 2014, 22(4):334-40. |