


2. 广西医科大学第一附属医院老年呼吸内科, 广西 南宁 530021
2. Dept of Geriatric Respiratory Medicine, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
流行病学资料显示,肥胖会增加哮喘的发病风险,在成人是2~3倍[1],儿童是1~2倍[2]。且合并肥胖的哮喘具有进展迅速、药物效果差、皮质类固醇激素类药物不敏感等特点,影响病人的治疗效果及预后。为研究肥胖合并哮喘的发病机制及治疗策略,合适的动物模型就显得尤为重要。目前,国内外研究肥胖哮喘模型制作缺乏系统完善的评价,呼吸功能测定往往需要麻醉小鼠后行气管插管,与人类哮喘发作时的状态相差甚远。营养性肥胖合并哮喘造模周期都相对较长,哪种实验动物更能提高造模的成功率,更接近人类肥胖哮喘的疾病特点,目前鲜见报道。本实验通过建立3种常用品系的小鼠营养性肥胖哮喘模型,比较肥胖及哮喘相关指标的差异,为营养性肥胖合并哮喘小鼠模型的制作提供参考。
1 材料 1.1 动物所有小鼠均为SPF级3~4周龄断乳♀小鼠。 C57BL/6J小鼠体质量12~14 g,购于广东省医学动物实验中心,生产许可证号SCXK(粤)2008-0002。KM小鼠体质量16~20 g,BALB/c小鼠体质量12~14 g,均购于广西医科大学动物实验中心,生产许可证号:SCXK桂2003-0003。
1.2 试剂血清甘油三酯、总胆固醇测定试剂盒:北京利德曼生化股份有限公司。小鼠OVA特异性IgE测定ELISA试剂盒:美国Biolegend公司。OVA(鸡卵清蛋白,Grade V):美国Sigma公司。氢氧化铝凝胶(浓度40 g·L-1):美国Pierce公司。
1.3 仪器酶标仪(MK3型):美国Thermo公司。全密闭真空组织脱水机(HD-300)、石蜡包埋机(YB-6LF):湖北惠达仪器有限公司。石蜡切片机(Eeisshm340e):德国蔡司公司。正置荧光显微镜及成像系统(CX41-32):日本奥林巴斯公司。显微图像分析系统Image-Pro Plus。无创动物肺功能仪(TBL4500型): 美国BUXCO公司。
2 方法 2.1 动物分组及模型制备KM、C57BL/6J、BALB/c小鼠经3 d适应性喂养后,随机分为对照组、哮喘组、肥胖组和肥胖哮喘组,每组8只。饲养于SPF环境(设施许可证 SCXK桂2003-0003),保持温度(23±3)℃,湿度(55.5±10)%,给予颗粒饲料,自由饮水。对照组及哮喘组给予常规饲料(脂肪供能比0.123);肥胖组和肥胖哮喘组给予高脂饲料(脂肪供能比0.430),每周测量身长及体重变化。饲养12周后,哮喘组和肥胖哮喘组每只小鼠分别于d 0、7、14给予OVA混悬液(OVA 25 μg、氢氧化铝凝胶4 mg溶于20 μL PBS液中)腹腔注射,d 21起给予质量浓度为10 g·L-1 OVA 30 mL雾化吸入,隔日1次,每次30 min,连续5次。于饲养16周,各组小鼠禁食12 h行肺功能检测,摘眼球取血,离心分离血清,测定甘油三酯、总胆固醇。取支气管肺泡灌洗液进行OVA特异性IgE水平测定。解剖取左肺上叶进行HE染色,进行肺组织细胞病理形态学观察。
2.2 Lee′s指数实验终点测量小鼠体重、体长(小鼠鼻尖到肛门外沿的距离)。计算Lee′s指数[3]=[体重(g)1/3/体长(cm)× 1 000]。
2.3 脂肪重量精确分离腹腔内(包括肠系膜、大网膜、双侧肾周及生殖器周围)脂肪组织,称湿重后,进行脂肪细胞形态学观察和计量。
2.4 脂肪细胞形态观察计量脂肪组织进行石蜡包埋,HE染色,参照Ketonen等[4]的研究方法对脂肪细胞进行形态计量:每只动物40倍物镜随机5张显微照片,使用Image-Pro Plus7.0显微分析系统测量脂肪细胞横截面面积。
2.5 支气管肺泡灌洗液(BALF)中IgE水平测定酶联免疫吸附法测定哮喘模型小鼠BALF中IgE的表达量。
2.6 小鼠sRaw增长率BUXCO TBL4500型无创动物呼吸机(美国)测定小鼠特殊气道阻力(specific airway resistance,sRaw,cm H2O×sec)。sRaw增长率=(吸入不同浓度乙酰甲胆碱后sRaw测定值-吸入PBS后sRaw测定值)/吸入PBS后sRaw测定值。
2.7 统计学分析实验数据采用SPSS 19.0软件进行统计,计量资料以x±s表示,采用单因素方差分析进行比较,先行方差齐性检验,两两比较采用LSD检验。
3 结果 3.1 肥胖评价指标 3.1.1 体重增长曲线3个品系的小鼠经高脂饲料喂养后,体重表现出与正常喂养组相比更加迅速的增长趋势,其中KM小鼠体重增长更加明显,且差异达到显著性的周期是3个品系中最短的。在实验终点,BALB/c肥胖小鼠及C57BL/6J肥胖小鼠体重较之正常组差异亦有显著性,但前者更加明显(Fig1)。
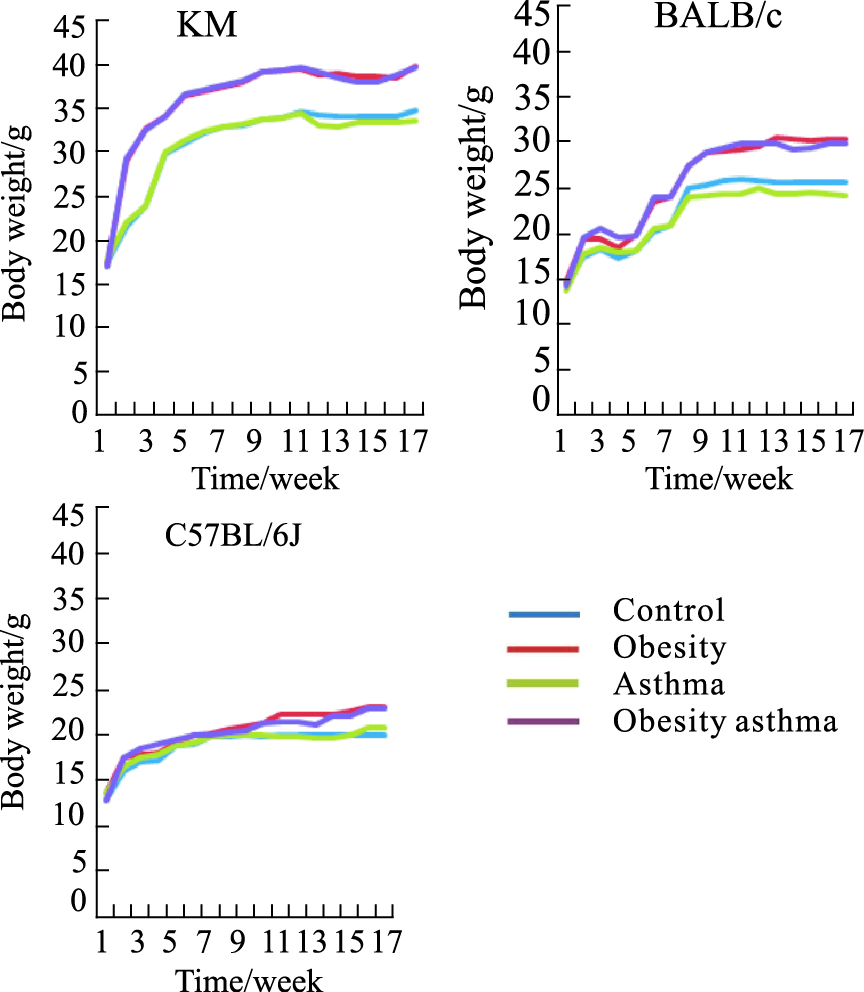
|
| Fig.1 Growth of body weight |
实验终点,3个品系小鼠体质量、脂肪重量、肝脏重量、Lee′s指数与对照组比较均升高。与单纯哮喘组相比,肥胖哮喘组KM小鼠及BALB/c小鼠体质量、脂肪重量、肝脏重量、Lee′s指数等肥胖指标差异均有显著性(P<0.01),C57BL/6J小鼠肥胖哮喘组与单纯哮喘组比较,体质量、Lee′s指数差异有显著性(P<0.05),脂肪重量及肝脏重量差异无显著性(Tab1)。
| Group | Body weight/g | Fat wwt/g | Liver weight/g | Lee′s index | |
| KM | Control | 34.83±1.60 | 0.95±0.32 | 1.50±0.32 | 15.73±0.46 |
| Obesity | 39.83±2.05 ** | 2.16±0.65 ** | 1.99±0.21 ** | 16.25±0.27 * | |
| Asthma | 33.65±1.43 | 0.71±0.29 | 1.26±0.23 | 15.10±0.24 | |
| Obese asthma | 39.76±2.80 ## | 2.90±0.83 ## | 1.98±0.12 ## | 15.83±0.48 ## | |
| BALB/c | Control | 25.65±1.01 | 0.33±0.20 | 0.92±0.08 | 14.64±0.23 |
| Obesity | 30.35±2.54 ** | 0.72±0.09 ** | 1.25±0.19 * | 15.35±0.39 ** | |
| Asthma | 24.28±0.54 | 0.33±0.20 | 0.87±0.06 | 14.53±0.17 | |
| Obese asthma | 29.94±1.87 ## | 0.71±0.20 ## | 1.09±0.06 ## | 15.25±0.49 ## | |
| C57BL/6J | Control | 20.05±1.34 | 0.21±0.09 | 0.93±0.06 | 13.48±0.32 |
| Obesity | 23.13±1.27 * | 0.40±0.08 * | 1.19±0.07 ** | 14.20±0.32 ** | |
| Asthma | 20.85±0.77 | 0.38±0.13 | 0.85±0.09 | 13.66±0.12 | |
| Obese asthma | 22.92±0.90 # | 0.48±0.21 | 0.90±0.12 | 13.92±0.17 # | |
| * P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs asthma | |||||
与刘芳等[5]研究结果有所出入,实验终点KM高脂饲料喂养的小鼠脂肪细胞横截面积与正常饲料喂养组比增加明显(P<0.01),BALB/c小鼠脂肪细胞变化不及KM小鼠明显,但差异有显著性(P<0.05),C57BL/6J小鼠脂肪细胞面积较对照组无明显差异(Fig2、3)。

|
| Fig.2 Photomicrographs of adipose tissue in mice(HE×400) |
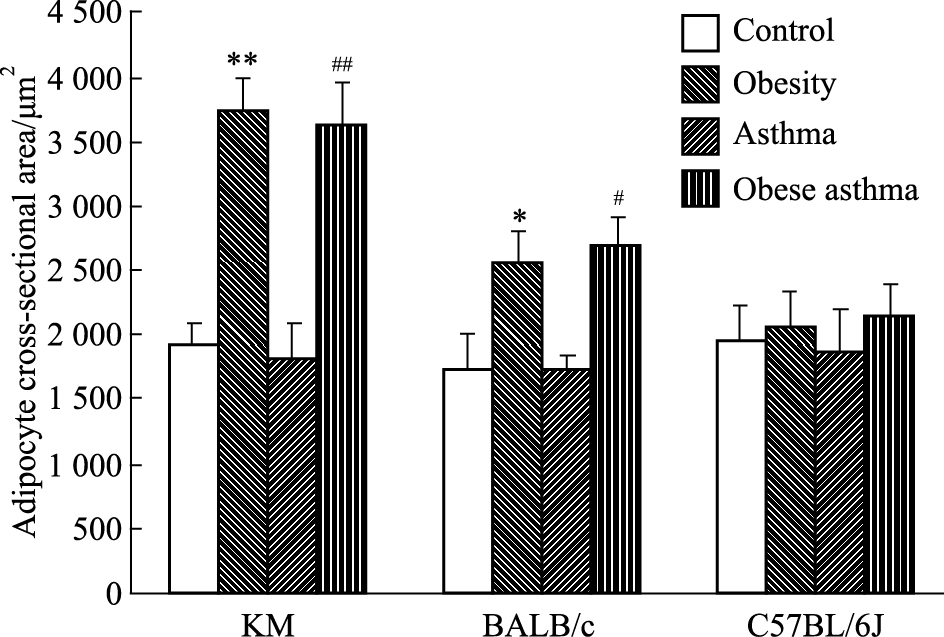
|
| Fig.3 Changes of adipocyte cross-sectional area in mice(x±s,n=8) *P < 0.05,**P < 0.01 vs control;#P < 0.05,##P < 0.01 vs asthma |
经高脂饲料诱导后,KM小鼠及BALB/c小鼠血清总胆固醇(TC)水平较普通饲料喂养的小鼠均表现出明显的增高,说明已出现高胆固醇血症脂代谢紊乱。C57BL/6J小鼠增高,但差异无显著性,说明未出现高胆固醇血症脂代谢紊乱。与刘芳等[5]研究结果相似,3个品系高脂饲料喂养的小鼠较之正常喂养的小鼠甘油三酯并未表现出明显的增高(Tab2)。
| Group | TC/mmol·L -1 | TG/mmol·L -1 | |
| KM | Control | 2.88±0.45 | 1.43±0.65 |
| Obesity | 3.78±0.63 * | 0.57±0.12 * | |
| Asthma | 2.04±0.23 | 0.75±0.15 | |
| Obese asthma | 3.52±0.55 ## | 1.01±0.10 ## | |
| BALB/c | Control | 3.17±0.19 | 1.36±0.52 |
| Obesity | 3.66±0.45 * | 1.09±0.14 | |
| Asthma | 3.19±0.20 | 0.67±0.41 | |
| Obese asthma | 4.02±0.25 ## | 1.44±0.38 ## | |
| C57BL/6J | Control | 3.71±0.62 | 1.10±0.17 |
| Obesity | 4.22±0.24 | 0.46±0.10 ** | |
| Asthma | 2.06±0.29 | 0.66±0.17 | |
| Obese asthma | 2.82±1.13 | 0.66±0.18 | |
| *P<0.05, **P<0.01 vs control; ##P<0.01 vs asthma | |||
BALB/c及C57BL/6J哮喘小鼠在雾化激发过程中,不同程度出现头、鼻、面部搔抓动作,进而呼吸加深加快,躁动不安,后期表现先为少动、弓背、前肢缩抬、点头呼吸及呼吸急促表现,部分BALB/c小鼠出现呼吸减慢、行为迟滞或俯伏不动,反应迟钝,KM小鼠仅表现为少动及前肢缩抬,且在后面几次雾化激发过程中,上述症状逐渐减轻。正常对照及单纯肥胖组小鼠活动自如,无上述表现。
3.2.2 肺组织病理损害如Fig4所示,3个品系正常组及肥胖组小鼠细支气管和肺泡清晰,无炎症细胞浸润;BALB/c品系哮喘组及肥胖哮喘组小鼠出现细支气管周围炎症细胞浸润,黏膜皱襞减少等气道炎症及气道重塑表现,较之哮喘组,肥胖哮喘组炎症改变更甚,炎症细胞浸润更明显,黏膜及平滑肌有断裂,肺泡不同程度融合表现,肥胖哮喘组小鼠表现更为明显,并出现平滑肌及基底膜增厚等气道重塑表现。C57BL/6J小鼠改变相对轻微,KM品系哮喘小鼠气道炎症细胞数量非常少,未见明显气道重塑表现。

|
| Fig.4 Photomicrographs of lung tissue in mice(HE×200) |
sRaw是反映哮喘模型气道高反应性的敏感指标。不同乙酰甲胆碱浓度雾化后,sRaw增长率能较好地反映气道阻力的变化。3个品系经OVA致敏和激发后的哮喘小鼠均表现出sRaw增长率逐步增高的趋势,以BALB/C哮喘及肥胖哮喘组增高最为明显(Fig5)。
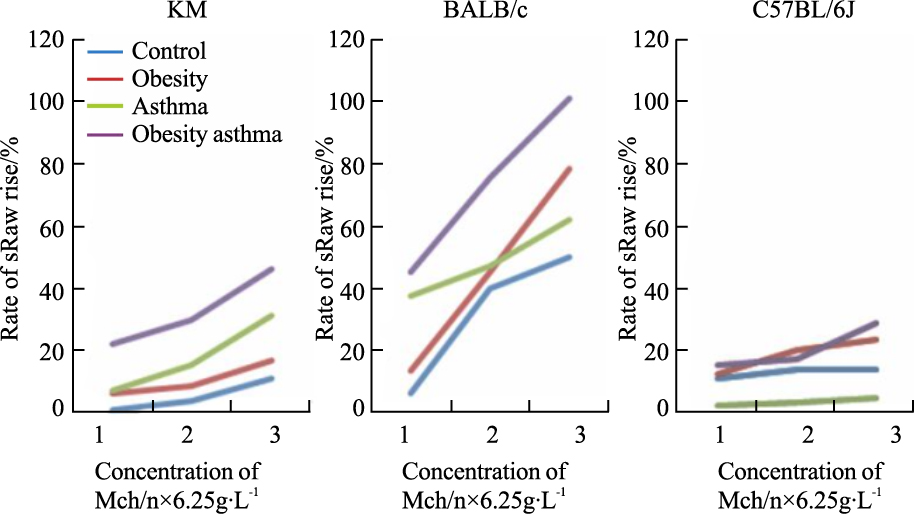
|
| Fig.5 Rate of sRaw rise |
与Bunyan等[6]研究结果类似,BALB/c及C57BL/6J肥胖小鼠BALF中OVA特异性IgE的浓度较正常对照组明显升高,但正常哮喘组较肥胖哮喘组更低,而KM小鼠模型并未表现出该种规律(Tab3)。
| Group | IgE/μg·L -1 | |
| KM | Control | 1.059±0.311 |
| Obesity | 1.275±0.264 | |
| Asthma | 1.281±0.274 | |
| Obese asthma | 1.486±0.244 | |
| BALB/c | Control | 1.462±0.447 |
| Obesity | 36.286±9.087 ** | |
| Asthma | 2.320±0.650 | |
| Obese asthma | 27.057±4.905 ## | |
| C57BL/6J | Control | 1.062±0.185 |
| Obesity | 2.743±0.477 ** | |
| Asthma | 1.329±0.408 | |
| Obese asthma | 1.846±0.788 # | |
| **P<0.01 vs control; #P < 0.05, ##P < 0.01 vs asthma | ||
一个成功的肥胖哮喘模型必须同时存在营养性肥胖及支气管哮喘的典型症状及相关实验室指标。高脂饲料所诱导的营养性肥胖与人类肥胖最为接近,国外研究中常用C57BL/6J小鼠,国内研究除C57BL/6J小鼠外,还大量应用KM小鼠,主要是因其有适应性强,生长迅速的特点。众所周知,体重、腹腔脂肪重量、Lee′s指数、脂肪细胞体积改变是判断肥胖的主要标准。成年动物的肥胖在组织水平表现为脂肪细胞体积的增大。本实验中3个品系小鼠经高脂饲料诱导后,均表现出体重及脂肪重量的明显增加,镜下脂肪细胞横截面积的明显增大也反映出脂肪细胞体积的增大。其中KM小鼠体重增加最快,达到体重平台期周期最短,实验终点体重、脂肪重量、Lee′s指数、总胆固醇水平差异均具有显著性(P<0.01)。C57BL/6J及BALB/c小鼠体重增加相对较缓慢,实验终点时,BALB/c小鼠的相关指数差异具有显著性(P<0.01),C57BL/6J的相关指数也具有差异,但较之前两个品系稍差(P<0.05)。且在喂养过程中,C57BL/6J出现部分小鼠脱毛及毛色变红表现,而其他两组小鼠均未发生,考虑为高脂饲料喂养所致维生素缺乏所致,虽经饮水中加入复合维生素后症状有所改善,但也反映出C57BL/6J小鼠对高脂饲料的耐受性较其他两个品系差,一定程度上影响模型的成功率。
在哮喘模型的建立中,近年来近交系的BALB/c小鼠因其免疫遗传背景清楚,品系纯,来源广,相关生物学试剂及抗体易获得而成为主要的哮喘模型动物。而一个良好的哮喘模型,应具备气道高反应性、气道炎症及气道重塑等特点。除常规判断哮喘模型的症状、BALF灌洗液IgE水平、肺脏病理学改变外,本研究应用了双室体积描记法测定小鼠sRaw,来反映小鼠气道反应性变化。体积描记法是一种无创的测定气道阻力和气道反应性的方法,较之有创测定方法,体积描记法具有操作简单,可反复操作,数据更加接近小鼠生理状态的特点。国外早在1979年,Pennock等[7]就将该方法应用于豚鼠气道反应性的测定,但受到设备条件的限制,国内到2009年姚卫民等[8]才开始应用该项技术测定豚鼠气道反应性。本研究首先将该项技术应用于小鼠的气道反应性的测定及评估,本实验室购进美国BUXCO公司的最新款双室体描仪,改进了动物固定装置,把固定器设置在动物颈部,使其有一定的活动度,不至于造成动物气管的挤压,根据小鼠体型特点,将封闭并分隔头室(用于测量鼻部气流的变化)和体室(用于测量胸腔气流的变化)的橡胶垫圈紧密包裹小鼠口鼻,更加合理并精确地测定鼻腔比胸腔的气流滞后时间,从而计算特殊气道阻力sRaw,取得了良好的实验效果。3个品系的小鼠哮喘模型均不同程度表现出气道阻力较非哮喘组增加,其中以BALB/c小鼠增加更为明显,且数据稳定,符合哮喘发作的临床特点。KM小鼠经OVA致敏及雾化激发后,症状及肺部病理表现出气道炎症及气道反应性变化相对不明显,且因KM小鼠个体增长过快、体型较大,在应用双室体描仪检测特殊气道阻力时出现不易安装的现象。C57BL/6J小鼠性格比较凶猛,在腹腔注射致敏及测气道阻力时多次咬伤实验员。
本实验表明,BALB/c小鼠经高脂饮食诱导12周后,能成功造成营养性肥胖模型,在经OVA腹腔注射致敏及OVA雾化激发后能造成典型肥胖合并支气管哮喘模型,能为肥胖合并哮喘机制及治疗研究提供良好的动物模型。
(致谢:感谢广西医科大学急诊医学实验室全体老师及同学对本研究的大力支持及协助!)
| [1] | Beuther D A,Weiss S T, Sutherland E R. Overweight, obesity, and incident asthma:a meta-analysis of prospective epidemiologic studies[J].Am J Respir Crit Care Med,2006,174(2):112-9. |
| [2] | Beuther D A. Recent insight into obesity and asthma[J].Curr Opin Pulm Med,2010,16(1):64-70. |
| [3] | 石海莲,郑沁乐,吴大正. 吴茱萸碱对肥胖并发血管肥厚的作用研究[J].中国药理学通报,2011,27(12):1687-92. Shi H L,Zheng Q L,Wu D Z. The preventive effect of evodiamine on vascular hypertrophy in obese rats[J].Chin Pharmacol Bull,2011,27(12):1687-92. |
| [4] | Ketonen J,Shi J,Martonen E. Periadventitial adipose tissue promotes endothelial dysfunction via oxidative stress in diet-induced obese C57Bl/6 mice[J].Circ J,2010,74(7):1479-87. |
| [5] | 刘 芳,高南南,杨润梅,等.不同品系小鼠肥胖模型比较及C57BL/6J小鼠肥胖机制研究[J].中国药理学通报,2013,29(3):360-5. Liu F,Gao N N,Yang R M,et al. Comparison of obesity models established in the different strains of mice and the mechanism of obese C57BL/6J mice[J].Chin Pharmacol Bull,2013,29(3):360-65. |
| [6] | Bunyan J,Murrell E A, Shah P P. The induction of obesity in rodents by means of monosodium glutamate[J].Br J Nutr,1976,35(1):25-39. |
| [7] | Pennock B E,Cox C P, Rogers R M,et al. A noninvasive technique for measurement of changes in specific airway resistance[J].J Appl Physiol Respir Environ Exerc Physiol,1979,46(2):399-406. |
| [8] | 姚卫民,赖克方,罗远明,等.双室体描仪测定豚鼠气道阻力和气道反应性[J].南方医科大学学报,2009,29(5):841-3. Yao W M,Lai K F,Luo Y M,et al. Measurement of airway resistance and reactivity in guinea pigs using double-chamber plethysmography[J].J South Med Univ,2009,29(5):841-3. |

