


2. 安徽省食品药品审评认证中心, 安徽 合肥 230051;
3. 安徽省食品药品检验研究院, 安徽 合肥 230051;
4. 湖北省食品药品监督管理局技术审评核查中心, 湖北 武汉 430071
 , SI Wen-wen3, YIN Yan-yan1, HE Can1, CHENG Jie3, WANG Chun-yan3, ZHANG Qiong-guang4, YANG Yan1
, SI Wen-wen3, YIN Yan-yan1, HE Can1, CHENG Jie3, WANG Chun-yan3, ZHANG Qiong-guang4, YANG Yan1

2. Anhui Center for Food and Drug Evaluation and Certification, Hefei 230051, China;
3. Anhui Provincial Food and Drug Inspection Institute, Hefei 230051, China;
4. Hubei Provincial Food and Drug Administration for the Technical Review Verification Centre, Wuhan 430071, China
近年的分子遗传学研究发现,至少有60%~70%的肥厚型心肌病为基因突变所致。现已知有19个基因与该病有关,其中胚胎基因心房利尿钠肽(atrial natriuretic peptide,ANP)、脑利尿钠肽(brain natriuretic peptide,BNP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)等的重新表达被认为是心脏肥厚的分子标志,检测这些基因的表达改变不仅可以肯定心脏肥厚的存在,而且可以判断肥厚的程度以及预后[1, 2]。
目前研究表明,不同心肌肥厚(cardiac hypertrophy,CH )模型间多数心室基因表达谱的变化存在差异,有些基因表达水平改变的方向相同,部分基因表达水平改变方向相反[3]。为了解心肌肥厚标志性基因在不同模型上的表达差异,本实验复制了3种常见小鼠心肌肥厚模型:肾上腹主动脉缩窄(renal abdominal aortic coarctation,AAC)模型、动静脉瘘(arteriovenous fistula,AVF)[4]模型和异丙肾上腺素( isoproterenol,ISO )模型,这3种模型都是经典的且被国内外研究者广泛认可,但尚未见到不同心肌肥厚模型间肥厚性标志基因(ANP、BNP 和β-MHC)表达差异性相关文献报道。
本文拟通过比较上述3种基因在mRNA和蛋白水平的差异性,来评价心肌肥厚模型的优劣,为深入探索心肌肥厚疾病的发生发展机制,及相关靶向药物的筛选研发、应用奠定初步的实验性理论基础。
1 材料与方法 1.1 动物SPF级C57BL/6小鼠,♀♂各半,体质量18~22 g,由安徽省实验动物中心提供,许可证号:SCXK(皖)2011-002。
1.2 仪器与试剂TP1020型脱水机,莱卡(德国)公司;BX-51型显微镜,OLYMPUS。DAB显色试剂盒,批号:K136621D,北京中杉金桥生物科技有限公司;PV-6000通用型二步法检测试剂盒,批号:WP133623,北京中杉金桥生物科技有限公司;β-MHC抗体(bs-0259R),批号:140212,ANP抗体 (bs-2040R),批号:990398W和BNP抗体(bs-2207R),批号:980502W,均购自北京博奥森生物技术有限公司。TRIzol 试剂(G&M Gene Technology公司);引物、反转录试剂盒及RT-PCR试剂盒(TaKaRa 公司)。
1.3 实验方法 1.3.1 小鼠AAC法小鼠术前禁食 12 h,4%水合氯醛麻醉,于小鼠剑突下沿腹中线切开皮肤及肌肉约1.5 cm。随后可见腹主动脉和下腔静脉。在肾动脉上方约 0.3 cm 处的腹主动脉,用 5 mL注射器针头(0.6 mm)紧贴腹主动脉,平行放置,用 4号手术丝线结扎,抽出针头缝合创口。术后4周,处死小鼠,取材检测。
1.3.2 小鼠AVF法[4]使用4%水合氯醛生理盐水溶液,麻醉小鼠,于腹正中切口,将连有1 mL注射器的4号静脉注射针弯折成135°角,斜向上刺穿腹主动脉,继续进针,刺穿动静脉联合壁,可见有鲜红色动脉血进入下腔静脉,迅速在腹主动脉针眼处,均匀涂抹医用胶,封住针眼,松开血管夹,可见下腔静脉明显变红,触之有震颤感,证明造瘘成功。于术后2周末,处死小鼠,取材检测。
1.3.3 小鼠ISO法异丙肾上腺素组皮下注射盐酸异丙肾上腺素1 mg·kg-1,每天2次,间隔8 h,连续14 d。对照组皮下注射相同体积的生理盐水。末次给药后24 h取材检测。
1.3.4 心脏重量指数称取各组小鼠体重(BW),脱颈处死。称量心脏重量(HW),剪去心房及右室,并置于4℃ PBS 缓冲液中清洗,称量左室重量(LVW),计算心脏重量指数(HW/BW)和左心室指数(LVW/BW),留取部分心肌组织用于 HE 和免疫组织化学染色,其余部分立即置于-80℃ 冻存。
1.3.5 心肌肥厚标志基因表达水平的测定将冻存的心肌组织放入组织研磨器中,并加入500 μL TRIzol 抽提总RNA。测定RNA纯度、浓度后,反转为cDNA,采用Real-time PCR 检测。使用Real-time PCR引物,序列如下[5]:引物上、下游序列依次为:ANP:forward:5′-ACAGCCAAGGAGGAAAAGGC-3′,reverse:5′-CCACAGTGGCAATGTGACCA-3′; BNP:forward:5′-TCCAGAGCAATTCAAGATGCA-3′,reverse:5′-CTTTTGTGAGGCCTTGGTCC-3′;β-MHC:forward:5′-GATGTTTTTGTGCCCGATGA-3′,reverse:5′-ACCGT CTTGCCATTCTCCG-3′;GAPDH: forward:5′-TGAAGCAGGCATCTGAGGG-3′,reverse:5′-CGAAGGTGGAA GAGTGGGAG-3′。
1.3.6 统计学方法所有资料的各项数值以x±s表示,采用 SPSS 11.0 软件,进行数据分析。组间比较用单因素方差分析,方差齐时用q检验,方差不齐时用 Tamhane检验。
2 结果 2.1 HW/BW和LVW/BW比较对照、AAC、AVF和ISO组小鼠体质量分别为(31.1±3.9) g、(30.4±3.3) g、(29.6±2.9) g和(30.8±3.1) g,之间差异无显著性。Fig1结果显示,与对照组比较,AAC、AVF和ISO组的HW/BW、LVW/BW比值均增大(P < 0.05~0.01);与AAC比较,ISO组HW/BW、LVW/BW比值均下降(P < 0.01),AVF组HW/BW比值下降(P < 0.05)。
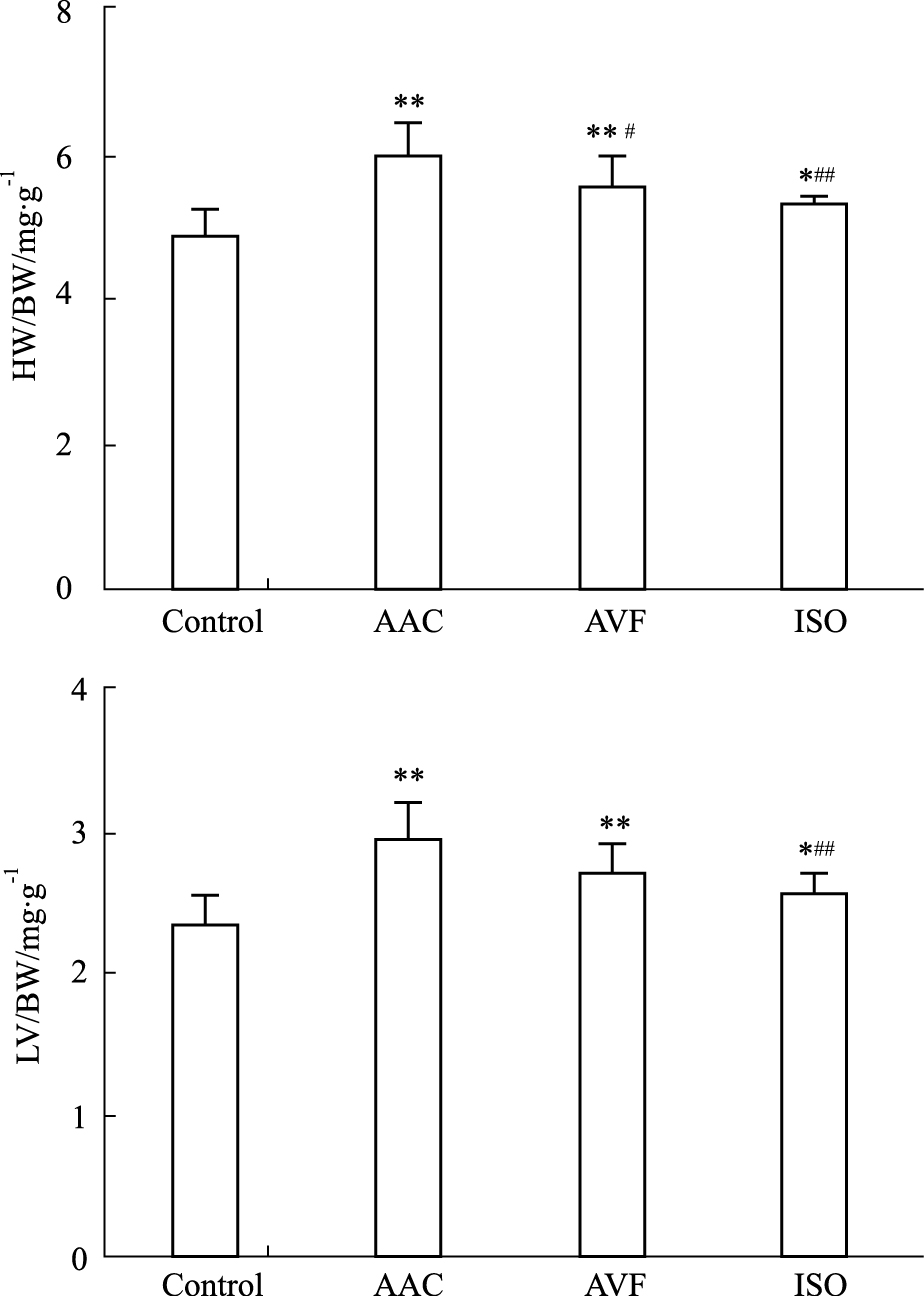
|
| Fig.1 Changes of HW/BW, LVW/BW in three different CH models (n=10) *P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs AAC |
Fig2结果显示,在低倍镜下,AAC、AVF和ISO组小鼠心肌可以见到室壁增厚,心室腔狭窄,其中AAC组变化明显;在高倍镜下,对照组的心肌细胞是修长而排列整齐,无心肌细胞肥大、坏死,无炎性细胞浸润和间质纤维化,AAC、AVF和ISO组部分心肌细胞变厚,排列稀疏,心肌细胞肥大,可见间质纤维化。

|
| Fig.2 Histopathological changes of heart in three models Heart tissues stained with HE, magnification(10×, 100×, 400×) |
Fig3结果显示,对照组ANP、BNP和β-MHC的组织染色几乎未见阳性细胞;与对照组比较,AAC、AVF和ISO组ANP、BNP和β-MHC的表达明显增加;与AAC组比较,AVF和ISO组ANP、BNP和β-MHC表达降低。

|
| Fig.3 Expression of ANP,BNP and β-MHC in different mouse models(n=6 ) *P<0.05,**P<0.01 vs control; ##P<0.01 vs AAC |
Fig4结果显示,与对照组比较,AAC和AVF 组ANP、BNP和β-MHC mRNA表达水平增加(P < 0.05~0.01),ISO组BNP mRNA表达水平增加(P < 0.05);与AAC组比较,AVF和ISO组ANP mRNA表达降低(P < 0.01),ISO组BNP、β-MHC mRNA表达降低(P < 0.01)。
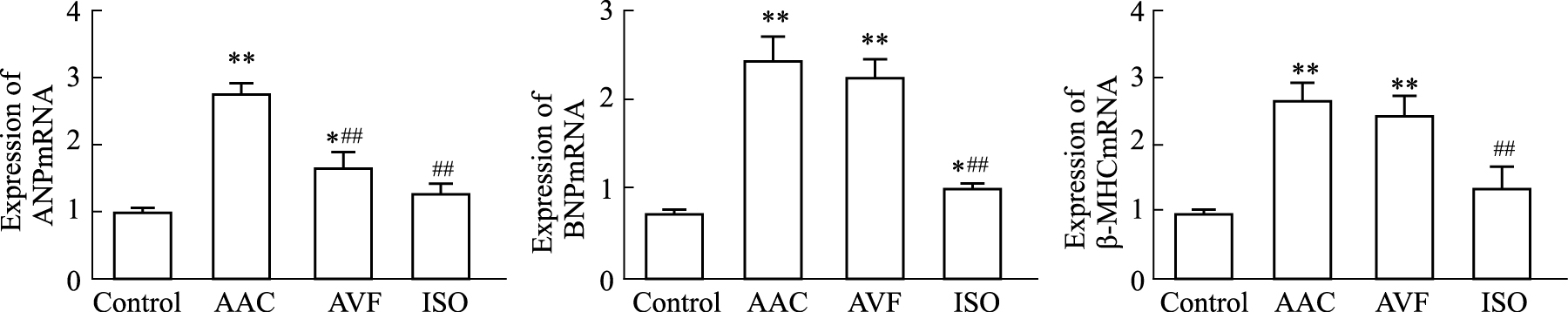
|
| Fig.4 Expression of ANP, BNP and β-MHC mRNA in three CH models (n=6) *P<0.05,**P<0.01 vs control;##P<0.01 vs AAC |
心肌肥厚过程伴随着复杂的基因表达水平变化,与心肌肥厚表型的发生、发展互为因果,其中ANP、BNP和β-MHC基因在心肌肥厚过程的再表达已经得到公认[2]。ANP主要由心房肌细胞分泌,ANP 基因的表达是所有哺乳动物心肌肥厚的特征,也是临床上判断疾病严重程度的预测指标[6]。BNP主要在心室合成和分泌,研究表明,血浆中BNP浓度与心室射血分数具有相关性,心室射血分数不足时,大量的血液聚集在心室内,导致心室压力增大,心室腔扩张,从而引起BNP 合成和释放[7]。心肌肌球蛋白是心肌肌原纤维的主要成分和收缩蛋白,主要由一对重链(即α-MHC 和β-MHC)和两对轻链组成,通过研究各种因素引起的心肌肥厚发现,在早期常伴有MHC同型异构体转换,当发生心肌肥厚时,β-MHC mRNA表达则明显增强,心肌α-MHC向β-MHC发生转化,所以β-MHC是心肌肥厚的一个重要的标志性基因[8]。因此,同时检测ANP、BNP和β-MHC基因的表达,对心肌肥厚的判定和预后将有重要的意义。
研究心肌肥厚的机制,离不开动物模型的制备,目前心肌肥厚动物模型的造模方法主要分为3类:①压力超负荷法。采取主动脉缩窄的方法,心脏后负荷增加,导致心脏做功与耗氧量增加,左心室重构而最终导致心肌肥厚[9];②容量超负荷法。如动静脉造瘘法引起动静脉短路,增加右心室前负荷,形成右心室肥厚[4];③激素诱导法。目前主要有去甲肾上腺素和甲状腺素等[10]。研究表明[11],只有接近临床肥厚患者实际患病过程的模型,才有更高的研究价值。ISO法不能完全地模拟生理分泌肾上腺素的过程,且剂量过大可能导致动物的死亡,剂量过小则不能成功地建立肥厚模型;AVF法实验操作相对复杂;AAC法主要是经过缓慢的病理变化模拟心肌肥厚,更接近肥厚疾病的真实病理进程。如在此基础上能深入地研究心肌肥厚疾病的发生发展机制,可最终为减少和改善心肌肥厚及相关治疗药物的研发和应用奠定科学的理论基础。本研究结果表明,AAC、AVF和ISO组小鼠心肌可以见到室壁增厚,心室腔狭窄,但AAC组变化明显。
李平等[3]对以上3种心肌肥厚模型的基因表达谱进行分析研究,结果显示不同造模方法引起的心肌肥厚,其基因表达谱存在差异。那么这3种模型ANP、BNP和β-MHC基因表达有无差异呢?目前,同时检测心肌组织ANP、BNP和β-MHC表达的,AAC法造模动物多采用大鼠和基因改造小鼠;AVF法造模多采用大鼠;ISO多用于诱导体外心肌细胞的表达。由于实验动物品系的差别、实验条件的不同,通过目前文献综述来比较3种模型ANP、BNP和β-MHC表达差异存在诸多困难。本研究表明,AAC法造模小鼠心肌组织在表达ANP、BNP和β-MHC时优于AVF和ISO法,说明不同的造模方法ANP、BNP和β-MHC表达存在一定的差异性。提示采用AAC法制作的小鼠心肌肥厚模型,在心肌肥厚标志性基因的mRNA和蛋白表达水平上,有着更加明显的优势。
本文采用的小鼠是研究心血管系统常用品系C57BL/6,李晓梅等[12]通过比较KM小鼠与C57BL/6两种品系小鼠的主动脉弓缩窄模型发现,虽然两种品系的小鼠均产生左室肥厚,但是在手术成功率、心衰发生率以及心肌肥厚出现时间等方面均存在差异。那么,采用不同品系小鼠对肾上腹主动脉缩窄法制作心肌肥厚模型的标志性基因表达是否会产生影响呢?本课题组将会进一步研究。
| [1] | Manning E P, Tardiff J C, Schwartz S D, et al. Molecular effects of familial hypertrophic cardiomyopathy-related mutations in the TNT1 domain of cTnT[J]. J Mol Biol, 2012, 421(1):54-66. |
| [2] | Marin T M, Keith K, Davies B, et al. Rapamycin reverses hypertrophic cardiomyopathy in a mouse model of LEOPARD syndrome-associated PTPN11 mutation[J]. J Clin Invest, 2011, 121(3):1026-43. |
| [3] | 李 平,李劲梁,冯新恒,等.大鼠不同心肌肥厚模型左心室基因表达谱变化的比较[J].生理学报,2004,56(2):210-28. Li P, Li J L, Feng X H, et al. Comparison of changes in left ventricular gene expression profiles from different cardiac hypertrophy models in rats[J]. Acta Physiol Sin, 2004,56(2):210-28. |
| [4] | 司文文,阚红卫,尹艳艳,等.小鼠腹腔动-静脉瘘模型构建及中药复方SP的干预[J].安徽医药,2014,18(9):1634-7. Si W W, Kan H W, Yin Y Y, et al. Construction of the arteriovenous fistula model in mice and the intervention of compound SP[J]. Anhui Med Pharm J, 2014,18(9):1634-7. |
| [5] | Mathiyalagan P, Chang L, Du X J, et al. Cardiac ventricular chambers are epigenetically distinguishable[J]. Cell Cycle, 2010, 9(3):612-7. |
| [6] | Nobata S, Ventura A, Kaiya H, et al. Diversified cardiovascular actions of six homologous natriuretic peptides (ANP, BNP, VNP, CNP1, CNP3, and CNP4)in conscious eels[J]. Am J Physiol Regul Integr Comp Physiol, 2010,298(6):R1549-59. |
| [7] | Liang F, Wu J, Garami M, et al. Mechanical strain increases expression of the brain natriuretic peptide gene in rat cardiac myocytes[J]. J Biol Chem, 1997, 272(44):28050-6. |
| [8] | 蔡 辉,郭郡浩,商 玮,等.压力负荷增加大鼠模型心肌α-MHC和β-MHC mRNA的表达[J].医学研究生学报,2009,22(10):1032-5. Cai H, Guo J H,Shang W, et al. Expressions of myocardial-MHC and -MHC mRNA in rats with pressure overload[J]. J Med Postgrad, 2009,22(10):1032-5. |
| [9] | Berry J M, Naseem R H, Beverly A, et al. Models of cardiac hypertrophy and transition to heart failure[J]. Drug Discov Today Dis Models, 2007,4(4):197-206. |
| [10] | 姜 妍,韩淑英.荞麦花叶总黄酮对去甲肾上腺素所致心肌肥厚大鼠PKC蛋白表达的影响[J].中国药理学通报,2008,24(12):1674-6. Jiang Y, Han S Y. Effects of total flavones of buckwheat flower and leaf on protein kinase C content and activity in cardiac hypertrophy rats[J]. Chin Pharmacol Bull, 2008,24(12):1674-6. |
| [11] | 赵祎镭,李丹露.心肌肥厚模型建立方法的研究进展[J].中国药房,2014, 25(5):473-5. Zhao W L, Li D L. Advances in cardiac hypertrophy model approach[J]. China Pharm, 2014, 25(5):473-5. |
| [12] | 李晓梅,马依彤,杨毅宁,等.不同品系小鼠主动脉弓缩窄压力负荷模型的比较[J].实验动物与比较医学,2008,28(4):209-13. Li X M, Ma Y T, Yang Y N, et al. Comparison of heart function changes by transverse aortic coarctation in different strain mice[J]. Lab Anim Comp Med, 2008,28(4):209-13. |