


2. 江南大学无锡医学院, 江苏 无锡 214062
2. Wuxi Medical School, Jiangnan University, Wuxi Jiangsu 214062, China
越来越多的研究表明,H2S是一种有效的心脏保护气体信号分子,参与许多心血管系统的病理、生理调节过程。虽然本课题组前期研究证实,外源性H2S后处理通过磷脂酰肌醇3 激酶/ 蛋白激酶B(phosphatidyqinositol-3 kinase/protein kinase B,PI3K/Akt) 信号通路保护大鼠缺血心肌[1, 2],但其下游靶分子仍未完全清楚。有文献报道,Sirt1表达水平的降低可导致心肌梗死的发生[3],激活PI3K/Akt可磷酸化Sirt1,使其进入细胞核发挥作用[4]。然而,PI3K/Akt/Sirt1信号通路是否参与了H2S后处理对大鼠缺血心肌的保护作用还未见报到。本研究拟通过使用大鼠离体心脏I/R损伤模型及PI3K/Akt特异性抑制剂LY294002来探索PI3K/Akt/Sirt1信号通路在H2S保护缺血心肌中的作用。
1 材料与方法 1.1 试剂氯化三苯基四氮唑(TTC)、硫氢化钠、 LY294002(Sigma,美国);鼠抗Sirt1单克隆抗体(ab110304,Abcam)、兔抗PGC-1α多克隆抗体(ab54481,Abcam);兔抗β-actin多克隆抗体(Bioworld Technology,美国)、辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物公司)及辣根过氧化物酶标记的山羊抗鼠IgG(武汉博士德生物公司);SDS-PAGE 凝胶试剂盒、SDS-PAGE蛋白上样缓冲液、超敏ECL化学发光试剂盒(碧云天生物技术公司);动物组织总RNA提取试剂盒(天根生化科技);逆转录及实时荧光定量PCR检测试剂盒(TaKaRa,日本)。
1.2 仪器Langendorff离体心脏灌流装置、Power Lab八通道生理记录仪(ADInstrument ,澳大利亚);Roche实时荧光定量PCR仪(Roche Light Cycler480Ⅱ,德国)。
1.3 大鼠离体心脏I/R模型的制备清洁级♂SD大鼠60只(8~10周龄,250±30 g),上海斯莱克实验动物责任有限公司提供,实验动物许可证号:SCXK (沪) 2012-0002。腹腔注射3%的戊巴比妥钠(80 mg·kg-1)麻醉,肝素钠500 U·kg-1抗凝。麻醉后迅速打开胸腔取出心脏,置于呈冰水混合物状态的95% O2和5% CO2混合气体饱和的K-H液中,然后经主动脉逆行插管固定在Langendorff 灌注装置上。使用37 ℃恒温加热的95% O2和5% CO2混合气体饱和的改良K-H液进行常规恒流灌注(12 mL·min-1)。改良的K-H液成分为(mmol·L-1):NaCl 118.5、KCl 4.7、CaCl2 2.5、MgSO4 1.2、KH2PO4 1.2、NaHCO3 24.8、D-Glucose 11、EDTA-2Na 0.125,pH=7.2~7.4。通过左心室内自制球囊实时监测心脏血流动力学指标:左室发展压(LVDP)、左室内压上升/下降最大速率(±dP/dtmax)和左室舒张末压(LVEDP)等。
1.4 实验动物分组60 只♂SD大鼠随机分为5组(n=12):① Control组,全心持续灌注110 min;② I/R组,平衡20 min后,全心停灌30 min,再灌注60 min;③ I/R + NaHS组(H2S组),全心停灌30 min后,复灌即刻给予含NaHS 10 μmol·L-1的K-H液15 s,不含NaHS的K-H液15 s,连续重复4次[1],其余处理同I/R组;④ I/R+LY294002组(LY组),平衡末10 min及复灌前5 min给予15 μmol·L-1 LY294002[8]溶于0.02% DMSO的K-H液,共15 min,其余处理同I/R组;⑤ I/R+NaHS+LY294002组(H2S+LY组),平衡末10 min及复灌前5 min给予15 μmol·L-1 LY294002溶于0.02% DMSO的K-H液,共15 min,同时复灌即刻给予含NaHS 10 μmol·L-1的K-H液15 s,不含NaHS的K-H液15 s,重复4次,其余处理同I/R组。
1.5 TTC法测定心肌梗死面积复灌末取下大鼠心脏,置于-80 ℃冷冻5~10 min,剔除右心室和右心房后,将心脏横切成约2~3 mm的薄片(4~6片),然后浸于37 ℃的1% TTC磷酸缓冲液(pH 7.4)中闭光孵育20 min。终止反应后,可见梗死的灰白色心肌以及存活的砖红色心肌。甲醛固定后,将切片心肌进行扫描,采用Image J软件计算心肌梗死面积百分比/%=(梗死心肌面积之和/心肌总面积之和)× 100%。
1.6 荧光实时定量PCR法检测Sirt1和PGC-1α的 mRNA含量取复灌末置于-80 ℃冰箱保存的心肌组织,按照总RNA提取试剂盒说明书步骤提取总RNA,并以总RNA为模板,加入逆转录试剂合成 cDNA。根据SYBR Green 试剂盒说明书,以cDNA为模板进行逆转录聚合酶链式反应,通过Roche Light Cycler480Ⅱ荧光定量PCR仪实时监测荧光强度。根据Light Cycler480 optical system software(SW1.5.1)提供的CP值,以GAPDH为内参,用算术公式“2-ΔΔCT”对结果进行计算后再统计分析[3]。以检索Genbank得到的基因序列设计引物如下:Sirt1,5′-CACCGAGGAACTACCTGAT-3′(forward),5′-CATCCCAGCCTCCGTTAT-3′(reverse)。PGC-1α,5′-CCTCCATGCCTGACGGCACC-3′(forward),5′-GAGCTGAGTGTTGGCTGGCG-3′(reverse)。GAPDH,5′-GGA TGGAATTGTGAGGGAGA-3′(forward),5′-GTGGACCT CATGGCCTACAT-3′(reverse)。引物均由上海生工合成。
1.7 Western blot 法测定Sirt1和 PGC-1α的蛋白表达取适量-80 ℃保存的心肌组织置于冰上,加入预冷的裂解液,快速制备组织匀浆,4 ℃ 14 000×g离心10 min后取上清。BCA法测定蛋白浓度后配平,加入5×SDS上样缓冲液后煮沸。取40 μg总的心肌蛋白进行SDS-PAGE电泳,然后将蛋白转移到PVDF膜上。5%的脱脂奶粉室温摇床封闭2 h ,加入TBST稀释的一抗(Sirt1,1: 1 000; PGC-1α,1: 1 000;β-actin,1: 3 000),4℃摇床孵育过夜,TBST漂洗后加入相应的HRP标记的二抗(1: 2 000),继续室温摇床封闭2 h ,最后采用超敏ECL发光液进行曝光,用Image J对蛋白条带进行分析。
1.8 免疫组化法检测Sirt1的细胞分布心肌组织石蜡切片,按照SABC即用型免疫组化试剂盒说明书进行标记染色(武汉博士德生物公司)。按标准免疫组化步骤处理石蜡切片。加入PBS稀释的一抗(Sirt1,1: 300),4 ℃孵育过夜后DAB显色,镜下不断观察染色程度,终止反应后苏木精染核。每张切片在×400镜头下随机选取6个高倍视野,统计相应视野内的Sirt1 阳性细胞核个数,以细胞核阳性表达指数(%)即视野内阳性细胞核个数/视野内所有心肌细胞个数来反映各组心肌组织中Sirt1的细胞分布情况。
1.9 统计学分析使用SPSS 16.0统计软件进行统计学分析,所有实验结果均以x±s表示。各组间的比较采用单因素方差分析,之后的多重比较采用SNK-q检验。
2 结果 2.1 硫氢化钠后处理对大鼠各项心功能指标的影响实验结果显示,在平衡末各组心功能指标间差异无统计学意义(P>0.05)。除Control组外,复灌30 min 和60 min后,其它4组与平衡末基础值相比,LVEDP明显升高(P < 0.05),LVDP和±dP/dtmax明显降低(P < 0.05);与I/R组比较,H2S组 LVEDP 明显降低(P < 0.05),LVDP和±dP/dtmax明显升高(P < 0.05);与H2S组相比,H2S+LY组LVEDP明显升高(P < 0.05),LVDP和±dP/dtmax明显降低(P < 0.05),见Tab1。
| Group | Baseline | Reperfusion | ||
| 30 min | 60 min | |||
| LVEDP/kPa | Control | 0.83±0.18 | 1.05±0.19 | 1.09±0.20 |
| I/R | 0.85±0.16 | 6.06±0.85 * | 6.46±0.75 * | |
| I/R+NaHS | 0.84±0.16 | 4.38±0.57 # | 4.50±0.76 # | |
| I/R+LY294002 | 0.85±0.18 | 6.46±0.91 △ | 6.06±0.91 △ | |
| I/R+LY294002+NaHS | 0.83±0.18 | 5.98±0.89 △ | 5.80±0.90 △ | |
| LVDP/kPa | Control | 14.30±0.65 | 13.75±0.51 | 13.49±0.52 |
| I/R | 14.33±0.91 | 5.86±1.11 * | 6.13±1.33 * | |
| I/R+NaHS | 13.99±0.83 | 8.00±1.56 # | 8.32±1.70 # | |
| I/R+LY294002 | 14.08±0.89 | 5.58±1.21 △ | 5.61±1.57 △ | |
| I/R+LY294002+NaHS | 13.82±0.99 | 5.84±1.55 △ | 5.66±1.47 △ | |
| +d P/d t max/kPa·s -1 | Control | 361±23 | 358±25 | 348±25 |
| I/R | 360±25 | 170±25 * | 155±25 * | |
| I/R+NaHS | 341±24 | 208±23 # | 230±27 # | |
| I/R+LY294002 | 345±26 | 148±27 △ | 152±27 △ | |
| I/R+LY294002+NaHS | 331±26 | 151±25 △ | 146±25 △ | |
| -d P/d t max/kPa·s -1 | Control | -311±24 | -293±24 | -290±24 |
| I/R | -298±23 | -125±27 * | -113±29 * | |
| I/R+NaHS | -293±23 | -161±27 # | -163±27 # | |
| I/R+LY294002 | -297±26 | -117±26 △ | -112±29 △ | |
| I/R+LY294002+NaHS | -316±24 | -124±28 △ | -128±28 △ | |
| * P < 0.05 vs control group; # P < 0.05 vs I/R group; △ P < 0.05 vs I/R+NaHS group | ||||
复灌末I/R组的心肌梗死面积为(48.9±5.6) %,与Control组梗死面积百分比(16.3±4.1)%相比明显增加(P < 0.05);与I/R组比较,H2S组梗死面积百分比减小,为(26.9±4.9)%(P < 0.05);与H2S组相比,H2S+LY组梗死面积百分比增加为(49.0±5.7)% (P < 0.05),见Fig1。
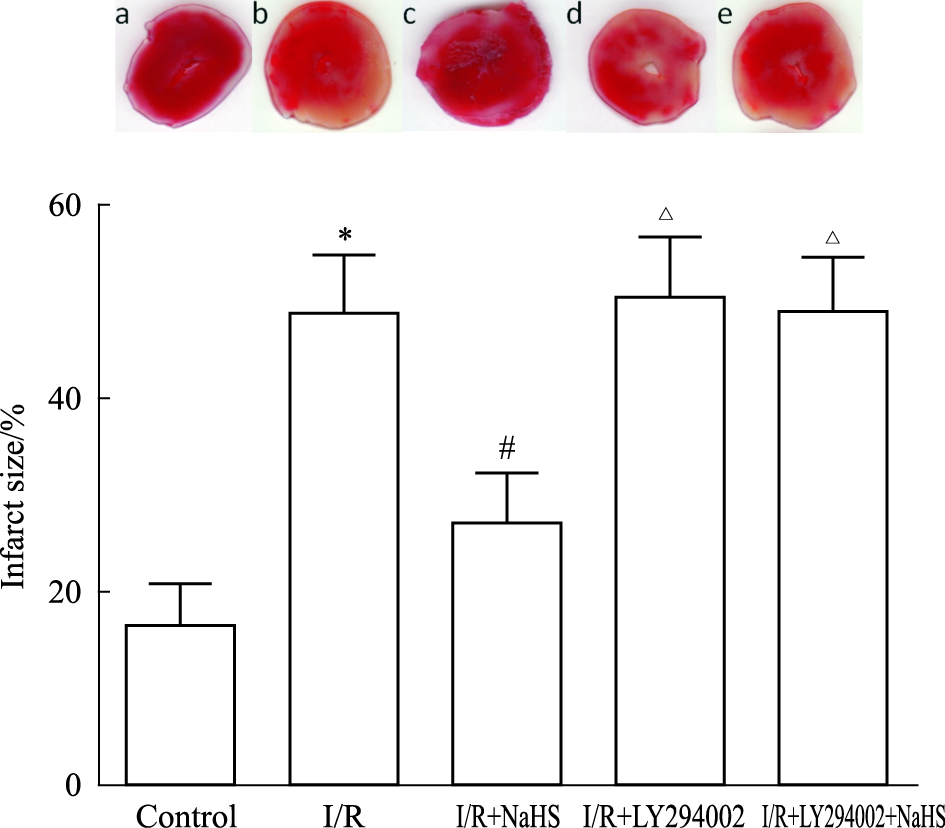
|
| Fig.1 Percentage of infract size of myocardiumat the end of reperfusion(x±s,n=6) One representative image of the myocardial infarct size of each group is shown. a: Control; b:I/R; c:I/R +NaHS; d:I/R+LY294002; e: I/R+LY294002+NaHS.*P < 0.05 vs control group;#P < 0.05 vs I/R group;△P < 0.05 vs I/R+NaHS group |
实时荧光定量PCR法检测结果见Fig2A和Fig2B。I/R组Sirt1、PGC-1α mRNA的表达水平升高,但与Control组相比差异无统计学意义(P>0.05);与I/R组比较,H2S组Sirt1、PGC-1α mRNA的表达水平进一步升高(P < 0.05);与H2S组相比,H2S+LY组Sirt1、PGC-1α mRNA表达水平明显降低(P < 0.05)。
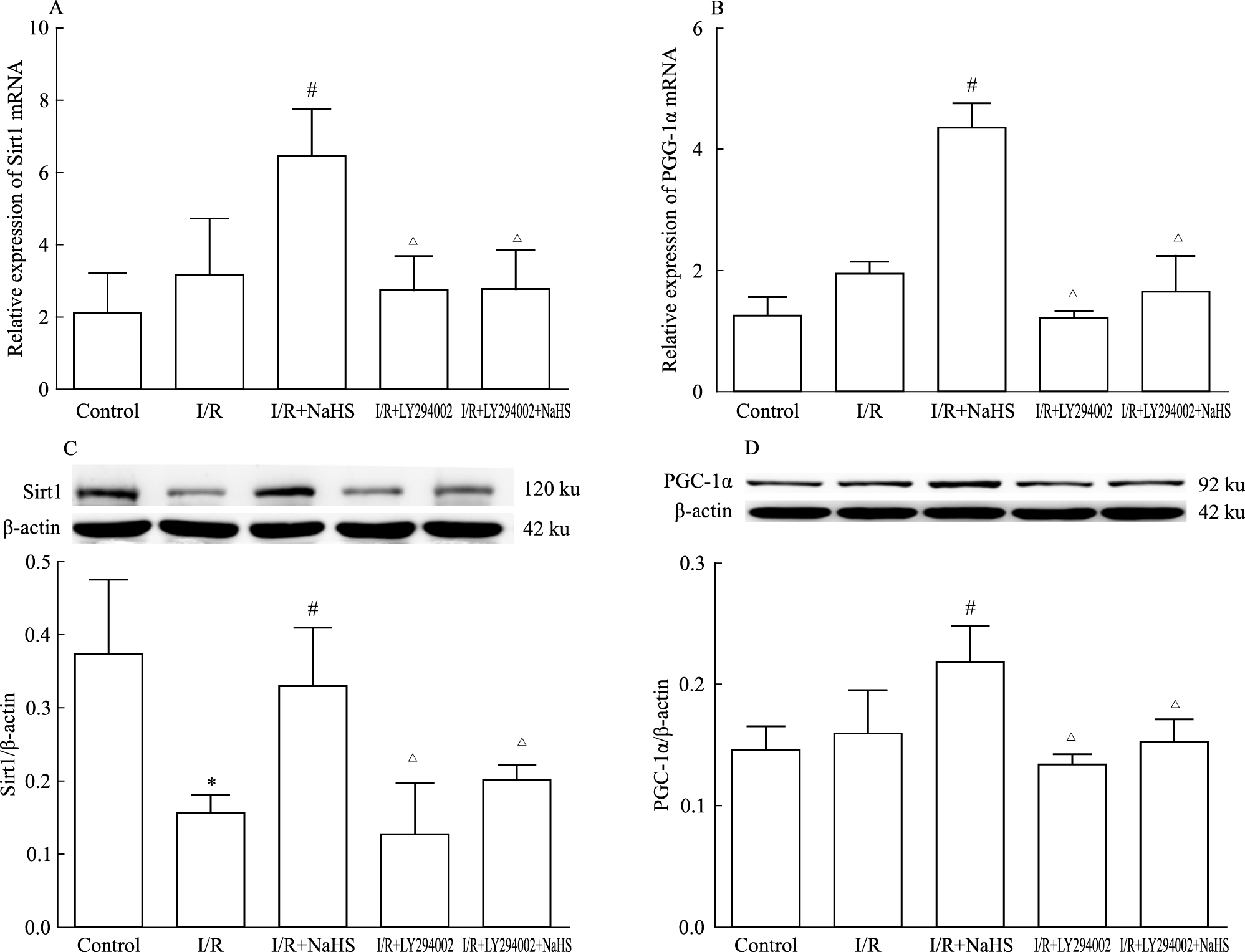
|
| Fig.2 Effects of NaHS on Sirt1 and PGC-1α(x±s,n=3) A and B: The levels of Sirt1 and PGC-1α mRNA were tested using real-time PCR; C and D: The protein levels of Sirt1 and PGC-1α were tested using Western blot.*P < 0.05 vs control group;#P < 0.05 vs I/R group;△P < 0.05 vs I/R+NaHS group |
Western blot法分析结果见Fig2C和Fig2D。I/R组与Control组相比,Sirt1蛋白表达水平明显降低(P < 0.05);与I/R组比较,H2S组Sirt1 蛋白表达水平升高(P < 0.05);与H2S组相比,H2S+LY组Sirt1蛋白表达水平明显降低(P < 0.05)。PGC-1α在正常心肌组织中表达量比较低,在I/R组中,PGC-1α蛋白表达水平升高,但差异无统计学意义(P>0.05);与I/R组比较,H2S组PGC-1α蛋白表达水平升高(P < 0.05);与H2S组相比,H2S+LY组PGC-1α蛋白表达水平明显降低(P < 0.05)。
2.5 硫氢化钠后处理对大鼠缺血心肌Sirt1的细胞分布影响免疫组化法检测心肌组织中Sirt1的细胞分布,见Fig3A、3B。结果显示,在Control组中Sirt1主要位于细胞核中,阳性表达指数为(51±4)%,与Control组比较,I/R组Sirt1阳性细胞核个数明显减少,为(22±3)%(P < 0.05);与I/R组比较,H2S组Sirt1细胞核阳性表达指数增加,为(43±4)%(P < 0.05);与H2S组比较,H2S+LY组Sirt1细胞核阳性表达指数减少,为(25±4)%(P < 0.05)。
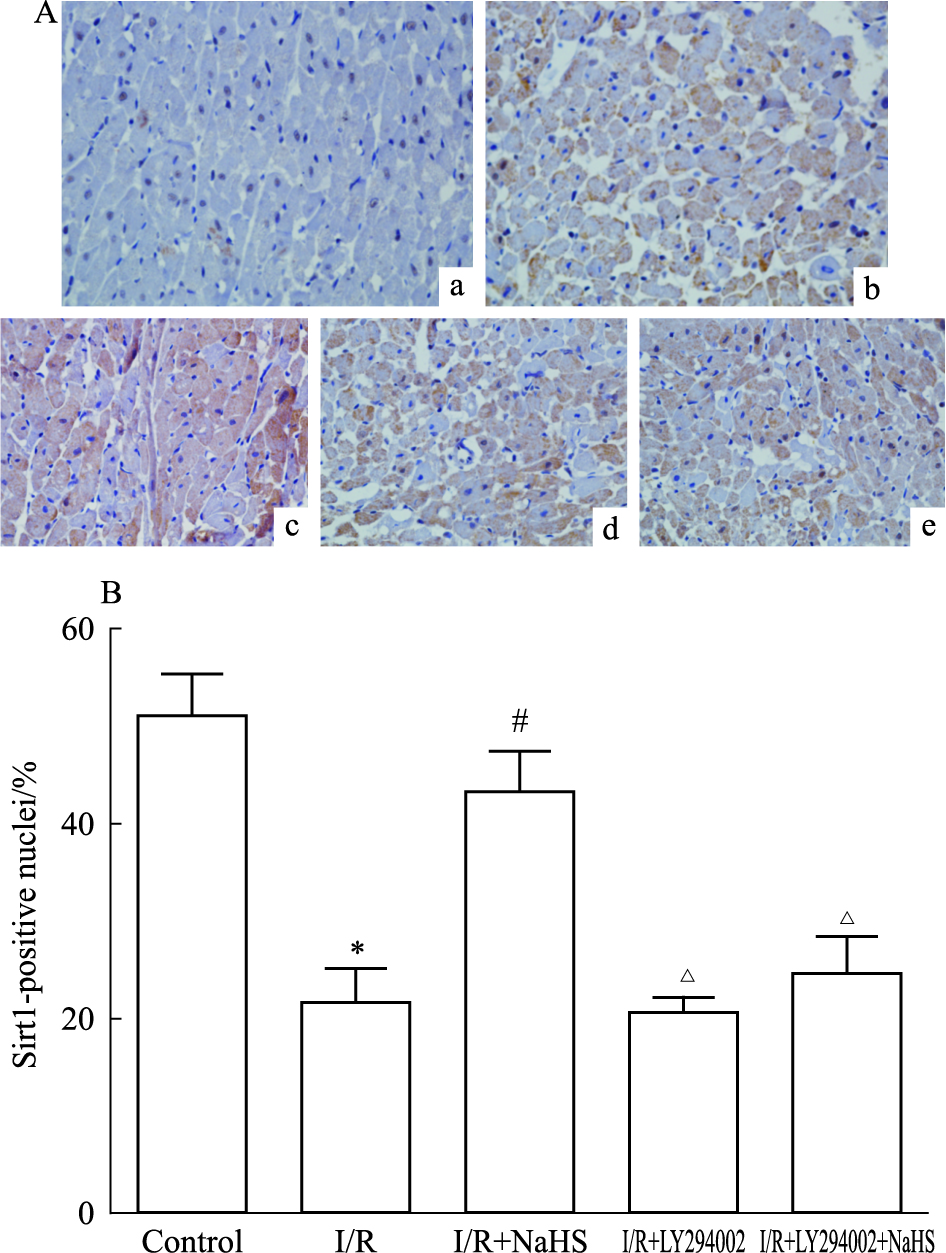
|
| Fig.3 Effects of NaHS on location of Sirt1(x±s,n=3) A:Sirt1 location was examined by IHC(40×).One representative image of each group is shown. a: Control; b:I/R; c:I/R+NaHS; d:I/R+LY294002; e:I/R+LY294002+NaHS. B:The percentage of Sirt1-positive nuclei for each group was quantified.*P < 0.05 vs control group;#P < 0.05 vs I/R group;△P < 0.05 vs I/R+NaHS group |
Sirt1是尼克酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的高度保守第三类组蛋白/非组蛋白去乙酰酶抑制剂家族的成员之一,作为敏感的能量感应器调节着许多重要的代谢和生理过程。本课题组的近期研究表明,PGC-1α参与了H2S后处理对心肌I/R损伤的保护作用[5]。虽然PGC-1α作为Sirt1的直接下游靶分子,可以被Sirt1去乙酰化而激活,发挥其调节线粒体生物合成和能量代谢的重要作用[6],但是Sirt1是否也参与了H2S的抗心肌缺血作用还尚未知。本实验发现,Sirt1 在I/R组减少,而在硫化氢后处理组增加,同时心肌梗死面积减少及心脏整体功能提高,认为Sirt1在硫化氢后处理保护缺血大鼠心肌中起重要作用。这与Wu等[7]近期研究结果:硫化氢可通过Sirt1途径减轻氧化应激诱导的心肌凋亡相一致。
PI3K/Akt是细胞内重要的信号转导通路,在细胞的生存、凋亡以及增殖等活动中发挥重要的生物学功能。季永等[8]研究结果表明,外源性硫化氢后处理通过PI3K/Akt 信号通路调节线粒体Cx43蛋白,保护大鼠缺血心肌。有文献报道[5],当细胞受到外界刺激时,激活PI3K/Akt,磷酸化Sirt1,使其进入细胞核发挥作用。为了研究Sirt1在硫化氢后处理中的保护机制及H2S是否通过PI3K/Akt信号通路调节Sirt1的表达,本实验使用PI3K/Akt 信号通路抑制剂LY294002,观察各组心功能指标、心肌梗死面积、Sirt1和PGC-1α的表达水平以及Sirt1的细胞分布。
研究结果显示,离体大鼠心脏经过全心缺血30 min,复灌60 min后,心脏整体功能明显下降。与I/R组比较,H2S组明显改善了心脏功能,主要表现为LVDP和±dP/dtmax均升高,LVEDP降低,心肌梗死面积减少等。在Control组中,Sirt1 的表达量较高,I/R损伤明显降低了Sirt1 的表达量。但在H2S后处理后,与I/R组比较,Sirt1和PGC-1α蛋白表达水平及mRNA水平都明显提高了。而加入PI3K/Akt抑制剂LY294002 后,H2S后处理的缺血心肌改善作用被废除,Sirt1和PGC-1α蛋白表达水平及mRNA水平降低,提示PI3K/Akt/Sirt1 参与了H2S后处理对心肌I/R损伤的保护作用。
Sirt1几乎在所有的哺乳动物细胞中都有表达,但其亚细胞定位却不尽相同,有的仅在细胞质中表达,有的仅在细胞核中表达,还有一些在细胞质和细胞核中均有表达[9, 10]。已有研究表明Sirt1是一种可以往返于细胞核和细胞质的蛋白[11],而且Sirt1细胞核转移量对其发挥细胞保护功能至关重要[12]。因此,我们采用了免疫组化的方法检测了Sirt1的亚细胞定位。实验结果显示,在Control组中,Sirt1主要位于细胞核中,I/R损伤降低了Sirt1 的阳性细胞核指数。而与I/R组相比,H2S组提高了Sirt1 的阳性细胞核指数,提示H2S后处理通过调节Sirt1的蛋白表达量以及增加Sirt1阳性细胞核指数,保护大鼠缺血心肌。但Sirt1发挥其保护作用的具体机制将有待于进一步的深入研究。
综上所述,本实验研究结果表明H2S 后处理通过PI3K/Akt 信号通路增加Sirt1、PGC-1α的 表达及Sirt1阳性细胞核指数,减轻离体大鼠I /R 损伤。
(致谢:本实验研究主要在江南大学无锡医学院庞庆丰教授、邱丽颖教授实验室以及医学院综合实验平台完成,感谢庞庆丰教授和邱丽颖教授给予课题实验的悉心指导!)
| [1] | Ji Y, Pang Q F, Xu G, et al. Exogenous hydrogen sulfide postconditioning protects isolated rat hearts against ischemia-reperfusion injury[J].Eur J Pharmacol, 2008,587(1-3):1-7. |
| [2] | 于 水,杨海口,米 琰,等.PI3K/Akt 信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J].中国药理学通报,2010,26(6):759-64. Yu S,Yang H K,Mi Y,et al. Function of PI3K/Akt signaling pathway in exogenous hydrogen sulfide postconditioning on isolated rat hearts[J].Chin Pharmacol Bull,2010,26(6):759-64. |
| [3] | Cui Y, Wang H, Chen H, et al. Genetic analysis of the SIRT1 gene promoter in myocardial infarction[J].Biochem Biophys Res Commun,2012,426(2):232-6. |
| [4] | Tanno M,Sakamoto J,Miura T, et al. Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1[J].J Biol Chem,2007,282(9):6823-32. |
| [5] | 杨洁琼,胡明珠,季 永,等. AMPK/PGC-1α信号通路在硫化氢抗心肌缺血/再灌注损伤中的作用[J].中国药理学通报,2015,31(7):951-6. Yang J Q, Hu M Z, Ji Y, et al. Role of AMPK/PGC-1α pathway in cardioprotection of hydrogen sulfide against ischemia/reperfusion injury[J].Chin Pharmacol Bull,2015,31(7):951-6. |
| [6] | Li Y G, Zhu W, Tao J P, et al. Resveratrol protects cardiomyocytes from oxidative stress through SIRT1 and mitochondrial biogenesis signaling pathways[J].Biochem Biophys Res Commun,2013,438(2):270-6. |
| [7] | Wu D, Hu Q, Liu X, et al. Hydrogen sulfide protects against apoptosis under oxidative stress through SIRT1 pathway in H9c2 cardiomyocytes[J].Nitric Oxide,2015,46:204-12. |
| [8] | 季 永,张可璇,毛洪雅,等. 缝隙连接蛋白Cx43介导硫化氢后处理对大鼠心肌的保护作用[J].中国药理学通报,2013,29(7):999-1003. Ji Y, Zhang K X, Mao H Y, et al. Protective effects of Cx43-mediated exogenous hydrogen sulfide postconditinoing on rat hearts[J].Chin Pharmacolo Bull, 2013, 29(7):999-1003. |
| [9] | Hisahara S, Chiba S, Matsumoto H, et al. NAD-dependent histone deacetylase SIRT1 modulates neuronal differentiation by its nuclear translocation[J].Pharmacol Sci,2008,105(40):15599-604. |
| [10] | Sundaresan N R, Pillai V B, Gupta M P. Emerging roles of SIRT1 deacetylase in regulating cardiomyocyte survival and hypertrophy[J].J Mol Cell Cardiol,2011,51(4):614-8. |
| [11] | Gu C, Xing Y, Jiang L, et al. Impaired cardiac SIRT1 activity by carbonyl stress contributes to aging-related ischemic intolerance[J].PLoS One,2013,8(9):e74050. |
| [12] | Tanno M, Kuno A, Yano T, et al. Induction of manganese superoxide dismutase by nuclear translocation and activation of SIRT1 promotes cell survival in chronic heart failure[J].J Biol Chem,2010,285(11):8375-82. |

