


2. 南京中医药大学南京市江宁中医院, 江苏 南京 210023
 , CHEN Chang2, ZHANG Hai-lou1, XUE Wen-da1, WU Ru-yan1, REN Li1, TAO Wei-wei1, CHEN Gang1
, CHEN Chang2, ZHANG Hai-lou1, XUE Wen-da1, WU Ru-yan1, REN Li1, TAO Wei-wei1, CHEN Gang1

2. Nanjing Jiangning Hospital of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
产后抑郁症(postpartum depression,PPD)是产褥期精神综合征中最常见的一种类型,以分娩后出现情绪低落、精神抑郁为主要症状,临床以沮丧、悲伤、哭泣、易烦躁、易激动,甚至出现幻觉,或有自杀及伤婴等一系列表现[1]。PPD不仅存在抑郁,且常与许多躯体疾病相关联,严重危害产妇及婴儿身心健康,给家庭和社会也带来严重影响。
PPD的产生与多种因素相关,既往的应激性生活事件被认为是PPD发病的重要风险因素[2]。本研究团队前期以孕前应激法构建Bal B/C小鼠PPD模型,以朱丹溪“统治六郁”的方药越鞠丸合《金匮要略》的甘麦大枣汤即越鞠甘麦大枣汤干预PPD模型,发现越甘对PPD模型小鼠具有与氯胺酮一致的快速抗抑郁作用[3]。
目前,国内外对于快速抗抑郁的研究出现新的潜在的治疗靶点,信号传导系统的缺陷和异常活化研究成为其中一个热点。丝氨酸/苏氨酸蛋白激酶(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路被认为是抑郁症的一个发病机制,而研究证明西药氯胺酮可通过AKT/mTOR信号通路发挥其快速抗抑郁作用[4]。AKT参与细胞成长、分化、损伤保护等过程。AKT磷酸化可改变活性,其水平可由很多因子调控,其中包括哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)家族。mTOR是细胞生长和增殖的重要调节因子。大量研究显示mTOR信号通路调控异常与细胞增殖密切相关。AKT磷酸化与mTOR相互调控,AKT磷酸化水平增加可上调mTOR的表达[5]。
本实验在前期产后抑郁动物模型构建成功及药物作用有效的基础上,进一步从 AKT/mTOR信号通路的角度,探讨产后抑郁症海马AKT/mTOR 信号传导通路的变化及中药越甘对此信号通路的作用影响。
1 材料 1.1 实验动物清洁级健康成年♀ Bal B/C小鼠32只,体质量18~24g,军事医学科学院提供,动物合格证号: 2007000581303。适应性饲养 1 周后用于实验。动物房室温25 ℃、湿度为45%,明暗交替时间为12 h,动物可以自由饮食,自由进水。
1.2 实验药物实验用中药材购于南京中医药大学国医堂门诊,经本校药学院专家鉴定,为中国药典收载品种。越鞠甘麦大枣汤由苍术100 g、香附100 g、神曲100 g、栀子100 g、川芎100 g、炙甘草125 g、淮小麦250 g、大枣375 g组成,上述药物加8倍量水浸泡30 min,沸后煎煮1 h过滤,再加6倍量水按上法煎煮后过滤,合并两次药液,65 ℃减压旋蒸浓缩,浓缩后的药物终浓度为8.3 g·kg-1。配好的药物分装在10 mL离心管内,-20℃保存。盐酸氯胺酮(ketamine,Ket)注射液为福建古田制药厂生产(批号: 20140301)。临用前用生理盐水配成30g·L-1的药液。
2 方法 2.1 动物分组及模型的制备小鼠随机分为2组:空白对照组(n=8)和孕前应激模型组(n=24),空白对照组不予任何应激,孕前应激组小鼠给予每天6 h的束缚应激刺激(am 11:00~17:00)。3周后将孕前应激组以1♀1♂分笼交配饲养。大约4周后,母鼠分娩,被定义为PPD模型组。检测行为学指标以判断造模是否成功。
将PPD模型组母鼠随机分为3组:模型组(n=8),中药越甘组(n=8),西药氯胺酮组(n=8)。在产后21 d,越甘组以中药越甘汤剂0.1 mL·(10 g)-1灌胃(相当于每克小鼠给予越甘生药0.083 g);氯胺酮组以西药氯胺酮注射液0.1 mL·(10 g)-1腹腔注射(相当于每克小鼠给予氯胺酮0.03 mg)。24 h后,检测母鼠的行为学表现。
2.2 小鼠的行为学测试指标悬尾实验(tail suspension test,TST):采用上海吉量软件公司的悬尾测试视频分析系统,用胶带将小鼠悬挂于距台面30 cm的支架边缘上,胶带粘贴位置在距小鼠尾尖1cm处。每只小鼠共悬挂5min,记录其在最后4min的不动时间,即小鼠在空中停止挣扎,或仅有细小的肢体运动。
2.3 Western blot检测小鼠海马Akt/mTOR蛋白表达小鼠行为学测试结束后,立即进行冰上取脑,分离出海马组织。将海马组织称重后,组织置于裂解液中匀浆 10 min(重量体积比为 1 ∶10),匀浆后4 ℃ 12 000×g离心10 min,取上清,20 μL/管分装,-70 ℃保存。采用聚丙烯酰胺凝胶电泳法,取 5 μL样品/泳道上样,分离胶浓度为 8%。电泳结束后,湿转法将蛋白转至PVDF膜上(4 ℃ 300 mA电转60 min),转膜结束后,5% BSA室温封闭膜 1 h,分别用AKT/p-AKT (Cell Signaling Technology,9272S,4058 S,1 ∶500),mTOR/p-mTOR (Cell Signaling Technology,2972S,2971S,1 ∶500),兔抗 β-tubulin (北京中山金桥,1 ∶2 000)一抗 4 ℃孵育过夜。次日 TBST 漂洗 10 min×3 次后,二抗(1 ∶2 000)室温孵育1 h后加入 ECL 发光底物显色。Tanon-5200全自动化学发光图像分析系统显影分析。用目的蛋白与各自 β-tubulin蛋白灰度比值表示其蛋白量。实验重复3次。
2.4 统计学处理测量结果以x±s表示,应用 SPSS 20.0 统计分析软件对多组间数据进行单因素方差分析,post hoc test 选用LSD方法。
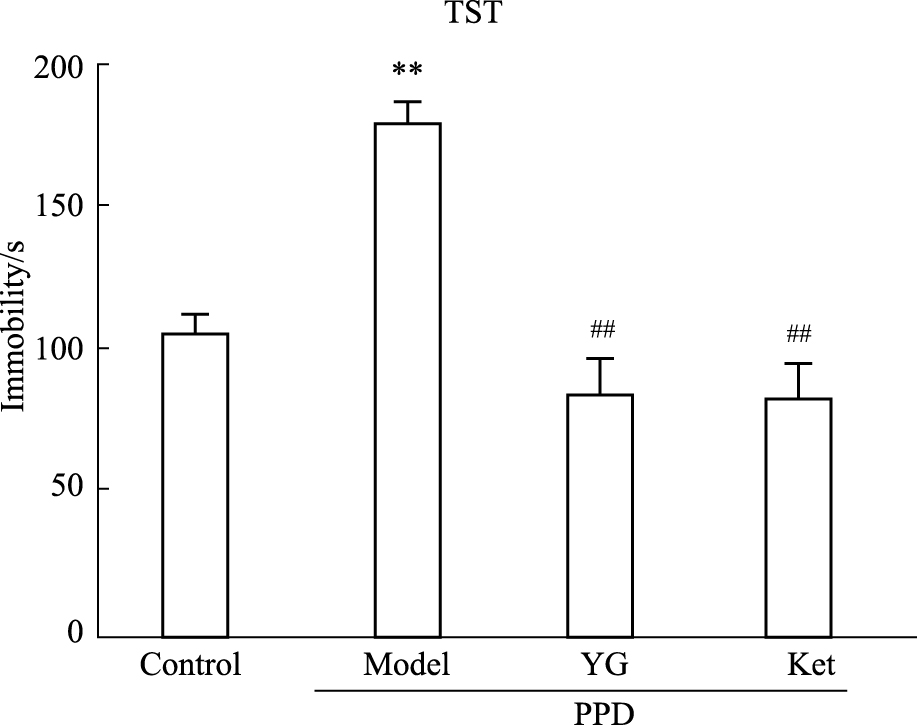
3 结果 3.1 PPD模型组母鼠悬尾测试的表现及越甘对其悬尾绝望不动时间的影响模型组母鼠绝望不动持续时间明显增加,与空白对照组相比差异有统计学意义(P < 0.01)。单次给予YG能够降低PPD模型组母鼠悬尾测试的不动时间,与氯胺酮效果一致(P < 0.01)。YG组与氯胺酮组差异无显著性。见Fig 1。
|
| Fig 1 Immobility in TST of two groups of mice **P < 0.01 vs control,##P < 0.01 vs model |
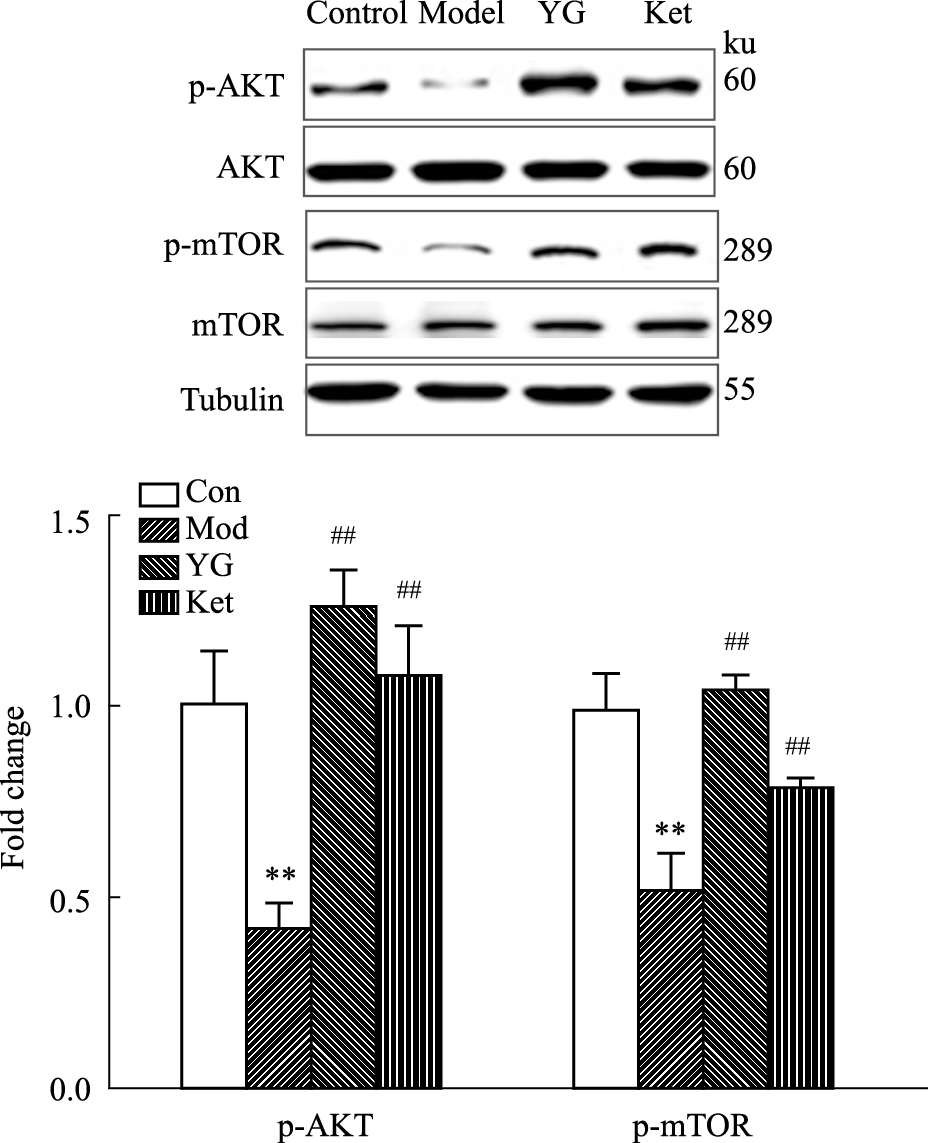
与对照组相比,模型组母鼠海马p-AKT和p-mTOR蛋白表达明显下调,差异具有统计学意义(P < 0.01,P < 0.01)。单次给予YG能够明显上调PPD模型组母鼠海马AKT/mTOR信号通路的蛋白表达(P < 0.01,P < 0.01),与氯胺酮效果一致(P < 0.01,P < 0.01)。见Fig 2。
|
| Fig 2 Changes in Akt/mTOR protein expression in two groups of mice **P < 0.01 vs control ,##P < 0.01 vs model |
本课题组先前的研究发现单次给药越甘24 h后能够明显改善孕前应激PPD小鼠模型的行为学指标[3]。与模型组相比,越甘治疗组可以明显增加模型母鼠的糖水偏爱百分比,降低模型母鼠在强迫游泳测试的绝望不动时间,缩短模型母鼠陌生环境摄食测试中的潜伏时间和增加其单位时间内摄食量,差异均有统计学意义。本研究进一步以悬尾测试证实越甘可以明显改善模型小鼠的绝望不动时间。在孕前应激PPD小鼠模型上,越甘具有跟西药氯胺酮一致的快速抗抑郁作用。
氯胺酮目前被公认为是可以用于治疗难治性抑郁、具有快速持久抗抑郁作用的药物[13]。在临床研究及动物实验上,单次亚麻醉剂量的氯胺酮具有快速持久的抗抑郁的作用[14-15]。但是,氯胺酮具有神经毒性和成瘾性等副作用,限制了其临床使用。研究证明氯胺酮可以通过调控AKT/mTOR信号通路发挥其快速抗抑郁作用[4]。AKT 信号转导通路是近年来发现的一条参与细胞增殖调控的重要信号通路。AKT 是一种PKC 相关的丝氨酸/苏氨酸激酶,也称蛋白激酶B(proteinkinase B,PKB),有连接酪氨酸磷酸化和丝/苏氨酸激酶磷酸化的作用。它可以被许多生长因子激活,参与多条信号转导途径[6, 7]。AKT是促进细胞生存和维持细胞正常功能关键的信息分子,并且构成细胞对外应激反应过程中的促进细胞生长、抑制细胞凋亡和维持细胞重要功能的信号传递链。激活后的AKT将信号传递给多种下游底物,从而控制转录、翻译、细胞周期、凋亡等生物学效应。活化的AKT 可提高海马区的神经再生。 国外学者等发现20 例重性抑郁症自杀患者的脑组织中,AKT 蛋白活性明显降低[8]。另外还有学者报道AKT 可增强海马干细胞的功能,促进抗抑郁药物的疗效[9]。
mTOR是AKT的重要底物之一。AKT通过直接和间接两种途径激活mTOR。mTOR通过控制其下游与翻译和转录有关的多种蛋白的磷酸化来发挥其生物学作用,在细胞的生存、生长和增殖中起中心调控作用。研究表明mTOR 也具有促进神经再生作用[9, 10]。有学者[4]发现氯胺酮的快速抗抑郁可能与其上调mTOR的表达,从而快速促进神经轴突再生有关。本课题组前期研究[11]也发现,在慢性应激小鼠模型上,越鞠丸具有与氯胺酮相似的快速抗抑郁作用,其机制与调控AKT/mTOR信号通路有关。
本实验结果显示产后抑郁模型组小鼠海马AKT、mTOR磷酸化蛋白表达均较正常组明显下调,经中药越甘及西药氯胺酮治疗后,其表达均明显上升,提示药物的抗抑郁作用可能是通过激活AKT/mTOR 信号传递通路级联反应,促进神经营养因子发挥神经存活功能,增强突触传导及神经可塑性的调节,逐步发挥抗抑郁的作用。这与国外学者的研究结果是一致的[12],其发现氯胺酮治疗抑郁症患者后,病人外周血清中AKT、mTOR 表达明显上调。根据研究结果,我们推测中药越甘快速治疗产后抑郁症的机制可能是通过调控海马中AKT/mTOR信号通路,修复由抑郁导致下降的神经突触功能,从而促进神经再生,发挥快速抗抑郁作用。
总之,本实验发现AKT/mTOR 信号通路在产后抑郁症模型动物海马中异常表达,此信号通路可能与产后抑郁的发生、发展密切相关,中药越甘可通过调控该信号通路发挥其快速治疗产后抑郁症的作用。我们对产后抑郁症模型动物脑中信号转导通路的研究将会进一步阐明产后抑郁症的潜在病理机制,了解快速抗抑郁药物的作用位点,揭示中药越甘快速治疗产后抑郁症的药物机制,为临床治疗这种疾病提供更好的药物选择。
(致谢:本文实验在南京中医药大学校基础医学院中医脑病重点实验室完成,特此致谢。)
| [1] | 张荣莲,陈起燕,李艳华,等.产后抑郁症发病因素的探讨[J].中华妇产科杂志.1999,34(4):231-3. Zhang R L, Chen Q Y, Li Y H, et al.Study for the factors related to postpartum depression[J].Chin J Obstetrics Gynecol, 1999,34(4):231-3. |
| [2] | Kendler K S, Kessler R C, Walters E E, et al.Stressful life events, genetic liability, and onset of an episode of major depression in women[J].Am J Psychiatry, 1995,152(6):833-42. |
| [3] | 夏宝妹,张海楼,薛文达,等.产后抑郁小鼠模型的构建及越鞠甘麦大枣汤对其抑郁样行为的影响[J].中国药理学通报,2015,31(9):1324-8. Xia B M, Zhang H L, Xue W D,et al.Postpartum depression animal model in mice and the effect of the Yuejuganmaidazaotang on the PPD model[J].Chin Pharmacol Bull,2015,31(9):1324-8. |
| [4] | Li N, Lee B, Liu R J, et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J]. Science, 2010,329(5994):959-64. |
| [5] | Obata T. Adenosine production and its interaction with protection of ischemic and reperfusion injury of the myocardium[J]. Life Sci, 2002,71(18):2083-103. |
| [6] | Thompson J E,Thompson C B.Putting the Rap on Akt[J]. J Clin Oncol, 2004,1522(20):4217-26. |
| [7] | Zhou H, Li X M,Meinkoth J, et al. Akt regulates cell survival and apotosis at a postmitochondrial level[J].J Cell Biol, 2000,151(3):483-94. |
| [8] | Karege F, Perroud N, Burkhardt S, et al. Alteration in kinase activity but not in protein levels of protein kinase B and glycogen synthase kinase-3beta in ventral prefrontal cortex of depressed suicide victims[J]. Biol Psychiatry, 2007,61(2):240-5. |
| [9] | Kalkman H O. The role of the phosphatidylinositide 3-kinase-protein kinase B pathway in schizophrenia[J].Pharmacol Ther,2006,110(1):117-34. |
| [10] | Saxe J P, Wu H, Kelly T K, et al. A phenotypic small-molecule screen identifies an orphan ligand-receptor pair that regulates neural stem cell differentiation[J].Chem Biol, 2007,14(9):1019-30. |
| [11] | Tang J J, Xue W D, Xia B M, et al. Fast-onset antidepressants normalize mTOR activity and NMDA receptor NR1 subunit expression in the prefrontal cortex of chronically stressed mice[J]. Sci Rep, 2015, 1-10. |
| [12] | Denk M C,Rewerts C, Holsboer F,et al. Monitoring ketamine treatment response in a depressed patient via peripheral mammalian target of rapamycin activation[J]. Am J Psychiatry, 2011,168(7):751-2. |