


2. 福建医科大学基础医学院生物化学与分子生物学系, 福建 福州 350108
2. Dept of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Fujian Medical University, Fuzhou 350108, China
肺动脉高压(pulmonary arterial hypertension,PAH)发病的核心事件是肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)紧张性增强、过度增殖和凋亡不足而引起的肺动脉收缩加强和血管重构[1]。在PAH发病过程中,Ca2+因能同时影响PASMCs的收缩、增殖和凋亡而成为PAH研究的热点之一。最近发现,钙池操纵性钙通道(store-operated calcium channel,SOCC)对细胞内钙的稳态起重要的调节作用,SOCC是由经典瞬间受体电位(TRP Canonical,TRPC)亚家族和Orai家族组成的异多聚体蛋白,受内质网钙池感受器基质相互作用分子1(stromal interaction molecule 1,STIM1)调控[2]。我们前期研究发现PAH动物模型上存在SOCC表达和功能的上调,而且这种上调参与了PAH的发病[3, 4, 5]。由于STIM1可调节多种正常细胞和肿瘤细胞的增殖[6, 7],我们推测STIM1可通过调节血管平滑肌细胞增殖而影响PAH发生,但目前相关研究尚少见报道。本研究首先建立肺动脉高压动物模型,检测STIM1蛋白和mRNA的表达,随后在培养的动脉平滑肌细胞中过表达STIM1,观察其对细胞增殖以及对Akt/mTOR增殖信号途径的影响,拟探讨STIM1对平滑肌细胞增殖的影响及可能的机制,为PAH防治提供新靶点。
1 材料与方法 1.1 材料SD大鼠,♂,体质量160~180 g,福州吴氏实验动物有限公司;动脉平滑肌细胞A7R5,中国科学院上海细胞库;胎牛血清,Hyclone公司;F-12培养基、青链霉素、TRIzol,Invitrogen公司;胶原酶、木瓜蛋白酶、牛血清白蛋白、野百合碱(MCT)、HEPES、D-葡萄糖、抑肽酶、正钒酸钠,Sigma公司;Rvert Aid First Strand cDNA合成试剂盒,Thermo Fermentas公司;X-tremeGENE HP DNA转染试剂、SYBRGreen荧光定量PCR试剂盒,罗氏公司;兔抗STIM1抗体,Alomone Labs公司;兔抗β-actin、Akt、p-Akt、mTOR、p-mTOR、p70-S6K、p-p70-S6K、4E-BP1、p-4E-BP1抗体及第二抗体,Cell Signaling公司;CCK-8试剂盒,同仁化学研究所;蛋白定量试剂盒、RIPA裂解液、PMSF、抗体稀释液、ECL发光试剂盒,碧云天生物技术研究所;质粒pEX-SP-YFP-STIM1及对照质粒购自Addgene,经本实验室测序验证。其余试剂均为进口或国产分析纯。
1.2 方法 1.2.1 MCT诱导的慢性肺动脉高压大鼠模型的建立健康SD大鼠,♂,体质量160~180 g,随机分成正常对照组(CON组)和MCT模型组(MCT组)。CON组:SD大鼠正常饲养3周,MCT组:按60 mg·kg-1剂量一次性腹腔注射2% MCT,正常饲养3周。
1.2.2 右心室收缩压(RVSP)和右心重量指数(RVMI)测定CON组和MCT组大鼠分别腹腔注射肝素(Heparin,50 IU/100 g),在5 min后氨基甲酸乙酯(1 g·kg-1)腹腔麻醉,从右颈外静脉插管直到右心室,记录大鼠RVSP。测完RVSP后,迅速开胸取出心脏及肺。沿房室交界处剪去左右心房及大血管,分离右心室(RV)及左心室+室间隔(LV+S),用滤纸吸去多余水分,分别称重,计算RV/(LV+S)即RVMI。
1.2.3 肺动脉形态学检测将取下的左肺用大头针固定在泡沫板上,在距离肺尖约0.5 cm处切取肺组织,肺组织在负压中性甲醛中固定24 h、石蜡切片、HE染色。光镜下观察CON和MCT组的肺血管形态。
1.2.4 大鼠肺动脉组织STIM1的表达对照组大鼠和模型组大鼠的肺动脉标本在液氮中充分研磨后, 用TRIzol试剂提取RNA,实时定量PCR技术测定STIM1基因表达水平(18S rRNA引物:5′-GTCTGTGATGCCCTTAGATG-3′,5′-AGCTTATGACCCGCACTTAC-3;STIM1引物: 5′-GAGCACCGAACAGTGGAAGT-3,5′-GCCTCTCTGCATTTTGCTTC-3′)。肺动脉标本以RIPA细胞裂解液(含1 mmol·L-1 PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验,测定STIM1蛋白表达水平。
1.2.5 动脉平滑肌细胞A7R5的培养、转染与鉴定A7R5细胞于F-12培养基(含10%胎牛血清和1%青链霉素)、在5% CO2和37 ℃下正常培养。细胞按合适的比例接种6孔板中,每孔加培养液2 mL,培养约24 h,使细胞生长的汇合度在95%左右。参照X-tremeGENE HP转染试剂说明书进行转染实验,简述如下:配制X-tremeGENE HP转染试剂工作液并按一定比例与配好的0.01 g·L-1质粒溶液混合,在15℃~25℃下孵育15 min;取出细胞,无需弃去生长培养基,将转染混合物滴加至细胞中,轻柔振荡混匀后,37 ℃培养72 h后,提取总蛋白,采用Western blot技术测定STIM1蛋白表达量。实验分组:① 空白组:仅加转染试剂,不加质粒;② 对照组:加入空质粒;③ 实验组:加入STIM1过表达质粒。
1.2.6 细胞增殖实验转染72 h后,收集对照组和实验组细胞,制成适当浓度的单细胞悬液(5×107·L-1),接种至96孔板,每孔100 μL。每组细胞设5个复孔,37 ℃和5% CO2实验条件下常规培养。于接种后d 1、2、3、4、5各取出一块96孔板进行检测。每孔加入CCK-8 10 μL,37℃培养1 h后,酶标仪上检测450 nm处的光吸收度,以培养时间为横坐标,A450为纵坐标绘制细胞生长曲线。实验重复3次。
1.2.7 转染STIM1对Akt/mTOR途径蛋白表达的影响转染72 h后,收集各组细胞,PBS洗2次,加入RIPA细胞裂解液(含1 mmol·L-1 PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验。10% SDS-PAGE电泳后行转膜印迹,分别用各种第一抗体与膜上的抗原结合,然后用HRP偶联的二抗与其反应,用ECL化学发光试剂检测,经压片曝光后,显影和定影。采用Phoretix 1D V2003.03图像分析软件测定和比较各组蛋白表达情况。
1.2.8 统计学分析所有数据均采用SPSS软件进行统计学处理,实验数据以x± s 表示,组间比较采用t检验。
2 结果 2.1 MCT诱发肺动脉高压大鼠模型鉴定 2.1.1 血流动力学及RVMI腹腔注射MCT 3周后,MCT组的RVSP明显高于CON组[(57.4±10.3) mmHg vs (18.1±3.8) mmHg,P < 0.01](1 mmHg=0.133 kPa),而MCT组的平均体循环动脉压(mean systemic arterial pressure,mSAP)与CON相比没有明显差异[(102.4±12.1) mmHg vs (104.8±10.1) mmHg,P>0.05],提示右心室内压增高;MCT组的RVMI明显高于CON组[(53.0±9.2)% vs (29.5±4.8)%,P < 0.05],表明右心重构、肥大,提示慢性PAH大鼠模型成功建立,见Fig 1A~D。
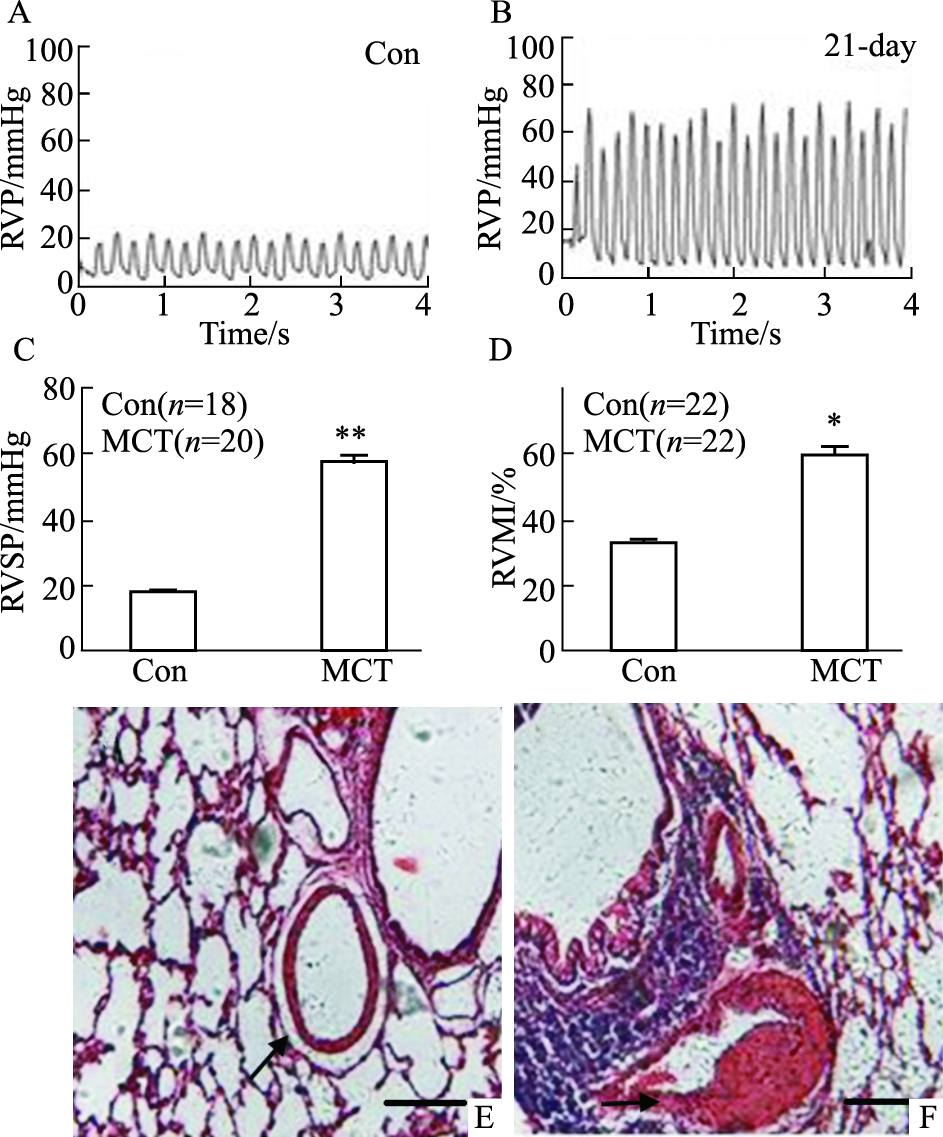
|
| Fig 1 Characterization of MCT-induced rat pulmonary hypertension model The primitive RVP curve in CON (A) and MCT(B). MCT-induced increases in right ventricle systolic pressure (RVSP, P<0.01 vs CON) (C) and RVMI(RV/LV+S, *P < 0.05 vs CON) (D). The Representative section (HE stain) of pulmonary arteries from CON (E) and MCT (F) rats;1 mmHg=0.133 kPa. |
镜下可见CON组的气管上皮完整,软骨片缺如,气管外包绕一层平滑肌,与其伴行的肺动脉内皮完整,中膜由一层平滑肌组成。MCT组气管上皮完整,软骨片亦缺如,气管外包绕一层平滑肌,与其伴行的肺动脉内皮完整,可见中膜由一层平滑肌组成。与CON组中外径相近的肺小动脉相比,MCT组肌壁明显增厚伴玻璃样变,管腔狭窄甚至闭塞,内膜纤维化,出现了肺血管重构,说明MCT能使肺动脉平滑肌增生肥厚,见图 1 E~F。
2.2 STIM1在肺动脉高压组织中的表达以实时定量PCR和Western blot法分别检测野百合碱诱导大鼠肺动脉高压模型中STIM1 mRNA和蛋白质相对于正常大鼠的表达,结果显示,模型组STIM1 mRNA和蛋白的表达量分别是对照组的(2.19±0.49)和(1.66±0.32)倍,两者相比 差异存在显著性,见Fig 2。
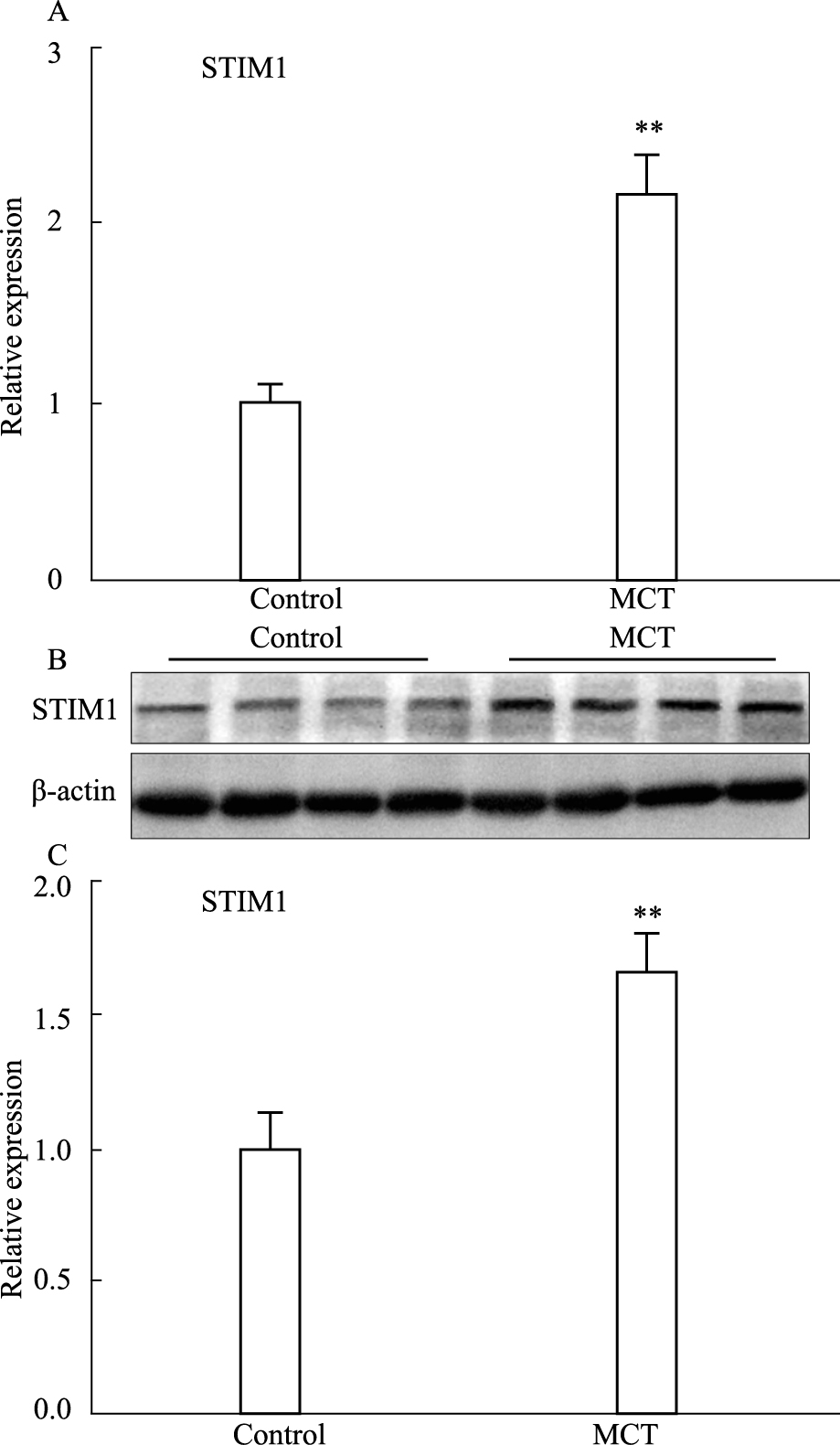
|
| Fig 2 Expression of STIM1 in pulmonary arteries of MCT-induced hypertensive rat A: STIM1 mRNA expressions in control and MCT-treated rats;B: STIM1 protein expressions in control and MCT-treated rats; C: Bar figure of STIM1 protein expressions, **P < 0.01 vs control. |
转染STIM1质粒明显增加A7R5的STIM1蛋白表达,Western blot结果出现明显的STIM1-YFP融合蛋白条带,而空质粒转染组无此条带,见Fig 3。细胞生长曲线结果显示:培养的A7R5在d 2开始增殖,d 3开始进入对数生长期,STIM1转染组与对照组相比,细胞的生长速度加快,说明所得到的STIM1高表达可促进细胞增殖,见Fig 3。
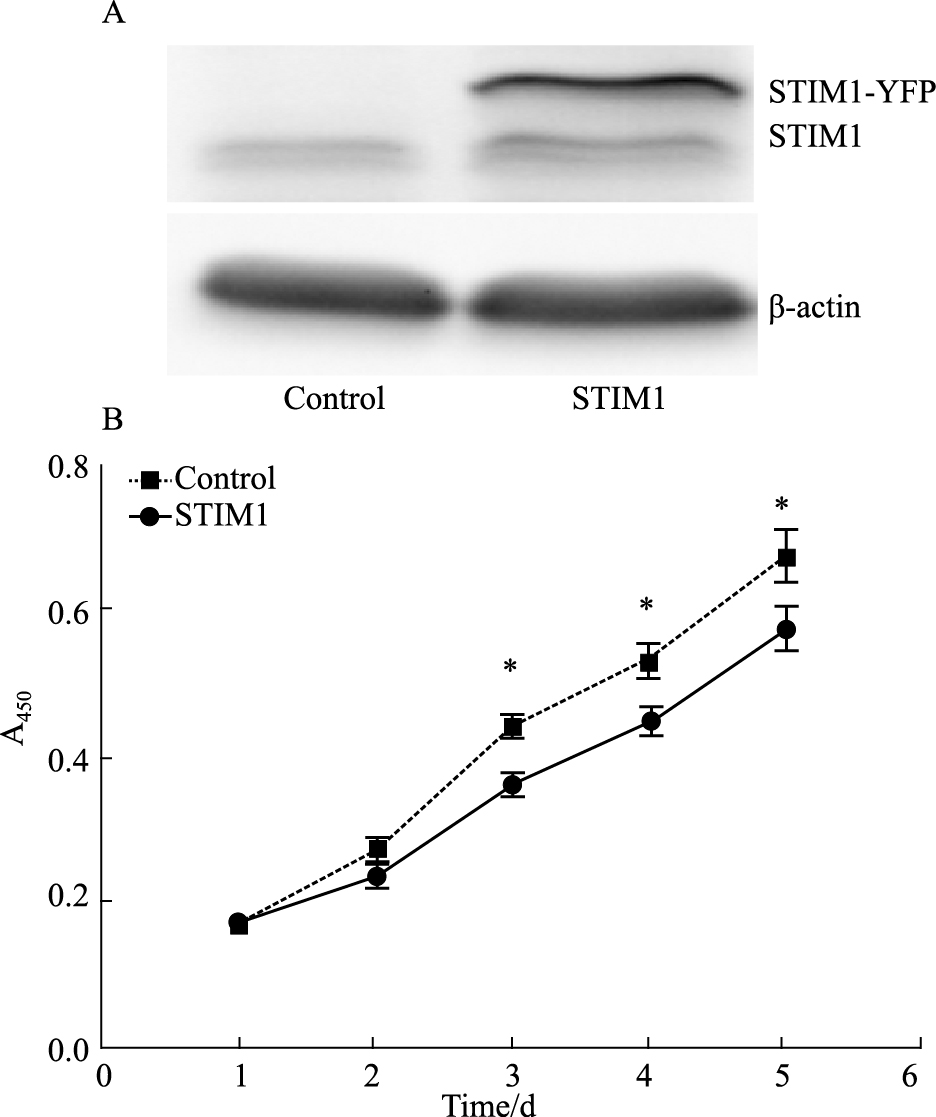
|
| Fig 3 Effects of STIM1 overexpression on A7R5 cells proliferation A: Overexpression of STIM1 in arterial smooth muscle cells A7R5; B: Effects of STIM1 overexpression on A7R5 cells proliferation, *P < 0.05 vs control. |
Western blot结果显示,转染STIM1可明显增加p-Akt、p-mTOR、p-p70-S6K、p-4E-BP1的表达,而对Akt、mTOR、p70-S6K和4E-BP1的表达没有影响,见Fig 4。
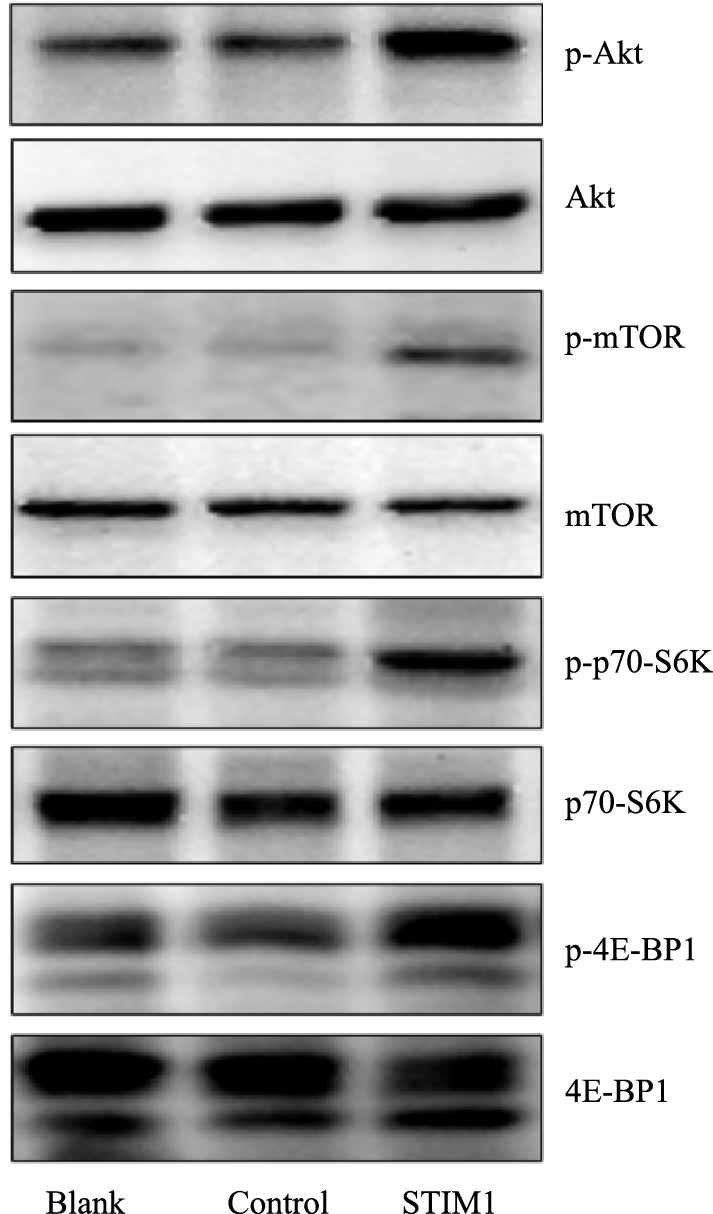
|
| Fig 4 Effects of STIM1 overexpression on Akt-mTOR signaling |
MCT是一种双吡咯类生物碱,在肝脏内经酶的作用后形成野百合碱吡咯(MCTP),沉积于肺小动脉壁和肺毛细血管,导致肺血管内皮发生广泛、不可逆性损伤,导致肺动脉高压,能很好的模拟急进型PAH的发生过程[8]。本研究显示,大鼠腹腔注射MCT模型组RVSP相比正常组大鼠明显升高(P < 0.05)。HE染色结果显示肺动脉肌壁明显增厚,管腔狭窄甚至闭塞,内膜纤维化;小血管壁未见正常结构并有纤维素样渗出,管周有炎症细胞大量浸润,结合大鼠一系列肺动脉高压症状的出现,提示成功建立肺高压大鼠模型。
动脉平滑肌细胞膜上的钙池操纵性钙通道(SOCC)参与了细胞内Ca2+稳态的维持,对动脉平滑肌的收缩和增殖起重要作用。它是由经典瞬间受体电位(TRP Canonical,TRPC)亚家族和Orai家族组成的异多聚体蛋白,受内质网钙感受器STIM1调控,当内质网腔Ca2+充盈时,STIM1在内质网膜上均匀分布;Ca2+池耗竭使STIM1在内质网上形成多聚体,作用于质膜上TRPC/Orai复合体,触发SOCC开放。我们前期发现,在慢性缺氧和MCT诱发的PAH大鼠模型上,SOCC膜通道的组分之一TRPC1在PASMCs的表达上调[3, 4],提高SOCC介导的Ca2+内流,引起PASMCs的静息[Ca2+]i升高和基础张力增加;耗竭细胞Ca2+池可激活Ca2+内流和血管收缩,SOCC抑制剂(Gd3+、La3+、SKF-96365)不仅抑制SOC介导的钙内流,也抑制内皮素引起的血管收缩[3 ,5]。这些结果提示,PAH动物模型存在SOCC功能的上调。
为确定PAH动物是否存在SOCC关键分子STIM1表达上调,本研究采用实时PCR和Western blot法分别检测MCT诱导大鼠肺高压模型中STIM1 mRNA和蛋白质相对于正常大鼠的表达,结果显示,MCT诱导产生的肺高压大鼠肺动脉组织的STIM1 mRNA和蛋白质表达水平均明显高于对照大鼠,证实肺高压模型上存在STIM1的表达上调。Soboloff等[9]测定了过表达STIM1、Orai1对HEK293细胞钙池操纵性钙内流(store-operated calcium entry,SOCE)的影响,发现单独过表达STIM1可适度增加SOCE(2~3倍),单独过表达Orai1可明显抑制SOCE(下降至30%~40%),而共表达STIM1、Orai1可大幅度增加SOCE(20~30倍)。本研究室前期测定了MCT肺高压大鼠模型中Orai1的表达,发现Orai1表达明显增加(另文发表)。因此,本研究中模型组大鼠肺动脉STIM1表达的上调,可与Orai1的增加形成协同效应,导致肺动脉SOCE的增高。
对多种肿瘤或正常细胞的研究显示,SOCE及其主要成分STIM1与细胞增殖密切相关[10, 11]。本研究中,为探讨STIM1对动脉平滑肌细胞增殖的影响,我们在体外培养的动脉平滑肌细胞A7R5上建立STIM1瞬时高表达模型,观察其对细胞增殖的影响。结果显示,过表达STIM1可促进A7R5的增殖,这一结果说明,模型大鼠肺动脉组织STIM1高表达可促进动脉平滑肌细胞增殖,可能对肺动脉高压形成起促进作用。Potier等[12]采用RNAi技术在A7R5上抑制STIM1和Orai1的表达,发现可大幅度降低SOCE,并抑制A7R5细胞的增殖和迁移,与我们的结果是一致的。
PI3K/Akt/mTOR途径是调节细胞增殖的重要信号通路,多种生长因子可激活PI3K/Akt信号,进而激活mTOR复合物,增强细胞能量代谢及蛋白质、脂类合成,促进细胞生长[13]。研究显示,mTOR因能促进细胞增殖,抑制细胞凋亡,对PAH的发病起到促进作用[14, 15]。刘杰等[16]采用雷帕霉素对MCT诱导的PAH大鼠进行实验性治疗,发现与野百合碱组相比,雷帕霉素干预组大鼠右心室收缩压明显改善,右心室肥厚指数明显降低,肺动脉重构程度明显减轻,证明mTOR在肺动脉高压发病中起重要作用。
本研究在动脉平滑肌细胞A7R5中过表达STIM1,观察STIM1对Akt/mTOR信号途径的调节,结果显示,Akt和mTOR磷酸化水平增加而蛋白质水平不变,提示Akt/mTOR途径活化。P70S6K和4E-BP1是mTOR的直接底物,其磷酸化水平常用于判断mTOR的活化,本研究发现STIM1过表达可增强p70S6K和4E-BP1的磷酸化,证明了STIM1可促进mTOR的活化,这可能与肺动脉高压发病中PASMCs增殖能力增强有关。Selvaraj等[17]在帕金森病的细胞模型上的研究发现,过表达STIM1/TRPC1,可升高神经细胞的钙池操纵性Ca2+内流,并进而激活Akt/mTOR途径,促进细胞生存和对抗神经毒素MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)的能力。Selvaraj等[18]的另一项研究发现,白藜芦醇可抑制STIM1并进而抑制mTOR途径,诱导前列腺癌细胞死亡,而过表达STIM1可增强mTOR磷酸化,抑制内质网应激和细胞死亡。这些结果说明,STIM1对Akt/mTOR的调节可能是多种细胞都存在的普适性的调节机制。
综上所述,我们在MCT诱导的肺动脉高压大鼠模型中,观察到了SOCC关键分子STIM1的mRNA和蛋白质的高表达;在大鼠动脉平滑肌细胞A7R5中过表达STIM1,发现细胞增殖能力增强和Akt/mTOR途径活化。这些结果提示,在PAH发病过程中,STIM1可能通过上调Akt/mTOR信号,促进PASMCs增殖和PAH发生。STIM1调节MCT诱导的肺高压发病的确切机制,以及在其他肺动脉高压大鼠模型中的作用仍在进一步研究中。
(致谢:本文在福建医科大学基础医学院心血管研究室完成,特此致谢!)
| [1] | Morrell N W, Adnot S, Archer S L, et al. Cellular and molecular basis of pulmonary arterial hypertension[J]. J Am Coll Cardiol, 2009, 54(1):S20-31. |
| [2] | Collins H E, Zhu-Mauldin X, Marchase R B, et al. STIM1/Orai1-mediated SOCE:current perspectives and potential roles in cardiac function and pathology[J]. Am J Physiol Heart Circ Physiol,2013,305(4):H446-58. |
| [3] | Liu X R, Zhang M F, Yang N, et al. Enhanced store-operated Ca2+ entry and TRPC channel expression in pulmonary arteries of monocrotaline-induced pulmonary hypertensive rats[J]. Am J Physiol Cell Physiol, 2012,302(1):C77-87. |
| [4] | 穆云萍, 焦海霞, 朱壮丽, 等. 慢性低氧大鼠TRPC1表达与肺动脉收缩变化时间曲线关系[J]. 中国药理学通报, 2014, 30(12):1667-71. Mu Y P,Jiao H X,Zhu Z L,et al.Relationship of time-course curve between the expression of TRPC1 and vascular tone of pulmonary arteries in chronic hypoxia pulmonary hypertension rats[J].Chin Pharmacol Bull,2014,30(12):1667. |
| [5] | 张明芳, 刘晓如, 杨娜, 等. TRPC6介导肺动脉高压大鼠肺动脉张力和肺动脉平滑肌细胞张力Ca2+的浓度升高[J]. 生理学报, 2010,62(1):55-62. Zhang M F, Liu X R, Yang N, et al. TRPC6 mediated the enhancement of pulmonary arterialvascular tone and intracellular Ca2+ concentration of pulmonary arterial smooth muscle cells in pulmonary hypertension rats[J]. Acta Physiol Sin, 2010, 62(1):55-62. |
| [6] | Zou J J, Gao Y D, Geng S, et al. Role of STIM1/Orai1-mediated store-operated Ca(2)(+) entry in airway smooth muscle cell proliferation[J]. J Appl Physiol, 2011,110(5):1256-63. |
| [7] | Li G, Zhang Z, Wang R, et al. Suppression of STIM1 inhibits human glioblastoma cell proliferation and induces G0/G1 phase arrest[J]. J Exp Clin Cancer Res, 2013, 32:20. |
| [8] | 胡莹, 焦海霞, 王瑞幸, 等. 三七皂苷R1对肺高压大鼠模型肺动脉的舒张作用[J]. 中国药理学通报, 2013, 29(11):1572-6. Hu Y,Jiao H X,Wang R X,et al.Vasodilation of notoginsenoside R1 on pulmonary arteries of pulmonary hypertensive rats[J].Chin Pharmacol Bull,2013,29(11):1572-6. |
| [9] | Soboloff J, Spassova M A, Tang X D, et al. Orai1 and STIM reconstitute store-operated calcium channel function[J]. J Biol Chem, 2006, 281(30):20661-5. |
| [10] | Yoshida J, Iwabuchi K, Matsui T, et al. Knockdown of stromal interaction molecule 1(STIM1) suppresses store-operated calcium entry, cell proliferation and tumorigenicity in human epidermoid carcinoma A431 cells[J]. Biochem Pharmacol, 2012, 84(12):1592-603. |
| [11] | Li G, Zhang Z, Wang R, et al. Suppression of STIM1 inhibits human glioblastoma cell proliferation and induces G0/G1 phase arrest[J]. J Exp Clin Cancer Res, 2013, 32(1):20. |
| [12] | Potier M, Gonzalez J C, Motiani R K, et al. Evidence for STIM1- and Orai1-dependent store-operated calcium influx through ICRAC in vascular smooth muscle cells:role in proliferation and migration[J]. FASEB J, 2009, 23:2425-37. |
| [13] | Laplante M, Sabatini D M. mTOR signaling in growth control and disease[J]. Cell, 2012,149(2):274-93. |
| [14] | Krymskaya V P, Snow J, Cesarone G, et al. mTOR is required for pulmonary arterial vascular smooth muscle cell proliferation under chronic hypoxia[J]. FASEB J, 2011,25(6):1922-33. |
| [15] | Goncharov D A, Kudryashova T V, Ziai H, et al. Mammalian target of rapamycin complex 2(mTORC2) coordinates pulmonary artery smooth muscle cell metabolism, proliferation, and survival in pulmonary arterial hypertension[J]. Circulation, 2014,129(8):864-74. |
| [16] | 刘杰, 杜雨轩, 王望,等. 雷帕霉素对野百合碱诱导的大鼠肺动脉高压及肺血管重构的影响[J]. 首都医科大学学报, 2013, 34(4):554-8. Liu J, Du Y X, Wang W, et al. Effects of rapamycin on monocrotaline-induced pulmonary hypertension and pulmonary arterial remodeling in rats[J]. J Cap Med Univ, 2013, 34(4):554-8. |
| [17] | Selvaraj S, Sun Y, Watt J A, et al. Neurotoxin-induced ER stress in mouse dopaminergic neurons involves downregulation of TRPC1 and inhibition of AKT/mTOR signaling[J]. J Clin Invest, 2012,122(4):1354-67. |
| [18] | Selvaraj S, Sun Y, Sukumaran P, Singh B B. Resveratrol activates autophagic cell death in prostate cancer cells via downregulation of STIM1 and the mTOR pathway[J]. Mol Carcinog, 2015 Apr27. |

