


2. 广东省人民医院 广东省医学科学院, 广东 广州 510080
 , PAN Yu2, LI Xiao-hong2, JIANG Lin1, 2, YANG Xiang-yu1, 2, WU Yue-heng2, LEI He-ping2, YU Xi-yong2
, PAN Yu2, LI Xiao-hong2, JIANG Lin1, 2, YANG Xiang-yu1, 2, WU Yue-heng2, LEI He-ping2, YU Xi-yong2
2. Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
在心肌梗死、心肌肥厚及动脉粥样硬化等心脏疾病中,心肌细胞功能受损,氧自由基的堆积,导致心肌组织处于一个氧化应激的环境当中,进而使其发生不可逆的损伤,加快疾病的进程。然而,目前对于这类疾病的治疗都无法逆转已经缺血坏死的心肌组织。研究表明,心肌损伤后心肌组织中的心脏干细胞(cardiac progenitor cells,CPCs)在心肌修复过程中发挥着不可忽视的作用,但是,CPCs的再生能力有限,其发挥作用的一个重要途径就是通过旁分泌作用,外泌体(exosome,Exo)便是心肌缺血保护作用中的重要旁分泌因子。Exosome是一种具有脂质双分子层结构的囊泡,直径在30~100 nm,其内部包裹着许多蛋白质、mRNAs、非编码 RNA等物质,参与细胞与细胞之间的信号传导。在心肌组织中,CPCs来源的exosome可以携带一些重要物质的传递到临近心肌细胞,发挥心肌缺血保护的重要作用。但是,Sca-1+CPC-exosome对于过氧化氢(H2O2)诱导的心肌细胞的氧化应激损伤是否具有保护作用尚未见报道。因此,本研究主要通过体外分离出小鼠的CPCs,建立CPCs分泌的exosome的成熟分离方法,同时构建心肌细胞氧化应激模型,从而观察CPC-exosome对于氧化应激条件下心肌细胞在的抗凋亡作用,为缓解心脏疾病氧化应激的损伤提供理论基础。
1 材料与方法 1.1 动物和试剂本研究选用4周龄的♂ C57BL/6J小鼠,由中山大学实验动物中心提供。主要试剂:CPC分离提取的试剂盒(Stemcell technology),II胶原酶(Gibco),Exo-Quick exosome提取试剂盒(System bioscience),exosome-depleted FBS(System bioscience),EBM-2内皮培养基(Lonza),M199基础培养基(Corning),DMEM培养基(Hyclone),30%过氧化氢(Sigma),PKH26 Dye试剂盒(Sigma),CD63抗体(Abcam),Sca-1-FITC抗体(Abcam),β-actin抗体(国产),Caspase-3(Cell Signaling Technology),抗兔二抗(Cell Signaling Technology),SDS-PAGE凝胶电泳试剂盒(Bio-Rad),脱脂奶粉(国产),PVDF膜(Millipore),ECL发光液(Bioworld)。
1.2 CPCs的分离培养用脱颈的方法处死小鼠,酒精完全浸泡后打开胸腔取出心脏,用冷PBS洗去残留的血液后,剪碎心脏至1 mm3的组织块,用0.05% Ⅱ胶原酶37℃恒温振摇水浴消化8 min,轻轻吹打后静置1 min,取上清用含10% FBS的全培中和,循环消化4~5次,直至心肌组织块消化完全为止,将收集的上清用200目筛网过滤后,1 000 r·min-1离心7 min,弃去上清液,用适量磁珠分选缓冲液将细胞重悬,接下来用磁珠分选出Sca-1+CPCs,按照Stem cell technology公司的试剂盒说明书操作,用CPCs维持培养基(EGM-2、M199、bFGF、FBS非必需氨基酸、双抗)进行培养。
1.3 免疫荧光法鉴定细胞表型待细胞长至70%~80%时,PBS洗涤3次,4%多聚甲醛固定10 min,PBS洗3次,每次5 min,0.1% Triton-100通透15 min,2% BSA+0.2% Tween 20封闭2 h,用1% BSA稀释一抗Sca-1(1:100)4℃孵育过夜,除去一抗,PBS洗3次,每次5 min,用1%BSA稀释抗兔荧光二抗-FITC(1:300)室温避光孵育2 h,吸除二抗,PBS洗3次,每次5 min,待水分快干时用含有DAPI的封片剂封片后用荧光显微镜观察拍片。
1.4 流式细胞仪进行纯度分析CPCs汇合至90%,PBS洗涤2次,加入适量0.25%胰酶(含EDTA)消化约2 min,用全培中和,吹打细胞至成为单细胞悬液,1 200 r·min-1离心3 min后弃上清,加入100 μL PBS重悬,加入1 μL Sca-1-FITC抗体,轻轻混匀,室温避光孵育15~30 min,1 200 r·min-1离心3 min后弃上清,用PBS洗涤2次后,加入500 μL PBS重悬,立即上机检测。
1.5 CPCs培养上清中exosome的分离及鉴定Exosome的提取步骤按照SBI公司的试剂盒说明进行,简单操作如下:按量加入提取试剂,4℃放置过夜之后1 500×g离心30 min,除去上清,1 500×g离心5 min以除去残留的液体(注意不要接触到沉淀在底部的exosome),用适量的PBS重悬后,-80℃可长期保存。
利用Western blot对exosome特异性标记物CD63进行鉴定。冰上解冻exosome,加入5×loading buffer,95℃加热5 min使蛋白变性,常规制胶、上样,蛋白电泳,然后转膜、封闭,5% BSA稀释一抗4℃孵育过夜,CD63(1:200) ,TBST洗涤3次,每次10 min,用HRP标记的抗兔二抗(1:2 000)室温孵育1 h,TBST洗涤3次,每次10 min,加入ECL发光液,用自动显影机(GE,美国)曝光。
1.6 Nanosight分析exosome的粒径离心沉淀后的exosome用适量纯水稀释,用1 mL注射器将样品注射至检测槽中,注意不要留气泡,根据NanosightNS300(Malvern,英国)记录的颗粒数多少调整稀释度,以视野中30~40个颗粒为宜,待机器自动读数,记录并生成报告。
1.7 免疫荧光检测心肌细胞对exosome的摄取24孔板用玻片覆盖后,0.1% glatin包被,接种H9c2细胞,待细胞汇合至70%~80%时进行实验,将PKH26与新鲜提取的exosome孵育,exosome的浓度约为2×1012个·L-1。孵育的方法按照Sigma公司说明书进行操作,染色后用ExoQuick对其进行再次提取,将已被荧光染料标记后的exosome加入到细胞中,37℃温箱中孵育12 h后将细胞在荧光显微镜下观察。
1.8 Western blot检测细胞凋亡相关蛋白的表达用过氧化氢溶液构建心肌细胞氧化应激模型,分别用50、100 μmol·L-1的H2O2处理H9c2细胞孵育6 h,分为空白组和CPC来源的exosome(CPC-exo)处理组,exosome加到心肌细胞中培养过夜后,分别用50、100 μmol·L-1的H2O2处理H9c2细胞孵育6h,消化收集细胞;PBS洗两次,加入适量细胞裂解液,冰上裂解30 min,提取细胞总蛋白,BCA进行蛋白浓度的定量测定。Western blot步骤同“2.4”,其中一抗caspase-3(1:1 000),cleaved-caspase-3(1:1 000)、β-actin(1:3 000)。
1.9 统计学处理应用GraphPad Prism 5统计软件分析,数据用x±s表示,两组间均数的比较采用t检验。
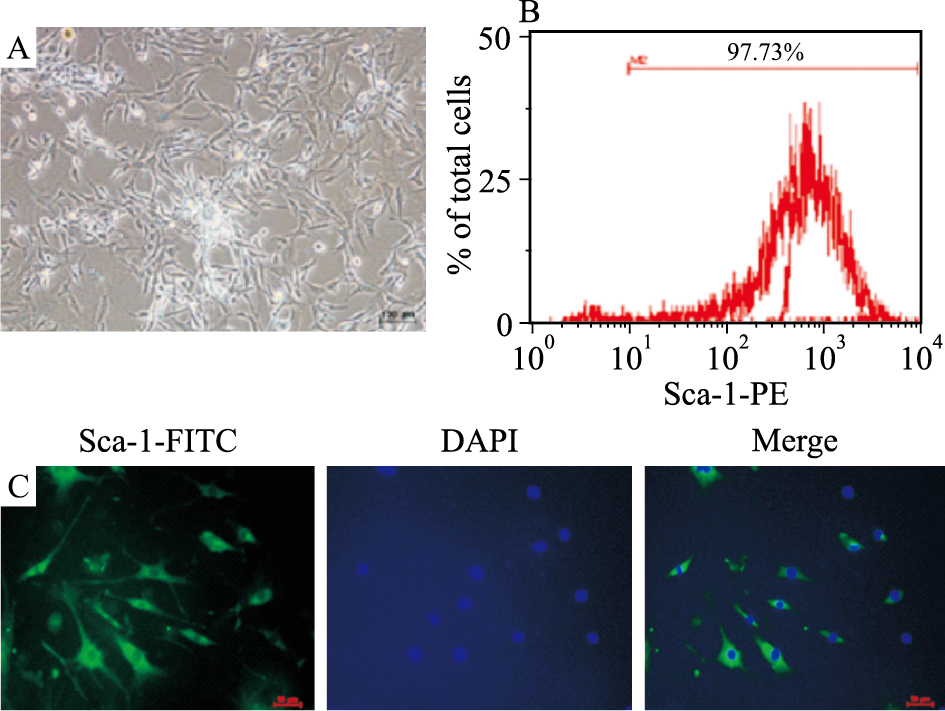
2 结果 2.1 CPCs的分离及表型鉴定磁珠分选Sca-1+CPCs后,4~5 d后可进行第1次传代,形态呈不规则的梭形(Fig1A);用流式细胞术进行纯度分析,结果显示分选之后Sca-1+细胞的比例可达到95%以上(Fig1B);对细胞进行免疫荧光鉴定,结果显示,磁珠分选出的细胞可表达Sca-1蛋白(Fig1C)。
|
| Fig.1 A:The phase morphology of isolated CPCs growing on gelatin-coated dish, scale bar=100 μm. B: Flow Cytometry analyzed purified Sca-1+CPC from the first preparations. Typical purity of isolation is>95%. C: Immunofluorescence detected the expression of Sca-1 protein in the cytoplasma of CPCs, scale bar=50 μm. |
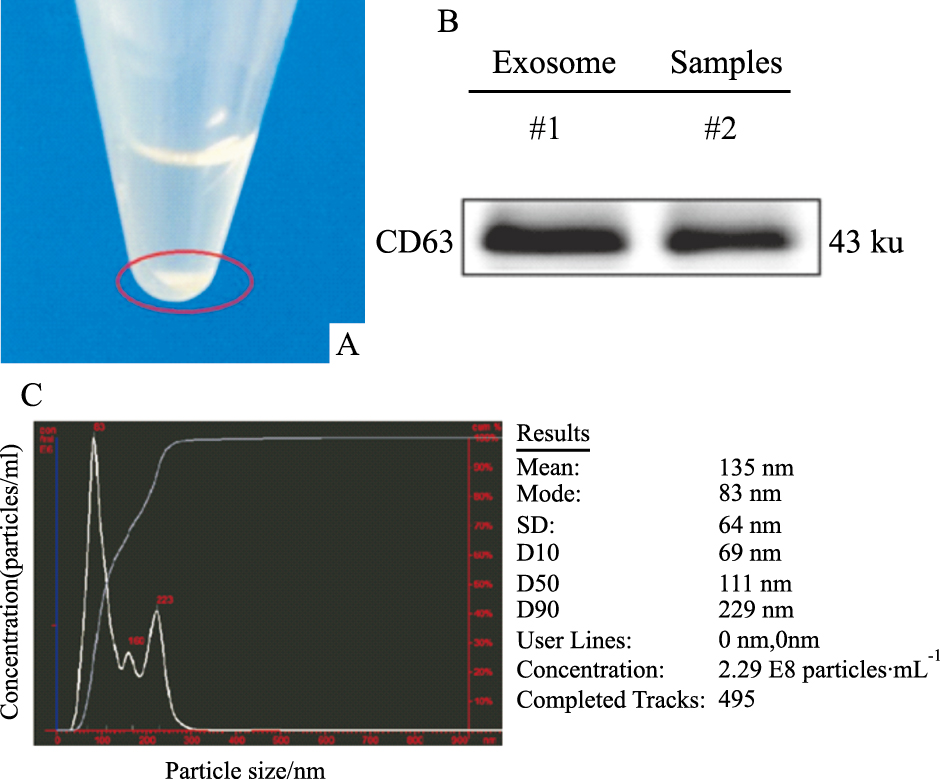
收集CPCs 48 h的培养上清,提取exosome,经过离心后可以明显在离心管管底部看到白色exosome 沉淀(Fig2A)。Western blot结果显示exosome沉淀表达CD63蛋白(Fig2B),CD63是目前用于exosome鉴定的最常用的一个蛋白分子[1]。Nanosight可检测到exosome的粒径分布范围以及浓度,大部分粒子都处于exosome直径的范围(30~100 nm),含量最多的粒子直径约为83 nm,浓度为9.16×1012个·L-1(Fig2C)。
|
| Fig.2 A: The exosome pellets accumulated in the bottom of centrifuge tube after centrifuge. B: Western blot detected the CD63 protein in exosome samples. C: NTA analyzed the diameters and concentration(dilution 1:40) of exosome. |
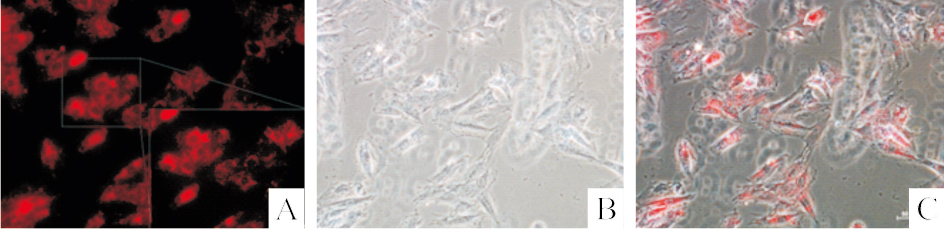
Exosome被PKH26标记后,加入H9c2细胞中培养12 h后,免疫荧光结果显示:H9c2细胞中可见大量红色物质在胞质聚集(Fig3),提示exosome可以被H9c2细胞所摄取。
|
| Fig.3 Confocal analysis of the PKH26 labeled-exosome′ uptake by H9c2 in different groups, A is the PHK26 labeled exosome, B is the phase morphology, C is the merged picture, scale bar=50 μm. |
与正常细胞相比,加入了H2O2处理6 h后的细胞形态明显改变,细胞的体积变小、变形,细胞膜完整但出现发泡现象,部分细胞出现皱缩、变圆并脱落(Fig4A)。但是提前加入exosome处理之后,细胞的凋亡状态在光镜下就可以看到明显改善(Fig4A)。对各组细胞的caspase-3进行检测,Western blot结果显示:各组总的caspase-3水平没有明显差异,而exosome处理可以明显的抑制H2O2导致的激活型cleaved-caspase-3水平增加(Fig4B),提示exosome在H2O2诱导的心肌细胞的凋亡中发挥了保护性作用。

|
| Fig.4 A: shows the morphological difference between control, 50 μmol·L-1 H2O2,exosome+50 μmol·L-1 H2O2 groups, 100 μmol·L-1 H2O2,exosome+100 μmol·L-1 H2O2 groups, scale bar=100 μm.B: Western blot detected the expression of caspase-3 and cleaved caspase-3. *P < 0.05,**P < 0.05 vs non-exosome treated cells. |
干细胞的旁分泌机制是干细胞发挥作用的一个重要途径。Exosome作为囊泡家族中重要的一员,是干细胞旁分泌因子的重要组成部分,它广泛参与干细胞与周围靶细胞的信息交换过程中,进而影响靶细胞的一系列生物学功能。近年来,CPCs对心肌损伤后心肌修复作用的几个重要临床试验已经完成,并且取得了一定成效[2],然而CPCs如何在损伤区域发挥功能以及其相关的机制却没有明确的定论。有研究发现,移植后有的干细胞可以通过直接向心肌细胞或者血管分化的作用发挥改善心功能的作用[3];也有研究证实CPCs发挥修复作用还可以通过旁分泌效应进行[4]。因此探索CPCs分泌的重要旁分泌因子之一的exosome对心肌细胞在病理环境下(如氧化应激等)的修复具有重要意义。
研究发现,将Sca-1+CPCs移植到心梗区域之后小鼠的心功能明显改善,该细胞在5-氮杂胞苷的诱导下可分化成为功能性心肌细胞,但分化效率只有1%[5]。因此,Sca-1+CPCs发挥心肌保护性作用很可能是通过其他更加有效的途径,旁分泌效应就为这一现象进行了合理的解释。在CPCs的旁分泌领域,Sca-1+CPCs分泌的exosome少有报道,这也是我们选择Sca-1+CPCs作为研究对象来探索其作用机制的重要原因。CPCs本身在心脏组织的含量极少,大约占整个心脏细胞的2%[6],那么某一特定表型的细胞含量则更少,常规的方法并不能有效的分离来,本研究我们选用免疫磁珠分选的方法[7],研究结果也证实我们所建立的分选平台可高效、特异性的分选出Sca-1+CPCs。
Exosome的鉴定方法不一,但是表面标记物是鉴定的金标准。目前已明确的表面标记物主要有:CD63、CD9、CD81、TSG101、Alix等[8],而其中最主要且最认可的是CD63,因此我们采用Weatern blot对CPCs分泌的exosome进行鉴定,发现CD63是阳性表达的。尽管CD63表达阳性可以证实我们提取的物质是exosome,但是这却不能反映出exosome作为一个纳米粒子的一些特征。Nanosight运用独特的纳米颗粒跟踪分析(Nanoparticle Tracking Analysis,NTA)技术,可以对10~2 000 nm范围内的纳米颗粒进行快速实时动态检测,测量参数包括颗粒粒径、散色光强、浓度等。因此,我们运用纳米粒子示踪技术,用Nanosight检测提取物质的直径和浓度,结果证实提取物的直径峰值符合exosome的直径范围,进一步提示我们提取的的确是exosome。说明我们建立的分选方案可以有效提取出CPCs分泌的exosome。
心肌细胞的氧化应激与活性氧族(ROS)的产生密切相关[9],而超氧阴粒子(O2-)、过氧化氢(H2O2)、一氧化氮(NO)等都属于ROS。在正常情况下,ROS的产生和清除存在着一个平衡,当心血管系统发生病变,心肌细胞不能发挥正常的功能,造成活性氧清除受阻,从而活性氧蓄积,导致氧化应激的发生,引起细胞DNA损伤、蛋白质变性、细胞凋亡等,最终发生细胞死亡,加快疾病的进程[10]。因此本研究在体外用H2O2使心肌细胞处于氧化应激的环境,发现心肌细胞出现有激活型caspase-3的高表达,总的caspase-3水平没有明显改变,活化的caspase-3的产生是细胞发生凋亡的一个重要标志。然而在进行氧化应激诱导前用CPCs分泌的exosome处理后,心肌细胞的凋亡得以缓解,提示CPCs来源的exosome对于心肌细胞确实具有一定的调控作用,这一结果发现不仅为CPCs的旁分泌作用提供了依据,而且对更深层次地探索exosome参与其中的作用机制提供了研究基础。
本研究对exosome的整体功能进行了初步的研究,有关exosome的作用机制需要后续进行更加深入的探索。但是我们不难推测,exosome要发挥功能与其内容物(蛋白质、mRNA、非编码RNA等)的传递作用密切相关[11, 12],其中包含的非编码RNAs更是近年来关注的前沿热点。在肿瘤领域,许多报道已证实exo-miRNAs作为分子标记物,在监测疾病转移和预测预后中扮演重要角色[13];在心血管领域,exosome中包含的miRNA-22或miR-34a等对心肌缺血/再灌注损伤也具有保护性性作用[1, 14]。最新研究表明长链非编码RNA(lncRNAs)和环状RNA(circRNAs)等所谓的“垃圾序列”在基因转录后调控也同样起着至关重要的作用[13],它们可作为miRNAs的Sponge共同调控靶基因的启动子区,进而影响基因的转录过程[15]。随着研究的不断深入,exosome内容物及其功能、作用机制也将随之阐明,因此,我们相信exosome将会为临床多种疾病的诊断、治疗以及疗效评估等做出重要的贡献。
(致谢:本实验主要是在广东省人民医院的医学研究部实验室完成的,感谢导师和实验室的老师对本人实验的帮助和指导。)
| [1] | Feng Y, Huang W, Meng W,et al.Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer:a critical role for HSF1/miR-34a/HSP70 pathway[J].Stem Cells, 2014, 32(2):462-72. |
| [2] | Malliaras K, Makkar R R, Smith R R,et al.Intracoronary cardiosphere-derived cells after myocardial infarction:evidence of therapeutic regeneration in the final 1-year results of the CADUCEUS trial (CArdiosphere-Derived aUtologous stem CElls to reverse ventricUlar dySfunction)[J].Jam Coll Cardiol,2014,63(2):110-22. |
| [3] | Smits A M, van Laake L W, den Ouden K,et al.Human cardiomyocyte progenitor cell transplantation preserves long-term function of the infarcted mouse myocardium[J].Cardiovasc Res, 2009, 83(3):527-35. |
| [4] | Barile L, Lionetti V, Cervio E,et al.Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction[J].Cardiovasc Res, 2014,103(4):530-41. |
| [5] | Chong J J, Forte E, Harvey R P.Developmental origins and lineage descendants of endogenous adult cardiac progenitor cells[J].Stem Cell Res, 2014, 13(3 Pt B):592-614. |
| [6] | Oh H, Bradfute S B, Gallardo T D,et al.Cardiac progenitor cells from adult myocardium:homing, differentiation, and fusion after infarction[J].Proc Natl Acad Sci USA, 2003, 100(21):12313-8. |
| [7] | Wang H, Chen H, Feng B,et al.Isolation and characterization of a Sca-1+/CD31- progenitor cell lineage derived from mouse heart tissue[J].Bmc Biotechnol, 2014, 14:75. |
| [8] | Taylor D D, Shah S.Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes[J].Methods, 2015,Mar 10. |
| [9] | Tsutsui H, Kinugawa S, Matsushima S.Oxidative stress and heart failure[J].Am J Physiol Heart Circ Physiol, 2011, 301(6):H2181-90. |
| [10] | Vaziri N D, Wang X Q, Oveisi F,et al.Induction of oxidative stress by glutathione depletion causes severe hypertension in normal rats[J].Hypertension, 2000, 36(1):142-6. |
| [11] | Ong S G, Lee W H, Huang M,et al.Cross talk of combined gene and cell therapy in ischemic heart disease:role of exosomal microRNA transfer[J].Circulation, 2014, 130(11 Suppl 1):S60-9. |
| [12] | 黄邵洪, 覃 杰, 李 昀,等.含表皮生长因子受体的外泌体诱导肿瘤特异性调节T细胞[J].中国药理学通报, 2014,30(8):1090-4. Huang S H, Qin J, Li H,et al. Epidermal growth factor receptor-containing exosomes induce tumor-specific regulatory T cells[J].Chin Pharmacol Bull,2014,30(8):1090-4. |
| [13] | Li Q, Shao Y, Zhang X,et al.Plasma long noncoding RNA protected by exosomes as a potential stable biomarker for gastric cancer[J].Tumour Biol, 2015, 36(3):2007-12. |
| [14] | Feng Y, Huang W, Wani M,et al.Ischemic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J].Plos One, 2014, 9(2):e88685. |
| [15] | Deng L, Yang S B, Xu F F,et al.Long noncoding RNA CCAT1 promotes hepatocellular carcinoma progression by functioning as let-7 sponge[J].J Exp Clin Cancer Res, 2015, 34:18. |