


2. 南京中医药大学中药学一级学科, 江苏 南京 210023;
3. 江苏省中药药效与安全性评价重点实验室, 江苏 南京 210023
 , ZHAO Shi-feng1, 2, XU Wen-xuan1, 2, ZHANG Feng1, 2, 3, WU Li1, 2, 3, LU Yin1, 2, 3, ZHENG Shi-zhong1, 2, 3
, ZHAO Shi-feng1, 2, XU Wen-xuan1, 2, ZHANG Feng1, 2, 3, WU Li1, 2, 3, LU Yin1, 2, 3, ZHENG Shi-zhong1, 2, 3

2. National First-Class Key Discipline for Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. Jiangsu Key Laboratory for Pharmacology and Safety Evaluation of Chinese Medica, Nanjing 210023, China
肝纤维化的发生与发展是一个复杂的病理和细胞生化过程[1, 2, 3, 4, 5]。这一过程受到多种细胞因子及细胞内多种信号转导通路网络的调控[1, 2, 3, 4, 5, 6, 7, 8]。近年来,随着许多新技术与新方法在肝纤维化领域的不断运用,在这个复杂的调控网络中涌现出许多新的成员[5, 6, 7, 8, 9, 10, 11],深入挖掘这些潜在靶点的药理学特性及作用机制将对阐明肝纤维化发生机制及后续的基于靶点的药物设计发挥重要作用。近年来临床与基础研究均表明细胞因子信号转导抑制分子-3 (suppressor of cytokine signaling,SOCS-3)在肝纤维化的发生发展中扮演重要角色,被认为是抗肝纤维化的潜在治疗靶点[12, 13, 14, 15]。SOCS-3可被多种细胞因子诱导产生,反过来又可对相应的信号转导途径进行负性调节,形成细胞因子信号转导负反馈调节的环形回路,从而让机体处于动态平衡[16]。现已证实,SOCS-3可调控与肝纤维化有密切关系的JAK/STAT信号通路、TGF-β1/Smad信号通路、胰岛素信号通路、瘦素信号通路的转导,进而在肝纤维化的形成发展中起到重要的调节作用[17, 18]。本文将就近几年来这方面的研究进展,论述SOCS-3在防治肝纤维化中的作用。
1 SOCS-3 概述SOCS-3属于SOCS 蛋白家族的成员。目前已发现SOCS 蛋白共有8种,分别为SOCS-1~SOCS-7和CIS。1997年科学家[19]首次克隆了人的SOCS-3基因,位于17q 25.3染色体上,由675个连续核苷酸构成,只有一个外显子,不含内含子,编码的蛋白质(SOCS-3蛋白)分子质量为24.7 ku,由225个氨基酸组成[19]。SOCS-3蛋白结构与SOCS家族其他成员相似,由N区(位于氨基端)、SH2区(位于中央)和SOCS盒区(位于羧基端)3个部分组成[20, 21]。N 区中含有两个非常重要的结构,分别为激酶抑制区(kinase inhibitory region,KIR)[22]和前SH2位点[23]。KIR 作为JAK激酶的假底物,可以抑制JAK激酶的活性,在此过程中,KIR 的4个残基(F56、F59、D64、Y65)发挥着关键作用[23, 24]。前SH2位点可以协同SH2位点与特定的细胞因子受体结合,进而导致SOCS-3蛋白激活相应的受体,调节细胞因子信号转导[23, 25]。有报道[26]称前SH2位点的两个残基(I68 和L75)可以与JAK激酶的pY1007相互作用,因而在该信号调节过程中发挥着重要的作用。中央SH2区含有SH2结构域,能与其他信号蛋白的磷酸化酪氨酸残基结合,抑制细胞信号转导的级联反应[27]。SOCS盒是SOCS-3蛋白羧基端的保守序列,由近40个氨基酸组成,同源性极强[28]。SOCS盒的3个α-单环结构可与泛素蛋白活化酶E1和泛素蛋白缀合酶E2一起组成复合物,该复合物与泛素连接酶E3相互作用,发挥抑制SOCS-3蛋白的降解,调节细胞内SOCS-3蛋白水平的功能[28]。有研究[29]证实,敲除SOCS-3盒会阻断SOCS-3的作用(Fig1)。
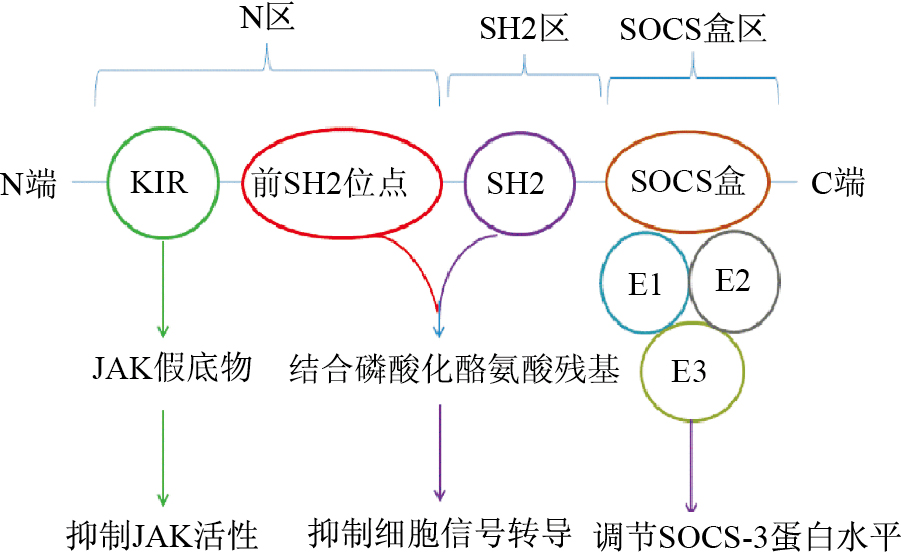
|
| Fig.1 Schematic structure of SOCS-3 |
SOCS-3蛋白广泛分布于肝脏、胸腺、脑、胰腺、肾脏、肺、胎盘等组织器官中,参与脂肪和肌肉组织中多种细胞因子的负调控,生理功能十分广泛[30]。在正常情况下,SOCS-3的表达水平非常低,但当有大量细胞因子、激素以及生长因子存在时,SOCS-3会被迅速诱导表达,且这种诱导表达具有细胞和组织特异性,过度表达的SOCS-3蛋白又特异性地抑制细胞因子介导的信号通路,对信号转导起到负反馈抑制作用,进而形成一个负反馈调节的通路[30]。SOCS-3与肝纤维化、动脉硬化、肥胖、糖代谢、胰岛素抵抗、瘦素抵抗、肿瘤、哮喘、风湿性疾病等关系密切,有可能成为这类疾病的治疗性靶标[30]。
2 SOCS-3与肝纤维化肝纤维化是各种形式慢性肝损伤之后继发的组织修复反应,其发病实质是HSC异常活化增殖,并合成与分泌大量细胞外基质(extracellular matrix,ECM),致使肝内ECM合成大于降解,最终导致ECM过度沉积[1, 2, 3, 4, 5, 6, 7, 8]。如无有效的治疗措施,随着病情的发展将导致肝脏纤维结节形成,并破坏正常的肝脏结构与功能,最终发展成为肝硬化而出现肝脏功能的衰退,甚至演变为肝癌[5, 6, 7, 8, 9, 10, 11, 12]。近年来,SOCS-3在肝纤维化发生发展中的作用引起了大量学者的关注,逐渐成为肝病领域研究的热点。肝脏处在正常生理条件,或是慢性肝损伤状态,亦或是肝纤维化早期以及肝纤维化发展期,SOCS-3的表达量以及活性都各不相同,这提示SOCS-3在肝脏疾病演变过程中扮演不同角色。本文接下来将对其重点阐述。
2.1 SOCS-3在肝纤维化演变过程中的作用当肝脏处于正常生理条件下,SOCS-3基因与蛋白表达量都很低,但是却维持一定的生理水平,这主要因为各种诱导因子大都处于动态平衡,无法诱导SOCS-3的过度表达,而且机体此时无需启动SOCS-3过表达的负反馈调节机制,也可维持正常的生理功能。低水平的SOCS-3可以提高肝脏抵抗病毒、各种致炎因子及趋化因子的能力,参与肝脏整体动态平衡的维护。但是,此时如果人为诱导SOCS-3的过度表达,反而会破坏机体的动态平衡,影响肝脏正常功能的发挥。Li等[31]分析正常人肝脏组织样本时发现,SOCS-3 mRNA的表达水平非常低,SOCS-3蛋白的表达量与之相应。Koeberlein等[32]检测正常大鼠肝脏组织SOCS-3的表达水平时同样发现,其基因与蛋白都保持很低的表达水平,但是使用转染技术过表达SOCS-3,血清ALT、AST水平反而升高,提示肝脏受到损伤。体外研究方面,Pasricha等[33]发现正常小鼠原代HSC细胞SOCS-3表达量很低,但当培养2代之后,SOCS-3基因与蛋白表达量迅速上升。由此可见,在肝脏功能正常的条件下,SOCS-3的表达水平很低,但是也扮演着不可替代的作用,上调或下调该种状态下SOCS-3的表达量都将引起肝脏功能的受损。
在肝纤维化早期,SOCS-3基因与蛋白表达量明显升高,主要原因在于肝纤维化早期,各种损伤因子(如PDGF、TGF-β、TNF-α、IL-6、PFA、FGF等)合成与降解动态平衡被打破,从而导致大量损伤因子过度积累,并不断诱导SOCS-3的表达。曹彦等[34]发现非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD) 患者肝脏样本IL-6、瘦素、胰岛素、PDGF、TGF-β、TNF-α等明显升高,SOCS-3 mRNA及其蛋白的表达水平随着肝损伤程度增加而逐渐增加。张千等[35]研究大鼠肝纤维化模型时发现,慢性肝损伤组SOCS-3相对表达量高于对照组,差异有统计学意义。潘金等[36]利用沉默技术下调肝纤维化大鼠SOCS-3的表达水平后发现,各种炎症因子(如IL-2、IL-6、IL-12等)表达量进一步升高,ECM含量进一步增加,肝纤维化程度加深。Fan等[37]将含有SOCS-3基因的重组质粒导入体外培养2代的HSC后发现,SOCS-3蛋白表达上升,肝纤维化各种标志物α-SMA、α1(I)procollagen、fibronectin都不同程度的降低。由此可见,在肝纤维化早期阶段,由于各种损伤因子的诱导,SOCS-3基因与蛋白表达水平都很高,在这种状态下,进一步上调SOCS-3的表达将有助于改善肝纤维化,相反下调SOCS-3将进一步促进肝纤维化的进程。
在肝纤维化发展期,SOCS-3基因常发生甲基化并且基因表达量明显降低。Yang等[38]证实肝癌患者SOCS-3蛋白表达的减少不仅发生在肝脏肿瘤区域,也发生在非肿瘤区域,而且这种表达的减少在肝纤维化发展期阶段更加明显,显示缺乏SOCS-3能够促进肝纤维化的发展,SOCS-3表达对肝纤维化起保护作用。王彬等[39]在研究CCl4致大鼠肝纤维化模型时发现,在造模初期肝脏组织中的SOCS-3水平比正常组高出很多,但是在造模后期,SOCS-3水平比正常组更低。da Silva等[40]报道以SOCS-3过表达质粒转染体外培养5代的HSC,可以抑制STAT3的磷酸化和下调cyclinD1和Bcl-x1,从而抑制HSC增殖。由此可见,在肝纤维化发展期甚至肝癌阶段,SOCS-3基因表达量明显降低,利用药理学方法上调SOCS-3的表达能够改善肝纤维化程度。
2.2 SOCS-3调控肝纤维化的分子机制在肝纤维化发展过程中,SOCS-3可通过调控多种信号通路干预肝纤维化进程,因而充分解析SOCS-3调控肝纤维化的分子机制,对后续筛选针对此靶点有效的天然活性成分至关重要。通过大量查阅相关文献,SOCS-3对肝纤维化的影响被归纳为以下几个主要方面,SOCS-3通过调控STAT3介导的TGF-β1信号通路影响肝纤维化进程、SOCS-3通过调控瘦素信号通路干预肝纤维化发生发展、SOCS-3通过调控胰岛素信号通路影响肝纤维化进程,下面本文分别对其进行详细介绍(Fig2)。
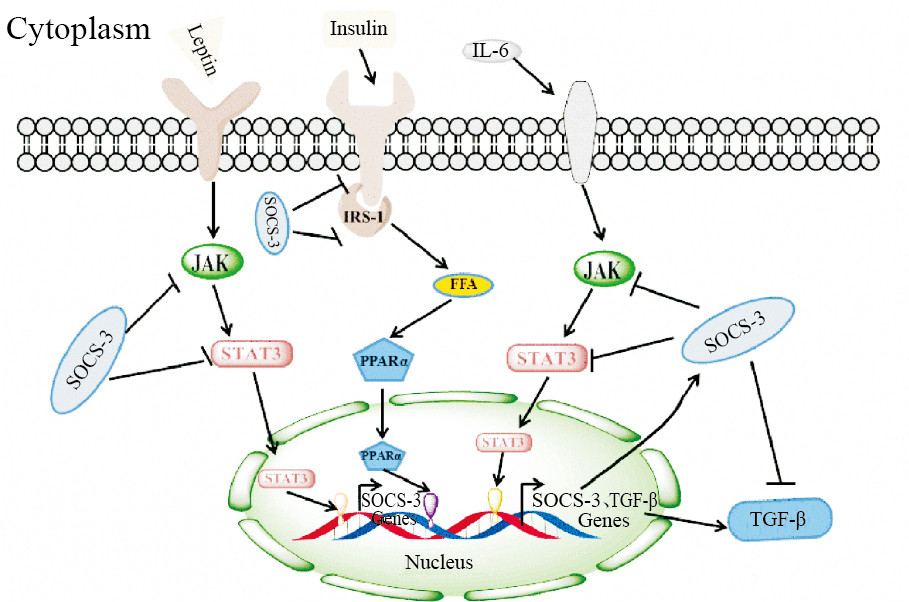
|
| Fig.2 Possible regulatory mechanism of liver fibrosis by SOCS-3 |
近年来,越来越多的临床数据表明,肝癌患者癌组织和非癌组织SOCS-3表达都减少,暗示缺乏SOCS-3能够促进肝纤维化的发展,SOCS-3表达对肝损伤起保护作用,进一步研究其机制,发现可能与抑制STAT3活化,下调TGF-β1表达有关[41]。体内研究方面,Ogata等[42]在研究肝脏特异性SOCS-3基因缺陷型小鼠时发现,SOCS-3基因缺陷会导致STAT3过度活化,对刀豆蛋白A(ConA)表现出高敏感性,促进ConA导致的肝纤维化的发生发展。Yu等[43]也发现肝脏特异性敲除SOCS-3基因后,STAT3活性增强,促进肝纤维化的发生,且与TGF-β1表达呈正相关。STAT3在转录水平直接上调TGF-β1表达,而SOCS-3通过抑制STAT3活化,对TGF-β1产生负反馈抑制,阻止肝纤维化的发展[43]。Ronn等[44]通过对SOCS-3转基因大鼠研究证实,过度表达SOCS-3能够抑制ConA引起的肝脏炎症,并伴随IFN-γ和IL-4表达下降。体外实验方面,Ogata等[42]发现IL-6可上调肝细胞和HSC表达TGF-β1,这种上调能够被高表达的AddnSTAT3和AdSOCS-3抑制,体外实验同样证实STAT3在转录水平直接上调TGF-β1表达,而SOCS-3通过抑制STAT3活化,对TGF-β1产生负反馈抑制,阻止肝纤维化的发展。根据临床研究及体内外实验结果,SOCS-3通过抑制STAT3活化逆转肝纤维化的机制可以总结为以下3种作用方式:(1) SOCS-3可以通过利用位于中央SH2区的SH2结构域,与JAK信号蛋白的磷酸化酪氨酸残基结合,竞争性抑制JAK与底物的结合,从而阻断细胞因子的信号传递。(2) SOCS-3可以通过羧基端的SOCS盒与延伸蛋白BC复合体结合,进而将与SOCS-3结合的JAK和STAT信号蛋白通过泛素化途径降解。(3)由于SH2结构域与转录因子STAT3相似,因此SOCS-3还可以通过竞争性结合细胞因子受体胞质区的磷酸化Tyr位点,抑制STAT3的活化。简而言之,SOCS-3可能通过多种作用机制抑制STAT3的活化,进而阻断其下游TGF-β1信号通路以及一系列炎症反应,最终发挥逆转肝纤维化的功能。
2.2.2 SOCS-3通过调控瘦素信号通路影响肝纤维化进程近年来大量临床及实验研究显示,瘦素与肝纤维化进程存在密切联系。Polyzos等[45]观察到酒精性脂肪肝患者血清瘦素水平与肝纤维化血清学指标呈正相关,提示瘦素与肝纤维化进程密切相关。Piche等[46]观察77例慢性丙肝连续病例与22例健康对照组,同样发现瘦素水平和肝纤维化的严重程度呈正相关。Elinav等[47]也发现瘦素蛋白在小鼠肝纤维化组织中表达水平异常升高,且与肝纤维化标记物α-SMA共表达于汇管区和肝窦壁等胶原纤维沉积处。在肝纤维化中,瘦素与其受体结合后,激活信号转导,通过特定的信号机制促进肝纤维化的发展。
近年来研究发现,瘦素对肝纤维化的影响与SOCS-3存在密切联系[48, 49, 50]。Emilsson等[48]报道,在CCl4致肝纤维化模型中,瘦素水平升高,而SOCS-3表达明显缺失;过表达SOCS-3能够阻断瘦素介导的信号通路,抑制瘦素发挥生物学效应,阻断肝纤维化的进展[48]。Handy等[49]也指出脂联素 (adiponectin,ADPN)可以通过促进SOCS-3与瘦素受体obRb的结合,抑制瘦素信号转导,发挥抗肝纤维化作用。Saxena等[50]进一步指出瘦素诱导HSC的活化与增殖是Akt与 Erk依赖性的,过表达SOCS-3能够抑制Akt与 Erk的磷酸化,进而阻断瘦素信号通路。总结SOCS-3对于瘦素通路的调节机制可以分为两个主要方面:一方面,SOCS-3可通过阻断瘦素受体磷酸化从而阻断瘦素诱导的HSC增殖;另一方面,SOCS-3利用其SH2结构域与瘦素通路中的JAK2结合,抑制其磷酸化,阻止JAK2与底物结合,进而抑制与JAK2相关的瘦素信号的转导。总之,瘦素能够专一地诱导SOCS-3基因的表达,而诱导产生的SOCS-3对瘦素的信号转导发挥负反馈抑制作用,进而阻断肝纤维化的发展。
2.2.3 SOCS-3通过调控胰岛素信号通路影响肝纤维化进程肝脏是能量代谢的重要器官,也是胰岛素作用的主要靶器官[51]。在肝脏中,作为一种多功能的激素类蛋白,胰岛素不仅调节着糖代谢、脂代谢和蛋白质代谢,还可与许多细胞表面特异性受体结合,激活细胞内多种信号转导通路,促进细胞分裂增殖相关基因表达,从而促使细胞生长和增殖[52]。在肝纤维化的发生发展过程中,胰岛素含量相对增高,高胰岛素可以促进游离脂肪酸进入肝脏,大量的游离脂肪酸通过激活过氧化物酶体增殖物激活受体α(PPARα)氧化酶系,增加过氧化物的浓度,导致氧自由基产生增多,诱导炎性介质过度释放,最终使HSC大量活化,导致肝纤维化的发生[53]。
新近研究表明,SOCS-3可能通过调控胰岛素信号通路影响肝纤维化发展进程[54, 55, 56]。胰岛素在HSC细胞系中可以诱导SOCS-3的表达,过表达的SOCS-3蛋白从细胞质转位到细胞内膜与胰岛素受体结合,进而抑制相关因子与胰岛素受体的结合,阻断胰岛素信号通路[54, 55, 56]。SOCS-3调控胰岛素信号通路的具体机制可以归纳为3条主要途径:(1) Emanuelli 等[54]报道胰岛素不仅可以刺激 SOCS-3的表达和转位,同时也可以诱导 SOCS-3 蛋白 204 位酪氨酸的磷酸化,该位点的磷酸化是 SOCS-3 SH2结构域发挥作用所必需的。SOCS-3 蛋白利用其SH2结构域与胰岛素受体Tyr90结合,从而占据胰岛素受体底物(IRS-1)和RS-2的锚定位点,使下游胰岛素信号传导受阻[54]。(2) Niwa等[55]报道过表达的SOCS-3还可与磷酸化的JAK结合,抑制JAK的激酶活性,阻断胰岛素信号通路。(3) Williams等[56]还报道SOCS-3可以通过SOCS盒与延伸蛋白复合物以及E3泛素连接酶结合,引导与SOCS-3结合的IRS通过泛素化降解,进而阻断胰岛素信号通路。总之,在肝纤维化的进程中,胰岛素的紊乱会诱导SOCS-3表达,过表达的SOCS-3蛋白从细胞质转位到细胞内膜与胰岛素受体结合,进而抑制胰岛素及其他因子与胰岛素受体的结合,负反馈阻断胰岛素信号通路,抑制异常胰岛素发挥生物学效应,最终调控肝纤维化进程。
2.3 SOCS-3在防治肝纤维化中的作用SOCS-3在防治肝纤维化中的作用可以被总结为两个主要方面:(1) SOCS-3作为抗肝纤维化的新型靶点,对于后续基于此靶点的药物设计以及筛选新型有效的抗肝纤维化天然产物至关重要。肝纤维化病理机制具有多环节和复杂性的特征,充分研究SOCS-3在肝纤维化各个阶段中的作用及其分子机制,能够更加深入的阐明肝纤维化发生发展机制,而且将SOCS-3与其他的靶点相结合,设计新型的基于多靶点的抗纤维化药物,或是筛选针对多靶点有效的天然活性成分,不仅能够增加抗肝纤维化药物的作用效果,还能够降低耐药性的产生,为抗肝纤维化药物的研究设计提供新的思路。(2) SOCS-3可以作为肝纤维化疾病诊断、预后的生物分子指标。在正常生理状态下,SOCS-3的表达水平非常低,但是当肝脏发生纤维化时,SOCS-3的表达水平会明显升高,因此通过动态监测SOCS-3的表达水平,并结合其他典型指标,不仅有利于及早发现肝纤维化病情,还可以及时掌握肝脏的纤维化程度,结合有效的治疗措施,有望促进肝纤维化的转归。
3 总结综上所述,虽然越来越多的证据表明SOCS-3在肝纤维化的发生发展中具有重要作用,但是人们对于其作用机制的了解还需要相当长的时间。目前关于SOCS-3的研究主要集中于SOCS-3对于JAK/STAT信号通路的调控,对于其他信号通路的调控仍需更加深入的研究,例如SOCS-3与DNA甲基化的关系、SOCS-3与miRNA的相互调控作用、转录因子PPARγ对SOCS-3的调控等。总之,SOCS-3为肝纤维化的治疗带来了新的希望。
| [1] | Friedman S L. Mechanisms of hepatic fibrogenesis[J].Gastroenterology, 2008, 134(6):1655-69. |
| [2] | Ding B S, Cao Z, Lis R, et al. Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis[J]. Nature, 2014, 505(7481):97-102. |
| [3] | Hidvegi T, Ewing M, Hale P, et al. An autophagy-enhancing drug promotes degradation of mutant alpha1-antitrypsin Z and reduces hepatic fibrosis[J]. Science, 2010, 329(5988):229-32. |
| [4] | Krizhanovsky V, Yon M, Dickins R A, et al. Senescence of activated stellate cells limits liver fibrosis[J]. Cell, 2008, 134(4):657-67. |
| [5] | Stiedl P, McMahon R, Blaas L, et al. Growth hormone resistance exacerbates cholestasis-induced murine liver fibrosis[J]. Hepatology, 2015, 61(2):613-26. |
| [6] | Chen L, Li J, Zhang J, et al. S100A4 promotes liver fibrosis via activation of hepatic stellate cells[J]. J Hepatol, 2015, 62(1):156-64. |
| [7] | Zhang Z L,Zhang F,Lu Y,et al. Update on implications and mechanisms of angiogenesis in liver fibrosis[J]. Hepatol Res, 2015, 45(2):162-78. |
| [8] | Zhang Z L,Guo Y,Zhang S,et al. Curcumin modulates cannabinoid receptors in liver fibrosis in vivo and inhibits extracellular matrix expression in hepatic stellate cells by suppressing cannabinoid receptor type-1 in vitro[J]. Eur J Pharmacol,2013, 721(1-3):133-40. |
| [9] | 张自力, 张 涉, 郭 瑶,等. 大麻素受体在肝纤维化中的作用及姜黄素干预效应[J]. 中国药理学通报, 2013, 29 (7):626-31. Zhang Z L,Zhang S, Guo Y,et al. Research on the role of cannabinoid receptors in hepatic stellate cell activation and interfering effects of Curcumin[J]. Chin Pharmacol Bull, 2013, 29 (7):626-31. |
| [10] | 张自力, 张 衍, 张 涉, 等. 大麻素受体在肝纤维化及肝硬化中的作用及研究进展[J]. 中国药理学通报, 2014, 30(3):306-9. Zhang Z L,Zhang Y, Zhang S,et al. Research progress on role of cannabinoid receptors in hepatic fibrosis and liver cirrhosis[J]. Chin Pharmacol Bull, 2014, 30(3):306-9. |
| [11] | 薛博瑜, 顾学兰. 肝纤维化的病机认识和辨证论治[J]. 南京中医药大学学报, 2001, 17(2):76-8. Xue B Y, Gu X L. Pathogenesis and differential diagnosis and treatment of liver fibrosis[J]. J Nanjing TCM Univ, 2001, 17(2):76-8. |
| [12] | Handy J A, Saxena N K, Fu P, et al. Adiponectin activation of AMPK disrupts leptin-mediated hepatic fibrosis via suppressors of cytokine signaling (SOCS-3)[J]. J Cell Biochem, 2010, 110(5):1195-207. |
| [13] | Pascarella S, Clément S, Dill M T, et al. Intrahepatic mRNA levels of SOCS1 and SOCS3 are associated with cirrhosis but do not predict virological response to therapy in chronic hepatitis C[J]. Liver Int, 2013, 33(1):94-103. |
| [14] | Luedde T, Wuestefeld T, Trautwein C. A new player in the team:SOCS-3 socks it to cytokine signaling in the regenerating liver[J]. Hepatology, 2001, 34(6):1254-6. |
| [15] | Culig Z. Suppressors of cytokine signalling-3 and -1 in human carcinogenesis[J]. Front Biosci(Schol Ed), 2013, 5(1):277-83. |
| [16] | Wójcik K, Jab onowska E, Omulecka A, et al. Insulin resistance, adipokine profile and hepatic expression of SOCS-3 gene in chronic hepatitis C[J]. World J Gastroenterol, 2014, 20(30):10449-56. |
| [17] | Al-Jamal H A, Jusoh S A, Yong A C, et al. Silencing of suppressor of cytokine signaling-3 due to methylation results in phosphorylation of STAT3 in imatinib resistant BCR-ABL positive chronic myeloid leukemia cells[J]. Asian Pac J Cancer Prev, 2014, 15(11):4555-61. |
| [18] | Kong X, Feng D, Wang H, et al. Interleukin-22 induces hepatic stellate cell senescence and restricts liver fibrosis in mice[J]. Hepatology, 2012, 56(3):1150-9. |
| [19] | Starr R, Willson T A, Viney E M, et al. A family of cytokine-inducible inhibitors of signaling[J]. Nature, 1997, 387(6636):917-21. |
| [20] | Williams J J, Palmer T M. Unbiased identification of substrates for the Epac1-inducible E3 ubiquitin ligase component SOCS-3[J]. Biochem Soc Trans, 2012, 40(1):215-8. |
| [21] | 许文频, 李卫东. SOCS3分子——治疗人类多种疾病的潜在靶标[J]. 药学学报, 2011, 46 (7):747-52. Xu W P, Li W D. SOCS3:a potential therapeutic target for many human diseases[J]. Acta Pharm Sin, 2011, 46 (7):747-52. |
| [22] | Jager L D, Dabelic R, Waiboci L W, et al. The kinase inhibitory region of SOCS-1 is sufficient to inhibit T-helper 17 and other immune functions in experimental allergic encephalomyelitis[J]. J Neuroimmunol, 2011, 232(1-2):108-18. |
| [23] | Walker D G, Whetzel A M, Lue L F, et al. Expression of suppressor of cytokine signaling genes in human elderly and Alzheimer's disease brains and human microglia[J]. Neuroscience, 2014, 452(14):803-6. |
| [24] | Zafra M P, Canas J A, Mazzeo C, et al. SOCS3 silencing attenuates eosinophil functions in asthma patients[J]. Int J Mol Sci, 2015, 16(3):5434-51. |
| [25] | Suessmuth Y, Elliott J, Percy M J, et al. A new polycythaemia vera-associated SOCS3 SH2 mutant (SOCS3F136L) cannot regulate erythropoietin responses[J]. Br J Haematol, 2009, 147(4):450-8. |
| [26] | 薛 帆,崔雪薇,张春东. 细胞因子信号传导抑制蛋白-3(SOCS-3)作用的研究进展[J]. 中国当代医药,2011,18(4):18-9. Xue F, Cui X W, Zhang C D. The research progress of suppressor of cytokine signaling protein-3 (SOCS-3)[J]. China Mod Med, 2011, 18(4):18-9. |
| [27] | Babon J J, McManus E J, Yao S, et al. The structure of SOCS3 reveals the basis of the extended SH2 domain function and identifies an unstructured insertion that regulates stability[J]. Mol Cell, 2006, 22(2):205-16. |
| [28] | Boyle K, Zhang J G, Nicholson S E, et al. Deletion of the SOCS box of suppressor of cytokine signaling 3 (SOCS3) in embryonic stem cells reveals SOCS box-dependent regulation of JAK but not STAT phosphorylation[J]. Cell Signal, 2009, 21(3):394-404. |
| [29] | Babon J J, Sabo J K, Soetopo A, et al. The SOCS box domain of SOCS3:structure and interaction with the elonginBC-cullin5 ubiquitin ligase[J]. J Mol Biol, 2008, 381(4):928-40. |
| [30] | Yao X G, Meng J, Zhou L, et al. Relationship between polymorphism of SOCS-3 and dyslipidemia in China Xinjiang Uygur[J]. Genet Mol Res, 2015, 14(1):1338-46. |
| [31] | Li Y, Han M F, Li W N, et al. SOCS3 expression correlates with severity of inflammation in mouse hepatitis virus strain 3-induced acute liver failure and HBV-ACLF[J]. J Huazhong Univ Sci Technolog Med Sci, 2014, 34(3):348-53. |
| [32] | Koeberlein B, zur Hausen A, Bektas N, et al. Hepatitis B virus overexpresses suppressor of cytokine signaling-3 (SOCS3) thereby contributing to severity of inflammation in the liver[J]. Virus Res, 2010, 148(1-2):51-9. |
| [33] | Pasricha S, Kenney-Hunt J, Anderson K, et al. Identification of eQTLs for hepatic Xbp1s and socs3 gene expression in mice fed a high-fat, high-caloric diet[J]. G3 (Bethesda), 2015, 5(4):487-96. |
| [34] | 曹 彦. 非酒精性脂肪肝病大鼠肝脏SOCS-3的表达和罗格列酮干预研究[C].中南大学, 2007. Cao Y. SOCS-3 expression in the liver of NAFLDR at model and the intervention study of Rosiglitazone[C]. Central South University, 2007. |
| [35] | 张 千,邓存良. SOCS-3在大鼠慢性肝损伤中的表达研究[J]. 四川医学,2014,35(9):1126-8. Zhang Q, Deng C L. The expression of SOCS-3 in hepatic tissue of rat with chronic liver injury[J]. Sichuan Med J, 2014, 35(9):1126-8. |
| [36] | 潘 金. SOCS-3在实验性肝纤维化大鼠中的表达及阴行草的干预作用研究[C]. 昆明医科大学, 2014. Pan J. SOCS-3 expression in experimental hepatic fibrosis in rats and the intervention study of siphonostegia chinensis[C]. Kunming Medical University, 2014. |
| [37] | Fan Y, Fang X, Tajima A, et al. Evolution of hepatic steatosis to fibrosis and adenoma formation in liver-specific growth hormone receptor knockout mice[J]. Front Endocrinol (Lausanne), 2014, 5(1):218. |
| [38] | Yang S F, Yeh Y T, Wang S N, et al. SOCS-3 is associated with vascular invasion and overall survival in hepatocellular carcinoma[J]. Pathology, 2008, 40(6):558-63. |
| [39] | 王 彬, 张晓华, 杨妙芳, 等. SOCS3在重症急性胰腺炎合并肝损伤大鼠肝组织中的表达及意义[J]. 解放军医学杂志, 2012, 37(11):1036-9. Wang B, Zhang X H, Yang M F, et al. Expression and significance of SOCS3 in liver tissue of rats with severe acute pancreatitis complicated by liver injury[J]. The People's Liberat Army Med J, 2012, 37(11):1036-9. |
| [40] | da Silva CG, Studer P, Skroch M, et al. A20 promotes liver regeneration by decreasing SOCS3 expression to enhance IL-6/STAT3 proliferative signals[J]. Hepatology, 2013, 57(5):2014-25. |
| [41] | Nakaya M, Hashimoto M, Nakagawa R, et al. SOCS3 in T and NKT cells negatively regulates cytokine production and ameliorates ConA-induced hepatitis[J]. J Immunol, 2009, 183(11):7047-53. |
| [42] | Ogata H, Chinen T, Yoshida T, et al. Loss of SOCS3 in the liver promotes fibrosis by enhancing STAT3-mediated TGF-beta1 production[J]. Oncogene, 2006, 25(17):2520-30. |
| [43] | Yu J H, Kim K H, Kim H. SOCS 3 and PPAR-gamma ligands inhibit the expression of IL-6 and TGF-beta1 by regulating JAK2/STAT3 signaling in pancreas[J].Int J Biochem Cell Biol, 2008, 40(4):677-88. |
| [44] | Ronn S G, Borjesson A, Bruun C, et al. Suppressor of cytokine signalling-3 expression inhibits cytokine-mediated destruction of primary mouse and rat pancreatic islets and delays allograft rejection[J]. Diabetologia, 2008, 51(10):1873-82. |
| [45] | Polyzos S A, Kountouras J, Mantzoros C S. Leptin in nonalcoholic fatty liver disease:a narrative review[J]. Metabolism, 2015, 64(1):60-78. |
| [46] | Piche T, Vandenbos F, Abakar-Mahamat A, et al. The severity of liver fibrosis is associated with high leptin levels in chronic hepatitis C[J].J Viral Hepat, 2004, 11(1):91-6. |
| [47] | Elinav E, Ali M, Bruck R, et al. Competitive inhibition of leptin signaling results in amelioration of liver fibrosis through modulation of stellate cell function[J]. Hepatology, 2009, 49(1):278-86. |
| [48] | Emilsson V, Arch J R, de Groot R P, et al. Leptin treatment increases suppressors of cytokine signaling in central and peripheral tissues[J]. FEBS Lett, 1999, 455(1-2):170-4. |
| [49] | Handy J A, Saxena N K, Fu P, et al. Adiponectin activation of AMPK disrupts leptin-mediated hepatic fibrosis via suppressors of cytokine signaling (SOCS-3)[J]. J Cell Biochem, 2010, 110(5):1195-207. |
| [50] | Saxena N K, Titus M A, Ding X, et al. Leptin as a novel profibrogenic cytokine in hepatic stellate cells:mitogenesis and inhibition of apoptosis mediated by extracellular regulated kinase (Erk) and Akt phosphorylation[J]. FASEB J, 2004, 18(13):1612-4. |
| [51] | Asrih M, Jornayvaz F R. Metabolic syndrome and nonalcoholic fatty liver disease:Is insulin resistance the link[J]. Mol Cell Endocrinal, 2015.[Epub ahead of print] |
| [52] | Birkenfeld A L, Shulman G I. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes[J]. Hepatology, 2014, 59(2):713-23. |
| [53] | Sydor S, Canbay A, Bechmann L P. Identifying soluble mediators of nuclear receptor and insulin signaling may enhance noninvasive diagnosis of fibrosis in Fatty liver disease[J]. Digestion, 2014, 90(1):33-4. |
| [54] | Emanuelli B, Peraldi P, Filloux C, et al. SOCS-3 inhibits insulin signaling and is up-regulated in response to tumor necrosis factor-alpha in the adipose tissue of obese mice[J]. J Biol Chem, 2001, 276(51):47944-9. |
| [55] | Niwa Y, Kanda H, Shikauchi Y, et al. Methylation silencing of SOCS-3 promotes cell growth and migration by enhancing JAK/STAT and FAK signaling in human hepatocellular carcinoma[J]. Oncogene, 2005, 24(42):6406-17. |
| [56] | Williams J J,Palmer T M. Unbiased identification of substrates for the Epac1-inducible E3 ubiquitin ligase component SOCS-3[J]. Biochem Soc Trans, 2012, 40(1):215-8. |