


右美托咪定(dexmedetomidine,DEX) 是外消旋混合物美托咪定的右旋异构体。20世纪80年代,Segal等[1]在研究α2-肾上腺素受体的激活是否能改变吸入麻醉药的需要量时得出这样一个观察结论:α2-肾上腺素受体激动剂DEX本身是一种麻醉药,具有镇静催眠作用。他们申请了相关专利,随即展开一系列研究,并将相关研究结果应用于人体,由此导致DEX作为一种镇静剂问世。随后在1990年由Orion Pharma公司 (芬兰)和Abott Labs公司(美国雅培公司)共同开发研制。1999年,美国政府批准DEX作为短期镇静剂( < 24 h)在重症监护室应用。
1 DEX的作用部位DEX是通过激活中枢α2-肾上腺素受体而产生镇静作用[2],其α2与α1受体亲合力之比为1620:1,这使得DEX具有更强的镇静镇痛作用。α2-肾上腺素受体(以下简称α2受体)是G蛋白偶联受体家族成员之一,经7次跨膜而成,广泛分布于外周神经系统、中枢神经系统和自主神经节中,在脑桥核、脑桥被盖网状核、蓝斑核(lcuos cruleus,Lc)、海马旁回、扣带回等处密度最高。其中,延髓和蓝斑核是α2受体激动剂的重要中枢结合位点,分别与低血压、心动过缓作用及镇静催眠作用有关。
α2受体可分为α2A、α2B以及α2C 3个亚型[3],不同的亚型有着不同的功能。α2A受体被认为是主要的突触前抑制反馈受体,控制着肾上腺素能神经元的胞吐作用。因此,编码α2A受体的基因缺失可导致血压升高、心率增快、易发展成心肌肥大和心功能衰竭。此外,α2A受体还是α2受体激动剂发挥镇静、镇痛、癫痫调控及血小板聚集作用所必须的。α2B受体主要分布在外周血管平滑肌,激活后可致短暂的高血压反应;脊髓中的α2B受体是下行性去甲肾上腺素能神经元调节NO镇痛作用的基本组件。α2C受体主要分布于海马、基底节、嗅球系统及大脑皮质,参与调节多种复杂记忆及行为功能。DEX高选择性激活α2A受体,作用于蓝斑核可发挥镇静催眠效应[4],作用于脊髓可产生镇痛作用[5],同时作用于外周及中枢可共同发挥抑制交感神经兴奋效应。
α2受体的3种亚型均与G蛋白依赖的信号传导系统相偶联,其可能的效应机制如Fig1[6]。α2受体激动剂与α2受体蛋白结合后,由于受体蛋白的构象发生改变,从而与G蛋白相偶联,并通过以下的效应器发挥作用:① 通过G0蛋白调节磷脂酶C(Pc);②通过抑制性Gi蛋白抑制腺苷酸环化酶(Ac);③ 通过G0蛋白抑制Ca2+的转运;④ 通过抑制性Gi蛋白使外向性K+通道开放,引起超极化;⑤ 通过一个未知的G蛋白(G?)调节H+与Na+的交换。
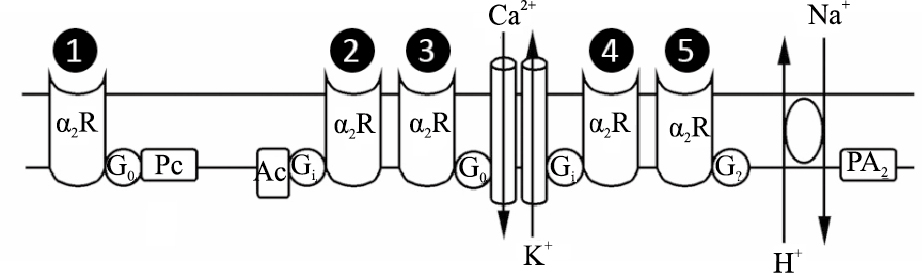
|
| Fig.1 Possible effector mechanisms coupled to α2-adrenoceptors The α2-adrenoceptor: ① Modulates phospholipase C (Pc) via G0 protein. ② Inhibits adenylyl cyclase (Ac) through the inhibitory Gi protein. ③ Inhibits Ca2+ translocation via G0 protein. ④ Causes outward opening of K+ channel via Gi protein, which results in hyperpolarisation. ⑤ Is coupled to an exchange of H+ and Na+ ions via an undetermined G protein(G?). |
术后认知功能障碍(post-operative cognitive dysfunction,POCD)是指患者在麻醉手术后出现的记忆力、定向力及抽象思维等发生障碍,并伴有社会活动能力的减退,即人格、认知能力及社交能力的改变。POCD通常发生在术后1~3 d ,患者表现为意识障碍、思维进行性破坏、语言零乱无逻辑性、判断力差,70%的患者可出现错觉和幻觉。多数为可逆性损害,一般在术后6个月内能逐渐恢复。
与POCD相关的因素很多,包括手术因素、麻醉因素和患者因素(如年龄、基础疾病、遗传因素)等,而老龄则是唯一明确的危险因素。有研究报道,年龄≥65岁的老年患者,POCD的发生率是年轻患者的2~10倍,这可能与老年患者中枢神经系统功能的减退及血流动力学调控能力的下降有关。另外,创伤、营养缺乏、焦虑或抑郁、术后感染、2次手术、呼吸道并发症则是早期POCD的危险因素。
近年来,不管是基础实验还是临床研究均表明,DEX可以明显改善麻醉手术后认知功能障碍的发生。DEX的神经保护功能在多种动物模型上均有报道[7, 8]。基础研究[9]发现,DEX可以改善老年大鼠POCD的行为学表现。临床研究[10]证实,DEX能改善腹腔镜手术患者术后认知功能。一项对预防术后谵妄策略进行系统回顾和荟萃分析的结果[11]显示,使用DEX镇静手段、多元化介入策略、抗精神病药物干预对预防术后谵妄有效。大脑是对缺血缺氧最为敏感的器官之一,目前认为POCD的发生与脑氧代谢异常有关。而DEX可以改善脑缺血/再灌注损伤大鼠局部脑区的氧供需平衡,并且减小脑梗死面积[12]。有研究[13]表明,DEX有助于稳定患者围术期血流动力学水平、提高脑氧摄取率、减轻麻醉和手术对神经系统的损伤,这更进一步证实了DEX的神经保护作用。
虽然大部分的研究都证实了DEX具有神经保护作用,但Brede等[14]的研究则发现,α2受体并不能对局灶性脑缺血表现出神经保护功能。既往研究表明,Tau蛋白与认知功能障碍相关,其过磷酸化可促进神经原纤维变性和神经元死亡;而最新研究表明,DEX可以直接增加Tau蛋白的磷酸化[15]。因此,只有对DEX的神经保护功能的机制有更深一步的了解,才能解释这些现象。
3 DEX神经保护作用的相关机制尽管许多药物和方法在动物身上证明是有神经保护功能的,但目前还没有一种能在人类被证实是同样有效的,这可能是由于局部或大脑缺血导致的损伤是通过多种机制引起所致。因此,神经保护的机制也应该是多样的。
DEX作为一种新型的麻醉辅助用药在临床上得到广泛应用,大量体内外研究表明,其可通过多种机制发挥神经保护效应。
3.1 抑制儿茶酚胺释放缺氧性脑损伤已知与儿茶酚胺的大量释放,中枢和外周的去甲肾上腺素浓度升高有关。儿茶酚胺可通过激活中枢α2受体使脑缺血的结局恶化。中枢去甲肾上腺素的增加,会使细胞代谢需求增加,使血流流向缺血组织,从而加重神经损害。此外,去甲肾上腺素的代谢产物还能促进氧化应激。缺血时,儿茶酚胺还使神经元对谷氨酸的敏感性增加,这类兴奋性神经递质会加剧损害。研究显示,在整体动物(大鼠)脑缺血期间,血浆儿茶酚胺水平与神经病学的结局相关。DEX阻滞交感神经,使中枢的交感活性减弱,并明显降低循环儿茶酚胺的水平,从而发挥神经保护作用[6]。
3.2 营养神经,抑制神经元凋亡体外[16, 17]、体内[18, 19]实验均表明,DEX有神经保护作用,而此作用有可能是通过激活细胞外信号调节激酶(ERK)而实现的。Degos等[18]发现,DEX可通过依赖于ERK的通路使星型胶质细胞脑源性神经营养因子(BDNF)的表达增加,从而对抗谷氨酸激动剂导致的神经元死亡。Yan等[20]也证明DEX可促进GDNF的释放来保护中风后神经元,这个信号可能依赖于PKCα和CREB的激活。DEX在大鼠不完全性脑缺血和再灌注模型可上调抗凋亡蛋白、下调促凋亡蛋白的表达,发挥脑保护作用。DEX还可以预防麻醉药如异氟烷[21]、氯胺酮[22]等所导致的神经毒性,减轻神经元凋亡。
3.3 抗氧化作用大脑缺血缺氧会使脑组织的活性氧(ROS)形成增加,而ROS直接参与细胞大分子如核酸、蛋白质和脂质的氧化损伤,从而导致细胞死亡。DEX可以增强抗氧化物酶如SOD的活性,降低脂质过氧化[7],上调DNA修复酶8-羟基鸟嘌呤DNA糖苷酶(OGG1)[23],减少神经损伤。Sifringer等[24]还发现DEX能影响谷胱甘肽氧化还原系统,使GSH/GSSG比值水平明显升高,减弱氧化应激。
3.4 抑制神经炎症反应神经炎症是POCD的发病机制之一。DEX通过激活中枢α2受体,抑制交感神经兴奋,下调促炎介质,抑制炎症反应[25]。研究发现,DEX可抑制激活的小胶质细胞[26]和星形胶质细胞[27, 28],降低炎症因子水平,如TNF-α[27, 28, 29, 30]、IL-1β[24, 28, 29, 30]、IL-6[27, 30],从而减轻神经炎症,降低POCD的发生率。
3.5 咪唑啉I受体的参与I受体分为3个亚型,包括I1受体、I2受体、I3受体。已有研究证实,I受体的激活能产生神经保护作用。DEX有可能通过I1受体[31]和I2受体产生神经保护作用。Zhang等[32]发现DEX通过激活I2受体及其下游PI3K/Akt通路,上调缺氧诱导因子1α(HIF-1α)的表达,HIF-1α可调节多种基因的表达,如血管内皮生长因子(VEGF)。VEGF可诱导血管发生,从而促进损伤恢复。
4 结语POCD不仅对患者的生活质量产生巨大影响,而且会增加医疗费用,造成严重的社会负担,因此研究患者POCD具有重要的医学、经济和社会价值。DEX作为镇静剂在临床上应用后,已成为麻醉科医师手中有价值的治疗工具。虽然,目前很多体内外的研究表明DEX具有神经保护功能,但其神经保护作用的机制还不是很清楚。在将它作为一种神经保护药应用于临床前,还需要从分子水平层面更进一步研究其机制,并且需要更多的随机临床对照研究来确认它的疗效。
| [1] | Segal I S, Vickery R G, Walton J K, et al. Dexmedetomidine diminishes halothane anesthetic requirements in rats through a postsynaptic alpha 2 adrenergic receptor[J]. Anesthesiology, 1988, 69(6):818-23. |
| [2] | Doze V A, Chen B X, Maze M. Dexmedetomidine produces a hypnotic-anesthetic action in rats via activation of central alpha-2 adrenoceptors[J]. Anesthesiology, 1989, 71(1):75-9. |
| [3] | Knaus A E, Muthig V, Schickinger S, et al. Alpha2-adrenoceptor subtypes-unexpected functions for receptors and ligands derived from gene-targeted mouse models[J]. Neurochem Int, 2007, 51(5):277-81. |
| [4] | Correa-Sales C, Rabin B C, Maze M. A hypnotic response to dexmedetomidine, an alpha 2 agonist, is mediated in the locus coeruleus in rats[J]. Anesthesiology, 1992, 76(6):948-52. |
| [5] | Fisher B, Zornow M H, Yaksh T L, Peterson B M. Antinociceptive properties of intrathecal dexmedetomidine in rats[J]. Eur J Pharmacol, 1991, 192(2):221-5. |
| [6] | Ma D, Rajakumaraswamy N, Maze M. alpha2-Adrenoceptor agonists: shedding light on neuroprotection[J] ? Br Med Bull, 2005, 71:77-92. |
| [7] | Eser O, Fidan H, Sahin O, et al. The influence of dexmedetomidine on ischemic rat hippocampus[J]. Brain Res, 2008, 1218:250-6. |
| [8] | Cosar M, Eser O, Fidan H, et al. The neuroprotective effect of dexmedetomidine in the hippocampus of rabbits after subarachnoid hemorrhage[J]. Surg Neurol, 2009, 71(1):54-9. |
| [9] | 戚志超, 王根宝, 吴论, 等. 右美托咪定对老龄大鼠术后海马脑源性神经营养因子及胆碱乙酰转移酶表达的影响[J].中华麻醉学杂志, 2014, 30(8):796-800. Qi Z C, Wang G B, Wu L, et al. Effects of dexmedetomidine on postoperative cognitive function and hippocampus brain-derived neurotrophic factor and choline acetyltransferase expression in rats[J]. Chin J Anesthesiol, 2014, 30(8): 796-800. |
| [10] | Chen J J, Yan J Q, Han X P. Dexmedetomidine may benefit cognitive function after laparoscopic cholecystectomy in elderly patients[J]. Exp Ther Med, 2013, 5(2):489-94. |
| [11] | Zhang H, Lu Y, Liu M, et al. Strategies for prevention of postoperative delirium: a systematic review and meta-analysis of randomized trials[J]. Crit Care, 2013, 17(2):R47. |
| [12] | Chi O Z, Grayson J, Barsoum S, et al. Effects of dexmedetomidine on microregional O2 balance during reperfusion after focal cerebral ischemia[J]. J Stroke Cerebrovasc Dis, 2015, 24(1):163-70. |
| [13] | Kang W S, Kim S Y, Son J C, et al. The effect of dexmedetomidine on the adjuvant propofol requirement and intraoperative hemodynamics during remifentanil-based anesthesia[J]. Korean J Anesthesiol, 2012, 62(2):113-8. |
| [14] | Brede M, Braeuninger S, Langhauser F, et al. α2-Adrenoceptors do not mediate neuroprotection in acute ischemic stroke in mice[J]. J Cereb Blood Flow Metab, 2011, 31(10):e1-e7. |
| [15] | Huang C, Ho Y S, Ng O T, et al. Dexmedetomidine directly increases Tau phosphorylation[J]. J Alzheimers Dis, 2015, 44(3):839-50. |
| [16] | Dahmani S, Rouelle D, Gressens P, Mantz J. Characterization of the postconditioning effect of dexmedetomidine in mouse organotypic hippocampal slice cultures exposed to oxygen and glucose deprivation[J]. Anesthesiology, 2010, 112(2):373-83. |
| [17] | Schoeler M, Loetscher P D, Rossaint R, et al. Dexmedetomidine is neuroprotective in an in vitro model for traumatic brain injury[J]. BMC Neurol, 2012, 12:20. |
| [18] | Degos V, Chhor V, Brissaud O, et al. Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J]. Anesthesiology, 2013, 118(5):1123-32. |
| [19] | Zhu Y M, Wang C C, Chen L, et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J]. Brain Res, 2013, 1494:1-8. |
| [20] | Yan M, Dai H B, Ding T T, et al. Effects of dexmedetomidine on the release of glial cell line-derived neurotrophic factor from rat astrocyte cells[J]. Neurochem Int, 2011, 58(5):549-57. |
| [21] | 曾敏婷, 李玉娟, 王飞, 等. 右美托咪定对异氟醚引起新生大鼠海马细胞凋亡及CRMP2表达的影响[J].中国药学杂志, 2013, 48(14):1165-9. Zeng M T, Li Y J, Wang F, et al. Effects of dexmedetomidine on isoflurance induced neuroapoptosis and expression of CRMP2 in neonatal rat hippocampus[J]. Chin Pharm J, 2013, 48(14):1165-9. |
| [22] | Duan X, Li Y, Zhou C, et al. Dexmedetomidine provides neuroprotection: impact on ketamine-induced neuroapoptosis in the developing rat brain[J]. Acta Anaesthesiol Scand, 2014, 58(9):1121-6. |
| [23] | 斯妍娜, 鲍红光, 韩流, 等. 右美托咪定对大鼠海马神经细胞氧糖缺失/复氧复糖时OGG1 mRNA表达的影响[J].中华麻醉学杂志, 2013, 33(8):1003-6. Si Y N, Bao H G, Han L, et al. Effect of dexmedetomidine on expression of OGG1 mRNA in rat hippocampal neurons subjected to oxygenglucose deprivation/reoxygenation and restoration[J]. Chin J Anesthes, 2013, 33(8):1003-6. |
| [24] | Sifringer M, von Haefen C, Krain M, et al. Neuroprotective effect of dexmedetomidine on hyperoxia-induced toxicity in the neonatal rat brain[J]. Oxid Med Cell Longev, 2015, 2015:530371. |
| [25] | Hofer S, Steppan J, Wagner T, et al. Central sympatholytics prolong survival in experimental sepsis[J]. Crit Care, 2009, 13(1):R11. |
| [26] | Peng M, Wang Y L, Wang C Y, Chen C. Dexmedetomidine attenuates lipopolysaccharide-induced proinflammatory response in primary microglia[J]. J Surg Res, 2013, 179(1):e219-25. |
| [27] | Zhang X B, Wang J, Qian W Y, et al. Dexmedetomidine inhibits tumor necrosis factor-alpha and interleukin 6 in lipopolysaccharide-stimulated astrocytes by suppression of c-Jun N-terminal kinases[J]. Inflammation, 2014, 37(3):942-9. |
| [28] | Xie C Y, Wang Z H, Tang J J, et al. The effect of dexmedetomidine post-treatment on the inflammatory response of astrocyte induced by lipopolysaccharide[J]. Cell Biochem Biophys, 2015, 71(1):407-12. |
| [29] | Qian X L, Zhang W, Liu M Z, et al. Dexmedetomidine improves early postoperative cognitive dysfunction in aged mice[J]. Eur J Pharmacol, 2015, 746:206-12. |
| [30] | 华潇潇, 陈洁琳, 张莉莉, 等. 右美托咪定抑制化学性低氧引起的PC12细胞炎症反应[J]. 中国药理学通报, 2014, 30(1):85-9. Hua X X, Chen J L, Zhang L L, et al. Dexmedetomidine inhibits inflammation induced by chemical hypoxia in PCI2 cells[J]. Chin Pharmacol Bull, 2014, 30(1):85-9. |
| [31] | Dahmani S, Paris A, Jannier V, et al. Dexmedetomidine increases hippocampal phosphorylated extracellular signal-regulated protein kinase 1 and 2 content by an alpha 2-adrenoceptor-independent mechanism: evidence for the involvement of imidazoline I1 receptors[J]. Anesthesiology, 2008, 108(3):457-66. |
| [32] | Zhang F J, Ding T T, Yu L, et al. Dexmedetomidine protects against oxygen-glucose deprivation-induced injury through the I2 imidazoline receptor-PI3K/AKT pathway in rat C6 glioma cells[J]. J Pharm Pharmacol, 2012, 64(1):120-7. |

