


大脑中动脉是人类脑卒中的多发部位[1]。脑卒中又称中风或脑血管意外,是由脑部血液循环障碍导致局部神经功能缺失的疾病,包括颅内和颅外动脉、静脉及静脉窦的疾病,其中以动脉疾病较为常见[2]。大脑中动脉阻塞模型是局灶性脑缺血的标准动物模型。然而在该模型的定量评价指标中主要以脑梗死面积及含水量测定为主[1, 3]。在梗死面积的测定时,需要做脑切片,采用氯化三苯基四氮唑染色显示梗死的脑组织,其中粉红色为正常脑组织,白色为梗死区,然后拍照,运用相关软件计算每片脑组织的梗死面积,或者用“梗死范围”法,将白色脑组织挖下称重,以梗死组织质量占总脑质量的百分比作为脑梗死范围。很明显,传统的方法只能计算每片脑组织1个切面的梗死面积,“梗死范围”法误差更大,都无法精确的表现出脑梗死的真实情况。
组织自发荧光是一种常见的现象[1, 2, 3],如果能用一种精密仪器,能检测到组织自发荧光并将其定量,那么就能解决传统方法不能解决的局灶性脑缺血/再灌注损伤模型梗死部位脑组织的精确定量评价问题。目前,应用荧光检测技术对正常大鼠和局灶性脑缺血/再灌注损伤大鼠脑组织进行自发荧光检测和荧光强度的定量分析还未见报道。Caliper Kinetics IVIS活体成像系统能检测到较微弱的组织自发荧光,而且能够对荧光强度进行定量分析。本研究运用该系统更加形象的展示出大鼠脑组织不同部位的自发荧光情况,更为精确的计算出脑梗死的面积,为大鼠局灶性脑缺血/再灌注损伤模型的研究及其评价提供新的依据。
1 材料与方法 1.1 实验动物及饲养条件SPF级SD大鼠购于广东省医学实验动物中心,体质量280~300 g,♂。实验动物饲养的环境条件符合国家标准(GB14925-2010)对SPF级实验动物环境条件的要求。实验室温度为20℃-26℃,最大日温差/℃≤4,相对湿度为40%-70%,最小换气次数≥15(次/h),空气洁净度为7级,相同区域的最小压差≥10 Pa,沉降菌最大平均浓度≤3(CFU/0.5 h·Φ 90 mm平皿),氨浓度≤14 mg/m3,噪声不高于60 dB,动物照度为15-20 lx。
1.2 实验动物饲料及饮用水实验动物饲料购于广东省医学实验动物中心,符合GB-14924.3-2010标准。饮用水经海口市疾病预防控制中心现场采样进行理化指标及微生物指标检测,所检测项目结果均符合现行国家《生活饮用水卫生标准》(GB 5749-2006)规定的限值要求。
1.3 SD大鼠局灶性脑缺血/再灌注损伤模型的制备采用线栓法(thread occlusion of the middle cerebral artery)制备SD大鼠局灶性脑缺血/再灌注损伤模型[1, 4]:选择检疫合格的♂ SD大鼠,体质量为280-300 g。经腹腔注射水合氯醛(300 mg·kg-1剂量)麻醉,取仰卧位固定,剪去手术部位毛发,安尔碘消毒皮肤,切开颈部皮肤,钝性分离,显露右侧颈总动脉(CCA)及迷走神经。结扎CCA、颈外动脉(ECA),动脉夹夹闭右侧颈内动脉(ICA)。在ECA结扎处用眼科剪剪一个小口,将准备好的线栓经该口插入,经ECA、ICA分叉处进入ICA,再向前推进18-20 mm时会有阻挡感,说明线栓已穿过MCA,到达大脑前动脉的起始部,堵塞MCA开口,造成脑组织局部缺血。2 h后缓慢拔出线栓实施再灌注损伤。
1.4 局灶性脑缺血/再灌注模型神经症状和体征的评价局灶性脑缺血/再灌注模型神经症状和体征的评价参照Zealonga [1, 5] 的5分测评方法进行评分。0 分:无神经功能缺失,活动正常;1 分:不能伸展对侧前爪;2 分:爬行时出现外侧转圈(追尾征);3 分:行走时身体向对侧倒;4 分:不能行走,意识丧失。24 h后麻醉放血处死动物,取出大脑,9 000 mg·L-1氯化钠注射液洗干净,置于干净的纱布上吸干表面的氯化钠注射液备用。
1.5 SD大鼠脑组织自发荧光检测采用caliper精诺真IVIS活体成像技术检测大鼠脑组织的自发荧光,选择荧光检测。依据Zealonga评分标准,选择分值为2分的动物进行脑组织自发荧光检测。将准备好的脑组织放入活体成像仪内合适的位置,然后进行拍照、数据分析和保存。先对脑组织进行完整分析,然后再横向切成数片进行局部分析,以确定损伤的部位和损伤的程度。
1.6 SD大鼠正常脑组织和局灶性脑缺血/再灌注损伤脑组织自发荧光部位的比较选择检疫合格的SD大鼠,挑选体重较为接近的动物进行比较。根据活体成像系统所得到的正常脑组织和局灶性脑缺血/再灌注损伤脑组织自发荧光所在的不同部位及其荧光强度差异分析,可以得出它们之间所存在的明显差异。
1.7 组织自发荧光定量分析采用caliper精诺真IVIS活体成像分析软件对实验结果进行定量分析。
2 结果 2.1 SD大鼠局灶性脑缺血/再灌注损伤模型的制备采用线栓法制备大鼠局灶性脑缺血/再灌注损伤模型,并依据Zealonga 的测评方法进行评分。结果表明,在12只造模动物中,有7只动物分值为2分(Fig1A),表现体征为不能伸展对侧前爪,爬行时出现外侧转圈;有5只动物分值为3分,表现体征为不能伸展对侧前爪,行走时身体向对侧跌倒。Fig1B为Fig1A中所示动物的脑组织,从中可以看出,大脑右半球出现水肿,体积比左半球略大,且其颜色也比左半球的白。

|
| Fig.1 Preparation of focal cerebral ischemia reperfusion injury model in rats A:SD rats with focal cerebral ischemia reperfusion injury model;B:rat brain tissue as shown in figure A. On the right side of the brain slightly larger than the left side and the surface than on the left side of the white color due to edema caused by its volume. |
采用小动物活体成像的荧光检测技术对局灶性脑缺血/再灌注损伤脑组织进行荧光检测(Fig2),结果表明,局灶性脑缺血/再灌注损伤模型的左半球大脑和右半球大脑荧光呈现出明显的区别,右半球大脑荧光强度明显比左半球大脑强。从Fig2A-I可以看出,大脑组织损伤的部位和损伤的程度,荧光强度越强,损伤越严重。

|
| Fig.2 Autofluorescence of focal cerebral ischemia reperfusion injury of brain tissue by IVIS A-I:autofluorescence images of brain tissue for focal cerebral ischemia reperfusion injury;A-F:for animal neurobehavioral score are two points;G-I:for animal neurobehavioral score are three points;J:color scale of C. From blue to green of the color scale express fluorescence intensity gradually increased. |
将正常大鼠和模型大鼠的大脑切片,先用小动物活体成像系统进行荧光检测,然后再进行TTC染色。实验结果如Fig3所示。结果表明,局灶性脑缺血/再灌注损伤大脑梗死部位未被TTC染色,但其荧光强度明显增强。分别选取了7只正常和局灶性脑缺血/再灌注损伤SD大鼠的脑组织进行自发荧光检测和分析。其中损伤组动物的神经症状和体征的评分均为2分。将正常组和损伤组2个组的动物分别变为1-7号,相同号数同时检测,不同号数用不同的颜色表示。结果表明,正常动物同一脑组织左侧和右侧自发荧光强度无明显差异,基本一致。而损伤同一脑组织左侧和右侧自发荧光强度存在明显差异,如图中绿色箭头所示部分,其荧光强度明显高于其它部位。

|
| Fig.3 TTC staining of rat brain tissue with spontaneous fluorescence detection A-B:normal brain tissue;A,TTC stain;B,spontaneous fluorescence detection,the fluorescence intensity of left and right brain are basically identical. C-D:brain tissue for focal cerebral ischemia reperfusion injury;C,TTC stain;D,spontaneous fluorescence detection. Brain on the right side of fluorescence intensity significantly stronger than the left. To TTC staining first for normal brain tissue and draw focal cerebral ischemia reperfusion injury of brain tissue,then to detect organize spontaneous fluorescence. E: color scale of B and D. from blue to green of the color scale express fluorescence intensity gradually increased. |
从Fig4中可以清晰的看出损伤脑组织的部位和范围。但是还需要将结果进行定量分析,即计算出整个脑组织的荧光强度。从Fig4中还可以看出,脑组织的自发荧光强度和脑组织的损伤程度直接相关,损伤程度越重,自发荧光强度越强。因此,可以通过Caliper Kinetics IVIS活体成像系统对整个脑组织或者是感兴趣部位的自发荧光强度进行定量分析(Fig5,Tab1),所得到的数据再通过如SPSS等统计分析软件进行方差分析,比较正常脑组织和损伤脑组织的差异是否具有统计学意义。如Fig5所示,可以随意定量分析自己所感兴趣的部位,或是将脑组织从这里切开再进行分析。如Tab1所示,损伤组脑组织自发荧光强度与正常脑组织比较明显增强,且差异有统计学意义,P<0.01。

|
| Fig.4 Autofluorescence of brain tissue for normal and draw focal cerebral ischemia reperfusion injury of SD rats brain tissue A:spontaneous fluorescence of normal brain tissue;B:spontaneous fluorescence of draw focal cerebral ischemia reperfusion injury. The most seriously injured area of the brain tissue where Green arrow places the fluorescence intensity is strongest. |

|
| Fig.5 Quantitative analysis of organization spontaneous fluorescence From A to C:Quantitative analysis of autofluorescence fluorescence intensity for whole brain tissue and the different parts of the brain. D:quantitative analysis of autofluorescence fluorescence intensity for the brain tissue with incision from the strongest part of fluorescence intensity. |
 ,n=7)
,n=7)
| Group | Fluorescence intensity 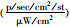 |
| **P<0.01 vs normal control group. | |
| Normal | 1.62E+08±4.01E+07 |
| Damage model | 5.73E+08±4.57E+07** |
局灶性脑缺血/再灌注模型的造模方法很多,比如线栓法、电凝法、光化学法和血栓法等[1],技术也非常成熟。但对于脑梗死的评价方法还有待完善和创新。本研究首次提出用组织自发荧光来评价局灶性脑缺血/再灌注损伤的脑组织。
我们通过研究发现,通过活体成像系统能非常好地检测到脑组织自发荧光;其次,局灶性脑缺血/再灌注损伤部位的脑组织自发荧光强度与正常脑组织相比明显增强,且实验结果具有显著统计学意义;第三,不用将大脑组织切片,也不用经过TTC染色以及繁琐的梗死面积和体积的计算,可以直接通过活体成像系统软件精确而又快速地计算出梗死部位或任意部位或整个脑组织的自发荧光的强度进行定量分析。
从Fig3D和Fig5D图片中可以看出,将脑组织从荧光强度最强的部位横向切开成片再进行自发荧光检测,右侧大脑不同梗死部位荧光强度也有所不同。综合分析Fig3C和D,结果表明:右侧大脑的尾状壳核、胼胝体和苍白球等部位荧光强度明显强于大脑皮质层。这说明即便是在均未被TTC染色的梗死区,不同部位自发荧光强度也具有较大差异。损伤程度较低的左侧大脑自发荧光强度也明显低于右侧大脑,而正常脑组织左右侧大脑的自发荧光强度并没有明显的区别。大鼠的脑组织在脑缺血/再灌注损伤时,损伤部位的受体活化效应可引发大量的Ca2+内流,同时激活细胞内Ca2+库的释放,并导致细胞内游离Ca2+超载[6]。因此,我们推测损伤脑组织自发荧光明显增强可能与细胞内游离Ca2+超载有关。在今后的研究中,我们将进一步具体分析梗死区域不同部位以及正常脑组织不同部位的自发荧光强度的差异及其产生这种差异的原因。
| [1] | Zhou G X,Gao C,Xu P,et al.Replication methodology of animal models for human disease[M]. Shanghai:Shanghai scientific and technological literature press,2008:249-51. |
| [2] | Walberer M,Stolz E,Muller C,et al.Experimentalstroke:ischaemic lesion volume and oedema formation differ among rat strains(acomparison between Wistar and Sprague-Dawley rat susing MRI)[J].LabAnim,2006,40(1):1-8. |
| [3] | Sakurama T,Kitamura R,Kaneko M. Tissue-type plasminogen actiator improves neurological functions in a rat model of thromboembolic stroke[J].Stroke,1994,25(2):451-6. |
| [4] | Toshima Y,Sstoh S,Ikegaki I,Asano T.A new model of cerebral microthrombosis in rat and the neuropotective effect of a Rho-Kinase inhibitor[J].Stroke,2000,31(9):2245-50. |
| [5] | Lin C L,Calisaneller T,Ukita N,et al.A murine model of subarachnoid hemorrhage-induced cerebral vasospasm[J].Neurosci Meth,2003,1(123):89-97. |
| [6] | Jensen A,Garnier Y,Middelanis J.Perinatal brain damage-pathophysiology to prevention[J].Europ J Obstet Gynecol Reproduct Biol,2003,110(suppl):70-9. |

