


雌激素是女性体内最重要的性激素之一。内源性雌激素及植物所含具有雌激素活性的化学成分——植物雌激素(phytoestrogen)发挥调节效应的共有关键途径是经典的雌激素核受体(estrogen receptor,ER),包括ERα和ERβ两种亚型。但随着相关领域研究的不断深入和扩展,上述两种经典的ER亚型介导机制已被发现无法确切、全面地阐明雌激素样成分的作用途径,特别是其所具有的与转录调节功能无关的快速细胞信号应答反应和传导过程[1, 2, 3]。其后的进一步研究为阐释上述问题提供了新的线索:20世纪末多个实验室在多项研究中相继报道了一种新型膜受体——膜G蛋白偶联受体30(G protein-coupled receptor 30,GPR30)[4, 5, 6],虽然其在结构上与经典ER没有同源性,但也可特异性结合雌激素及雌激素样物质并介导其效应,因此GPR30之后被赋予了另一与该效应更相吻合的名称——G蛋白偶联雌激素受体(G protein-coupled estrogen receptor,GPER)[7],该受体效应的揭示为诠释雌激素的快速应答反应提供了新的重要切入点。
近年来的研究表明,多种能够结合经典雌激素受体的化合物也可结合、活化GPER[8]。在多种雌激素相关肿瘤的发生和演变中,GPER发挥了重要的介导作用[9]。GPER也成为了特异性雌激素相关肿瘤细胞抗肿瘤药物的候选新靶标[10]。本课题组在既往研究中已经发现,丹参的重要活性成分丹参酮IIA(Tanshinone II-A)可通过ER途径明显抑制乳腺癌T47D细胞的增殖,但ER调节和介导功能并不能完全解释其效应[11],GPER是否也是其抗癌效应的重要靶点和介导者?本研究旨在进一步探讨丹参酮IIA抗乳腺癌效应及其GPER靶向和介导机制,以期为临床乳腺癌的治疗提供更加全面的实验基础和理论依据。
1 材料 1.1 试剂DMEM(高糖)、无酚红DMEM(高糖)、胎牛血清、活性炭-葡聚糖苷处理的胎牛血清(CDT-FBS)为Hyclone公司产品;雌二醇(Estradiol,E2)、MTT、DMSO为Sigma公司产品;GPER抗体、β-肌动蛋白抗体、对照SiRNA、GPER SiRNA为Santa Cruz公司产品;脂质体Lipofectamine-2000 购自Invitrogen公司;GPER特异性激动剂G1、GPER特异性拮抗剂G15为Tocris公司产品;甘氨酸、Tween-20为Amresco公司产品;BCA蛋白定量试剂盒、RIPA裂解液、苯甲基磺酰氟(PMSF)、30%丙烯酰胺、浓缩胶缓冲液、分离胶缓冲液、蛋白分子量Marker、三羟甲基氨基甲烷、十二烷基磺酸钠、脱脂奶粉、TEMED、SDS-PAGE 上样缓冲液、ECL超敏发光液为普利莱基因有限公司产品;二抗Anti-Rabbit IgG/HRP为北京康为世纪生物科技有限公司产品。
1.2 药物丹参酮IIA购自中国生物制品检定所,纯度:98%;实验时以DMSO溶解,终浓度为:1×10-5 mol·L-1 ~1×10-7 mol·L-1。
1.3 细胞株人乳腺癌T47D细胞购自协和医科大学细胞中心。
1.4 仪器CO2培养箱(Binder);酶联免疫检测仪(Epson LX-800);倒置显微镜(Olympus);凝胶成像分析仪(Pharmacia);流式细胞仪(BD)。
2 方法 2.1 细胞培养人乳腺癌T47D细胞,常规培养在含10% 胎牛血清的DMEM高糖溶液中,培养条件为37℃,5% CO2,相对饱和湿度。实验开始前4天将细胞用PBS洗涤2次后,改为在无酚红DMEM(含5% CDT-FBS)中培养,以耗尽细胞内储存的雌激素。
2.2 MTT细胞增殖试验T47D细胞传代3次,经无酚红DMEM(含5% CDT-FBS)培养4 d后,选取对数生长期细胞,0.25% 胰蛋白酶消化,PBS洗涤2次,加入无血清DMEM,以细胞密度3×103个/孔接种于96孔板内,每孔培养液总体积为200 μL。培养24 h待细胞贴壁后,换为含1×10-8 mol·L-1 雌二醇、1×10-5 mol·L-1~1×10-7 mol·L-1丹参酮IIA的DMEM培养液中继续培养;在GPER干预组中同时加入1×10-8 mol·L-1 GPER激动剂G1或GPER拮抗剂G15;每种受试物均设6个复孔。于48 h后加入MTT(5 g·L-1,15 μL /孔),继续孵育4 h,小心吸去培养液,每孔加入DMSO 150 μL。以DMSO调零,用酶联免疫检测仪在570 nm下测定各孔光吸收值(A),计算平均A值和增殖率(proliferation rate,PR)。
PR/%=(实验组A值/溶剂对照组A值)×100%
2.3 Western blot检测GPER SiRNA转染效果T47D细胞传代3次,经无酚红DMEM(含5% CDT-FBS)培养4 d后,选取对数生长期细胞,以2×105 个/孔密度将细胞接种于6孔培养板中。在细胞密度达到80% 时进行对照SiRNA或GPER SiRNA转染:5 μL siRNA/孔应用脂质体Lipofectamine-2000按试剂盒说明进行转染。培养48 h后收集细胞,加入细胞裂解液,并以14 000×g离心20 min,将上清部分进行蛋白含量测定后用于免疫印迹分析。蛋白变性后上样,SDS-PAGE电泳(浓缩胶80 V,分离胶120 V),半干电转膜仪转膜(60 V,120 min)。5%脱脂奶粉37℃振摇1 h将膜封闭;加入GPER一抗,4℃孵育过夜。HRP标记的二抗37℃振摇1 h后,将PVDF膜置ECL混合液中室温下振荡孵育5 min,X胶片曝光,显影、定影、扫描后,以β-肌动蛋白表达量为对照观察结果。
2.4 GPER SiRNA转染T47D细胞增殖试验T47D细胞处理及GPER SiRNA转染过程同“2.3”。应用上述转染成功的T47D细胞,以细胞密度3×103个/孔接种于96孔板内,24 h后按上述“2.2”步骤换为含1×10-8 mol·L-1 雌二醇、1×10-5 mol·L-1~1×10-7 mol·L-1丹参酮IIA的DMEM培养液中继续培养,每种受试物均设6个复孔。于48 h后应用MTT法检测药物对GPER SiRNA转染T47D细胞增殖的影响。
2.5 Western blot检测丹参酮IIA对细胞GPER蛋白表达的影响取经无酚红DMEM(含5% CDT-FBS)培养4 d的T47D细胞,以5×105个/ 瓶的密度接种于25 cm2的培养瓶中,以无血清DMEM接种24 h待细胞贴壁后,换为含1×10-8 mol·L-1 雌二醇、1×10-5 mol·L-1或1×10-6 mol·L-1丹参酮IIA的DMEM培养液继续培养。药物作用48 h后收集细胞,加入细胞裂解液,并以14 000×g离心20 min,将上清部分进行蛋白含量测定后用于GPER免疫印迹分析。蛋白变性、SDS-PAGE电泳及结果检测方法均与“2.3”步骤相同。
2.6 数据统计与分析实验结果均用 表示,用SPSS 11.0软件进行数据处理,用t检验进行统计学分析。
表示,用SPSS 11.0软件进行数据处理,用t检验进行统计学分析。
从Tab1可见,阳性药物(1×10-8 mol·L-1雌二醇)在48 h时可使T47D细胞增殖速率明显增加(P<0.01),加入G1后其促增殖作用明显有所增强,加入G15后其促增殖作用有所减弱(P<0.05)。而1×10-5 mol·L-1~1×10-7 mol·L-1丹参酮IIA对T47D细胞增殖均具有明显抑制作用(P<0.01)。加入G1后其增殖抑制作用被部分拮抗(P<0.05);加入G15后其增殖抑制作用进一步增强(P<0.05)。
 ,n=6)
,n=6)
| Treatment | 48 h | 48 h+G1 1×10-8 mol·L-1 | 48 h+G15 1×10-8 mol·L-1 | |
| *P<0.05,**P<0.01 vs EtOH control; △P<0.05 vs same concentration of estradiol or tanshionoe IIA without G1 or G15 | ||||
| EtOH | 0.2% | 0.524±0.017 | 0.517±0.024 | 0.514±0.018 |
| Estradiol | 1×10-8 mol·L-1 | 0.652±0.013** | 0.672±0.011** | 0.586±0.008**△ |
| Tanshinone IIA | 1×10-7 mol·L-1 | 0.452±0.022** | 0.487±0.018△ | 0.409±0.028**△ |
| Tanshinone IIA | 1×10-6 mol·L-1 | 0.393±0.027** | 0.451±0.018*△ | 0.356±0.016**△ |
| Tanshinone IIA | 1×10-5 mol·L-1 | 0.292±0.024** | 0.364±0.020**△ | 0.266±0.026** |
Fig 1显示,GPER SiRNA转染可使T47D细胞GPER蛋白表达水平明显降低,与正常对照组相比差异有显著性(P<0.01),即GPER SiRNA转染可构建GPER蛋白表达水平明显降低的T47D细胞。
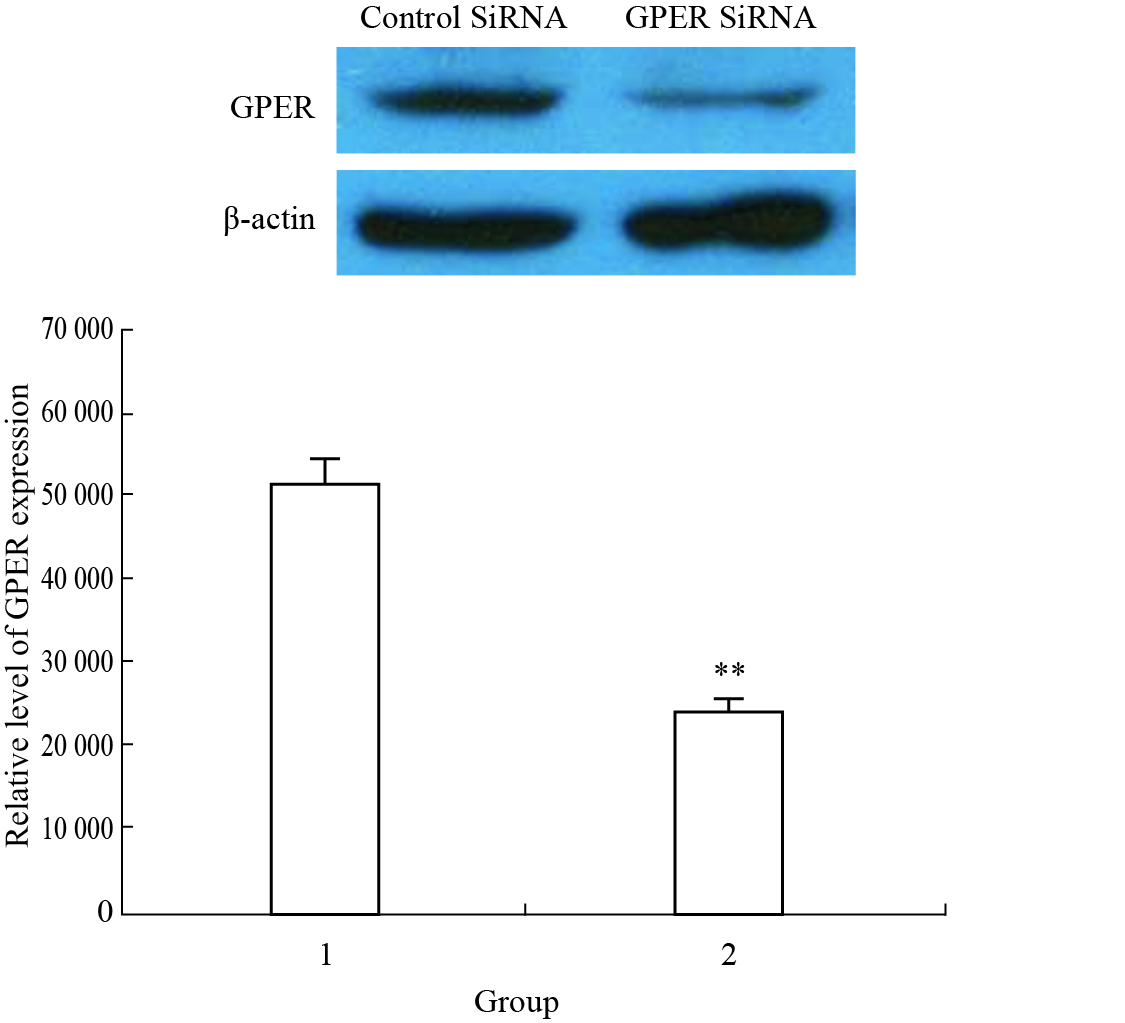
|
| Fig.1 Effect of GPER SiRNA transfection on GPER protein expression in T47D cells 1:Control SiRNA; 2:GPER SiRNA.**P<0.01 vs group transfected with control SiRNA |
从Tab 2可见,与“3.1”结果一致,1×10-8 mol·L-1雌二醇在48 h时可使T47D细胞增殖速率明显增加(P<0.01),GPER SiRNA转染后其促增殖作用明显减弱(P<0.01)。而1×10-5 mol·L-1~1×10-7 mol·L-1丹参酮IIA对T47D细胞增殖具有明显抑制作用(P<0.05或0.01),GPER SiRNA转染促进了丹参酮IIA抗增殖作用的进一步增强,与相应浓度未转染组相比差异有显著性(P<0.05或0.01)。
 ,n=6)
,n=6)
| Treatment | 48 h | 48 h+SiRNA | ||
| *P<0.05,**P<0.01 vs EtOH control; △P<0.05,△△P<0.01 vs same concentration of estradiol or tanshionoe IIA in untransfected group | ||||
| EtOH | 0.2% | 0.516±0.022 | 0.498±0.006 | |
| Estradiol | 1×10-8 mol·L-1 | 0.633±0.007** | 0.544±0.013**△△ | |
| Tanshinone IIA | 1×10-7 mol·L-1 | 0.466±0.011* | 0.372±0.029**△△ | |
| Tanshinone IIA | 1×10-6 mol·L-1 | 0.407±0.030** | 0.344±0.029**△ | |
| Tanshinone IIA | 1×10-5 mol·L-1 | 0.296±0.007** | 0.256±0.005**△△ | |
Fig 2显示,药物作用48 h后,1×10-8 mol·L-1雌二醇可使T47D细胞GPER蛋白表达水平稍有降低,但与正常对照组相比差异没有显著性。1×10-5 mol·L-1和1×10-6 mol·L-1丹参酮IIA可诱导T47D细胞GPER蛋白表达水平明显下降(P<0.01)。
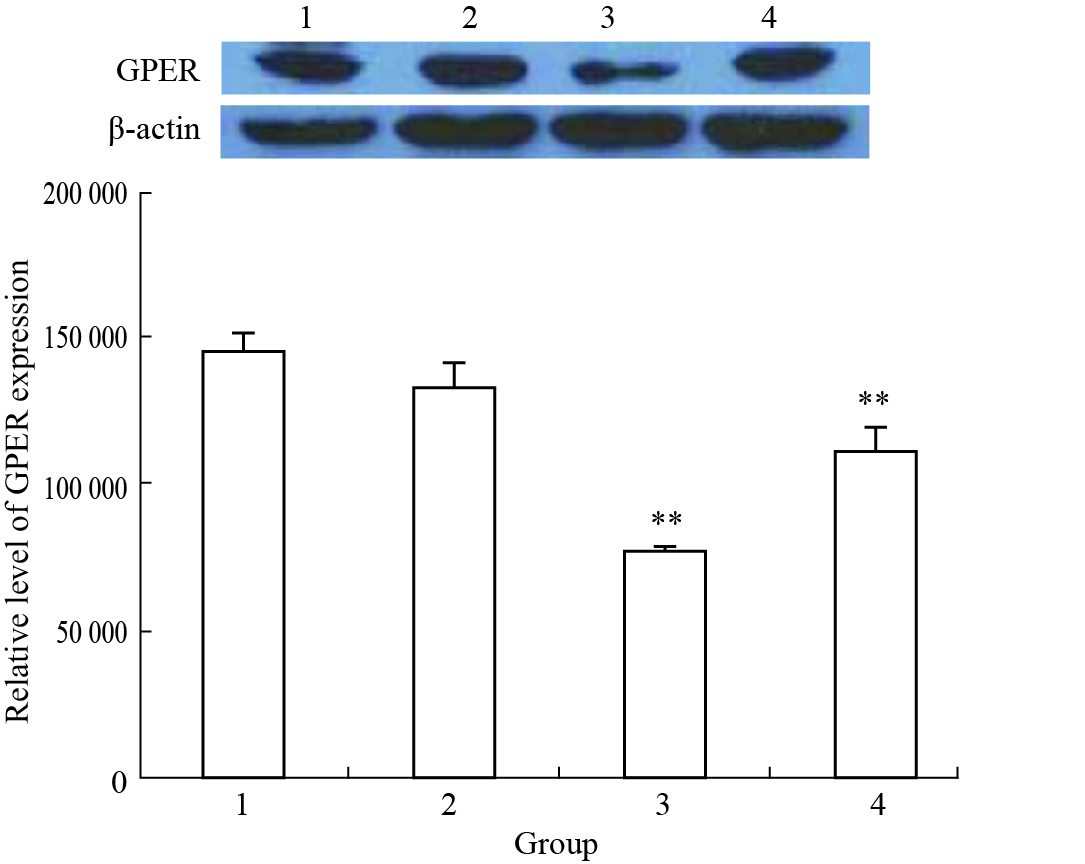
|
| Fig.2 Effect of tanshinone IIA on GPER protein expression in T47D cells 1:EtOH; 2:1×10-8 mol·L-1 estradiol; 3:1×10-5 mol·L-1 tanshinone IIA; 4:1×10-6 mol·L-1 tanshinone IIA.**P<0.01 vs EtOH control |
丹参酮为中药丹参的一组脂溶性菲醌类有效成分,丹参酮IIA是其中的代表性化合物,是丹参发挥药效的重要活性成分,其抗肿瘤作用,包括抗乳腺癌细胞生长的作用已为实验所证实[12, 13]。本课题组在以前的研究中曾发现,丹参酮IIA对ER阳性T47D细胞增殖具有明显的抑制作用[11];而且已证明了丹参酮IIA在发挥该抗癌效应过程中经过了ER介导途径,并具有升高ERα/ERβ比值的作用。但值得注意的是,据文献报道,与ERβ相比,ERα在激活促增殖相关基因转录上作用明显,而ERβ在抑制相关基因转录上活性更强[14, 15];而丹参酮IIA可升高ERα/ERβ比值,故推测其发挥抗癌效应还有其他的作用靶点和相关途径的参与。
如前所述,已有研究证实,多种能够与经典ER结合的化合物也可结合、活化GPER,而且GPER在多种雌激素相关肿瘤的发生及演变中发挥了重要介导作用,GPER也成为了特异性雌激素相关肿瘤细胞抗肿瘤药物的候选新靶标。本实验结果显示:丹参酮IIA对T47D细胞的增殖抑制作用可被GPER激动剂减弱、被GPER抑制剂增强,说明GPER可介导丹参酮IIA抗T47D细胞增殖作用,而且GPER活性与丹参酮IIA的抗增殖活性成负相关。同时,从Wester blot结果中可见,丹参酮IIA还具有降低GPER表达量,即GPER表达调节功能,这与某些既往研究结果具有一致性。例如,有研究发现TAM的活性代谢产物4-OHT(4-hydroxytamoxifen)可通过GPER途径上调子宫内膜癌Ishikawa和HEC1A细胞的c-fos表达、促进两种细胞的增殖;而拮抗GPR30的作用可导致OHT促增殖作用的消失[16, 17]。Filardo等[18]曾发现,在乳腺癌细胞GPER有过量表达且表达量与肿瘤大小成正比。Smith等[19]也发现子宫内膜癌细胞中有GPER过量表达,而且表达量与癌症的严重程度呈正相关,患者生存率随着GPER的超量表达明显降低。本研究中基因沉默实验结果也进一步证实,GPER表达减少可致丹参酮IIA抗T47D细胞增殖活性增强。Chevalier等[20]在2012年也曾报道,GPER基因沉默可致其介导的人精原细胞癌增殖效应受到明显抑制。Scaling等[21]在2014年也曾发现G1诱导的MCF10A乳腺癌细胞增殖活性可因GPER基因沉默而明显降低。
另有报道也证实[22]:GPER对于甲状腺癌等雌激素相关内分泌系统肿瘤的治疗具有重要应用价值,特别是应用于ER阴性、GPER阳性的病例。因此,针对GPER蛋白的研究对于解析疾病的发生、发展并据此进行患者的个体化治疗和预后均具有重要意义。与上述实验结果和分析一致,本项研究不但表明丹参酮IIA可以通过GPER途径抑制T47D乳腺癌细胞增殖,而且还可通过降低GPER表达水平进一步促进其抑癌效应。
针对靶向经典雌激素受体治疗中遇到的组织选择性或特异性问题,以及在某些治疗中存在的抗药性问题,目前也迫切需要寻找更好的作用靶点和更广泛而有效的治疗策略来抑制乳腺癌细胞中的雌激素信号转导体系。随着对GPER的深入研究和认识,以GPER作为靶标,为乳腺癌治疗提供了新的重要切入点。同时,综合本研究结论及课题组先期研究成果,提示靶细胞内ERα、ERβ含量及比值的变化必须与GPER的改变情况及其介导效应综合考虑,才能对雌激素样活性调节成分影响细胞增殖、发挥雌激素样效应的最终结果、趋势和程度进行较为全面的分析和预测,为临床妇科肿瘤的治疗提供更加可靠的实验依据。
(致谢:本文实验在北京中医药大学基础医学院细胞生物化学实验室完成,谨此致谢!)
| [1] | Moriarty K, Kim K H, Bender J R. Minireview:estrogen receptor-mediated rapid signaling[J]. Endocrinology, 2006,147(12):5557-63. |
| [2] | Byer S J, Eckert J M, Brossier N M, et al. Tamoxifen inhibits malignant peripheral nerve sheath tumor growth in an estrogen receptor-independent manner[J]. Neuro Oncol, 2011,13(1):28-41. |
| [3] | Revankar C M, Cimino D F, Sklar L A, et al. A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J]. Science, 2005,307(5715):1625-30. |
| [4] | O'Dowd B F, Nguyen T, Marchese A, et al. Discovery of three novel G-protein-coupled receptor genes[J]. Genomics, 1998,47(2):310-3. |
| [5] | Carmeci C, Thompson D A, Ring H Z, et al. Identification of a gene (GPR30) with homology to the G-protein-coupled receptor superfamily associated with estrogen receptor expression in breast cancer[J]. Genomics, 1997,45(3):607-17. |
| [6] | Takada Y, Kato C, Kondo S, et al. Cloning of cDNAs encoding G protein-coupled receptor expressed in human endothelial cells exposed to fluid shear stress[J]. Biochem Biophys Res Commun, 1997,240(3):737-41. |
| [7] | Ariazi E A, Brailoiu E, Yerrum S, et al. The G protein-coupled receptor GPR30 inhibits proliferation of estrogen receptor-positive breast cancer cells[J]. Cancer Res, 2010,70(3):1184-94. |
| [8] | Prossnitz E R, Barton M. Signaling, physiological functions and clinical relevance of the G protein-coupled estrogen receptor GPER[J]. Prostaglandins Other Lipid Mediat, 2009,89(3-4):89-97. |
| [9] | Prossnitz E R, Sklar L A, Oprea T I, et al. GPR30:a novel therapeutic target in estrogen-related disease[J]. Trends Pharmacol Sci, 2008,29(3):116-23. |
| [10] |
赵丕文, 牛建昭, 王继峰, 等. 丹参酮IIA抗乳腺癌细胞增殖作用研究[J]. 中国药理学通报, 2010,26(7):903-6. Zhao P W, Niu J Z, Wang J F, et al. Research on the inhibitory effect of Tanshinone IIA on breast cancercell proliferation[J]. Chin Pharmacol Bull, 2010,26(7):903-6. |
| [11] |
赵丕文, David Yue-Wei Lee, 陶仕英, 等. G蛋白偶联雌激素受体在雌激素相关肿瘤发生中的作用[J]. 中国药理学通报, 2014,30(8):1037-41. Zhao P W, Lee DY, Tao S Y, et al. Effect of G protein-coupled estrogen receptor on the occurrence and development of estrogen related cancer[J]. Chin Pharmacol Bull, 2014,30(8):1037-41. |
| [12] |
蔡丽萍, 习志刚, 杨 红. 丹参酮的药理作用和临床研究进展[J]. 广东药学院学报, 2008,24(3):321-4. Cai L P, Xi Z G, Yang H.Progress in pharmacological action and clinical research of Salvia miltiorrhiza[J]. Acad J Guangdong Coll Pharm, 2008,24(3):321-4. |
| [13] |
许旭东, 胡晓茹, 杨峻山. 抗肿瘤药用植物有效成分研究概况[J]. 中国中药杂志, 2008,33(17):2073-81. Xu X D, Hu X R, Yang J S. Review of studies on active components of antitumor medicinal plants[J]. Chin J Chin Mater Med, 2008,33(17):2073-81. |
| [14] | An J, Ribeiro R C, Webb P, et al. Estradiol repression of tumor necrosis factor-alpha transcription requires estrogen receptor activation function-2 and is enhanced by coactivators[J]. Proc Natl Acad Sci USA, 1999,96(26):15161-6. |
| [15] | Seo H S, Denardo D G, Jacquot Y,et al. Stimulatory effect of genistein and apigenin on the growth of breast cancer cells correlates with their ability to activate ER alpha[J]. Breast Cancer Res Treat, 2006,99(2):121-34. |
| [16] | Vivacqua A, Bonofiglio D, Recchia A G, et al. The G protein-coupled receptor GPR30 mediates the proliferative effects induced by 17beta-estradiol and hydroxytamoxifen in endometrial cancer cells[J]. Mol Endocrinol, 2006,20(3):631-46. |
| [17] | Du G Q, Zhou L, Chen X Y, et al. The G protein-coupled receptor GPR30 mediates the proliferative and invasive effects induced by hydroxytamoxifen in endometrial cancer cells[J]. Biochem Biophys Res Commun, 2012,420(2):343-9. |
| [18] | Filardo E J, Graeber C T, Quinn J A, et al. Distribution of GPR30, a seven membrane-spanning estrogen receptor, in primary breast cancer and its association with clinico-pathologic determinants of tumor progression[J]. Clin Cancer Res, 2006,12(21):6359-66. |
| [19] | Smith H O, Leslie K K, Singh M, et al. GPR30:a novel indicator of poor survival for endometrial carcinoma[J]. Am J Obstet Gynecol, 2007,196(386):e381-9. |
| [20] | Chevalier N,Vega A,Bouskine A,et al. GPR30, the non-classical membrane G protein related estrogen receptor, is over expressed in Human Seminoma and promotes Seminoma cell proliferation[J]. PLoS One, 2012,7(4):e34672. |
| [21] | Scaling A L, Prossnitz E R, Hathaway H J. GPER mediates estrogen-induced signaling and proliferations in human breast epithelial cells, and normal and malignant breast[J]. Horm Cancer, 2014,5(3):146-60. |
| [22] |
吴婷婷, 龙方懿, 贾朝莉, 等. G蛋白偶联受体在雌激素诱导人甲状腺未分化癌FRO细胞增殖中的作用及其机制[J]. 第三军医大学报, 2011,33(2):164-8. Wu T T, Long F Y, Jia C L, et al. G-protein coupled receptor improves 17β-Estradiol induced proliferation of human anaplastic thyroid carcinoma FRO cells[J]. Acta Acad Med Mil Tert, 2011,33(2):164-8. |

