


2. 蚌埠医学院第一附属医院核医学科, 安徽 蚌埠 233004;
3. 安徽医科大学第一附属医院核医学科, 安徽 合肥 230022
刘斌(1962-),男,硕士,主任医师,教授,博士生导师,研究方向:影像诊断,通讯作者,E-mail:lbhyz321@126.com
2. Dept of Nuclear Medicine, the First Affiliated Hospital of Bengbu Medical College, Bengbu Anhui 233004, China;
3. Dept of Nuclear Medicine, the First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
肿瘤细胞的多药耐药(multidrug resistance,MDR)现象是导致化疗失败的主要原因,如何逆转MDR现象以及寻找合适的逆转剂是目前研究的热点。MDR现象具有广谱耐药特性,能够对许多结构、功能各异的细胞毒性药物产生交叉抵抗。MDR的机制较为复杂,涉及DNA修复缺陷、相关转运蛋白表达增强、凋亡逃避、药物靶点改变、细胞黏附等多种因素[1]。目前认为,ABC(ATP-binding cassette)转运蛋白家族是介导肿瘤细胞多药耐药的最主要机制[2]。相关蛋白包括P糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance-associated proteins,MRP)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等。
99m锝-甲氧基异丁基异腈(99mtechnetium- methoxyisobutylisonitrile,99mTc-MIBI)常用在核心脏病学中,以及乳腺癌、肺癌、甲状腺癌、淋巴瘤等恶性肿瘤的探测。99mTc-MIBI是一种脂溶性阳离子放射性药物,能够通过被动扩散进入细胞膜,并以膜电位差为动力浓聚于线粒体内膜。恶性肿瘤细胞因代谢旺盛、线粒体丰富、具有较高的负跨膜电势能够大量摄取。此外,99mTc-MIBI的摄取及清除与肿瘤细胞的MDR现象有关。文献报道99mTc-MIBI能够用来检测肿瘤细胞的耐药情况,99mTc-MIBI在肿瘤细胞内的动力学变化可以评价MDR现象[3] 。
2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)因具有抗肿瘤作用而被广泛关注。2-DG不仅能够抑制肿瘤糖酵解、影响蛋白质糖基化、抑制肿瘤细胞增殖、诱导凋亡,并且具有放、化疗增敏作用[4] 。但2-DG作为MDR现象的逆转剂却鲜见报道,本研究通过观察99mTc-MIBI在肿瘤细胞内摄取清除变化检测肿瘤细胞的多药耐药现象以及评价2-DG对于HNE-1/DDP细胞多药耐药的逆转效果,探讨其逆转机制为临床提高辅助化疗疗效提供理论依据。
1 材料与方法 1.1 材料HNE-1细胞(鼻咽低分化鳞癌)及HNE-1/DDP耐药株由湖南湘雅医院提供。RPMI 1640培养液、胰蛋白酶(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),2-DG、DDP、P-gp及MRP检测试剂盒(美国Sigma公司),ATP检测试剂盒(碧云天生物技术研究所),鼠抗人MRP及β-actin单抗(美国Santa Cruz公司),鼠抗人P-gp单抗(美国Millipore公司)。流式细胞仪Accuri C6(美国BD公司)、GC-300 γ 计数器(科大创新中佳分公司)、Mini-Prote电泳仪及凝胶成像系统(美国Bio-Rad公司)。MIBI配体(北京师宏药业提供)用新淋洗的99mTcO4洗脱液标记,放射化学纯度 ≥95%。
1.2 细胞培养常规复苏HNE-1细胞及HNE-1/DDP耐药株细胞,HNE-1细胞使用含10%胎牛血清的RPMI 1640 培养液,HNE-1/DDP耐药株细胞使用RPMI 1640 培养液+DDP(50 μg·L-1),置于37 ℃、CO2体积分数为5%的饱和湿度培养箱中培养,隔天换液,细胞生长至融合状态时,用0.25%的胰酶消化传代。
1.3 不同浓度2-DG条件下HNE-1/DDP细胞对99mTc-MIBI摄取清除实验含10%胎牛血清+DDP(50 μg·L-1)的RPMI 1640 培养液调整HNE-1/DDP细胞浓度为每孔7×103个细胞,以每孔100 μL接种于2组96孔板中,培育24 h,细胞贴壁后弃去上清液,加入终浓度分别为1、2、5、10、20 mmol·L-1的2-DG的培养液100 μL,继续培育2 h。然后加入含有99mTc-MIBI(放射性浓度370 MBq·L-1)的培养液100 μL,培育20 min(早期)及120 min(延迟)后分别取出一组96孔板,弃去含有99mTc-MIBI的培养液,用4℃冰生理盐水快速清洗3次,加入含0.25% 的胰酶消化收集细胞,以1 100 r·min-1离心5 min,弃去上清液,用冰PBS液洗涤后重复离心,共计2遍,最后得到沉淀细胞使用γ计数器检测其放射性。每个时间点及各浓度组均设3个重复孔,设3个对照孔(接种等量细胞及培养液,不加2-DG),并设3个空白孔(不接种细胞,只加入等量培养液)作为本底,结果取平均值。按下述公式计算99mTc-MIBI摄取清除率:清除率/%=(早期99mTc-MIBI放射性计数-延迟99mTc-MIBI放射性计数)/早期99mTc-MIBI放射性计数×100%。
1.4 HNE-1及HNE-1/DDP细胞对99mTc-MIBI摄取清除实验上述实验证实加入终浓度为10 mmol·L-1的2-DG作用后HNE-1/DDP细胞对99mTc-MIBI的清除率最低,因此本组以10 mmol·L-1为实验条件以验证2-DG对HNE-1及HNE-1/DDP细胞的作用。用RPMI 1640 培养液和RPMI 1640+DDP培养液分别调整HNE-1和HNE-1/DDP细胞浓度为每孔104个细胞,以每孔100 μL接种于2组96孔板中培育24h,细胞贴壁后弃去上清液,将HNE-1和HNE-1/DDP细胞分为2组,一组为对照组加入培养液100 μL(不含2-DG),另一组为实验组加入含终浓度为10 mmol·L-1 2-DG的培养液100 μL,继续培养2 h,再按前实验方法检测加入99mTc-MIBI后HNE-1及HNE-1/DDP细胞在20 min(早期)及120 min(延迟)的摄取清除情况。每实验点均设重复孔3组,并设对照孔及空白孔各3组。
1.5 细胞内ATP检测将HNE-1/DDP细胞接种于6孔板中(每孔4×105个细胞)培养24 h,加入含2-DG(10 mmol·L-1)培养液并设阴性对照组,每组3个复孔。继续培育5 h后收集细胞,离心后弃上清液,每孔细胞加入200 μL裂解液。裂解后4℃ 12 000 r·min-1离心5 min,取上清用于后续测定(冰上操作)。在检测孔中加入ATP检测工作液(1 ∶ 100),每孔100 μL,室温放置5 min,使本底性ATP全部消耗(避光操作)。每孔加100 μL样品及标准品,迅速混匀,2 s后立即用酶标仪检测Rlu值。
1.6 Western blot 检测P-gp、MRP蛋白表达HNE-1/DDP细胞接种于6孔板中(每孔5×105个细胞)培养24 h,加入2-DG(10 mmol·L-1)后继续培养16 h,消化收集细胞,用预冷PBS洗2次,加入预冷的蛋白裂解液(20 mmol·L-1 Tris-HCl pH 7.5,150 mmol·L-1 NaCl,1 mmol·L-1 EDTA,1 mmol·L-1 EGTA,1 mmol·L-1原矾酸钠,1 mmol·L-1 PMSF,体积分数为1%的Triton X-100,2.5 mmol·L-1焦磷酸钠,40 mmol·L-1 β-甘油磷酸,10 mg·L-1的亮肽素、抑肽酶和大豆胰蛋白酶抑制剂),冰上裂解30 min,提取细胞总蛋白,BCA 蛋白定量法测定各组蛋白浓度,用细胞裂解液将各组蛋白稀释至等浓度,与2×上样缓冲液1 ∶ 1混合,95℃煮沸5 min 蛋白变性,每组取50 μg蛋白,SDS-PAGE电泳(70 V,400 mA,50 W,30 min; 90 V,400 mA,50 W,90 min);转膜(50 V,250 mA,50 W,150 min)至PVDF膜; 5%脱脂牛奶室温封闭4 h; 一抗室温孵育4℃过夜;TPBS 洗膜3次/5 min;二抗室温孵育2 h; TPBS 洗膜3次/5 min; ECL 发光试剂盒显影;Bio-Rad 凝胶成像系统获取图像。
1.7 溴化丙啶(PI)染色检测HNE-1/DDP细胞的凋亡情况将HNE-1/DDP细胞接种于12孔板中(每孔1.5×105个细胞)培养24 h,分别加入DDP(1.5 mg·L-1)、2-DG(10 mmol·L-1)以及DDP+2-DG,并设阴性对照组,继续培养24 h后消化收集细胞,1 000 r·min-1离心5 min,弃去培养液,1 mL PBS洗涤1次,离心去PBS,加入冰预冷的75%的乙醇固定,4℃过夜,离心弃去固定液,1 mL PBS重悬5 min,1 000 r·min-1离心5 min后弃去PBS,用600 μL PI染液染色,4℃避光2~4 h后上机检测。实验重复3次。
1.8 统计学方法数据以 ± s表示,两组之间的比较采用Mann-Whitney检验,多组之间比较采用单因素方差分析。
± s表示,两组之间的比较采用Mann-Whitney检验,多组之间比较采用单因素方差分析。
通过γ计数器检测后结果显示(Tab1),20 min时(早期)不同浓度的2-DG作用下HNE-1/DDP细胞对99mTc-MIBI摄取的cpm值差异无统计学意义(P < 0.01),120 min时(延迟)1、2、5、10、20 mmol·L-1浓度组的HNE-1/DDP细胞摄取的cpm值与对照组(0浓度组)cpm值比较,差异有统计学意义(P < 0.01)。计算清除率后结果表明,随着2-DG浓度的升高,99mTc-MIBI的清除率呈降低趋势,且2-DG浓度为10 mmol·L-1时,清除率达到最低。此外2-DG浓度为20 mmol·L-1时,并没有继续降低其清除率。因此,选择10 mmol·L-1为条件进行后续实验。
( ± s, n=3) ± s, n=3) |
 |
实验结果显示(Tab2),对照组及实验组HNE-1、HNE-1/DDP细胞在20 min时(早期)对99mTc-MIBI摄取的cpm值均无明显差异(P=0.87,P=0.95)。120 min时(延迟)对照组中HNE-1/DDP细胞的cpm值明显低于HNE-1细胞(P=0.001),说明该细胞对99mTc-MIBI具有较强的 “泵出”作用。2-DG(10 mmol·L-1)作用120 min后(延迟)实验组HNE-1/DDP细胞的cpm值高于HNE-1细胞(P=0.03)及对照组HNE-1/DDP细胞(P=0.003),显示出2-DG作用后该细胞增强了对99mTc-MIBI的滞留作用。清除率结果也表明,对照组HNE-1/DDP细胞对 99mTc-MIBI的清除率为54.8%,高于HNE-1细胞的清除率-41.3%(P < 0.01),2-DG作用后实验组HNE-1/DDP细胞的清除率为-203.7%,较前明显降低(P < 0.01)。实验结果表明,2-DG可以提高HNE-1/DDP细胞对99mTc-MIBI的摄取,使其清除率处于低值,表现出较明显的增强99mTc-MIBI在细胞内滞留的作用;此现象在 HNE-1敏感株细胞中表现不明显,其摄取值在2-DG作用前后无明显差异(P=0.23)。
( ± s, n=3) ± s, n=3) |
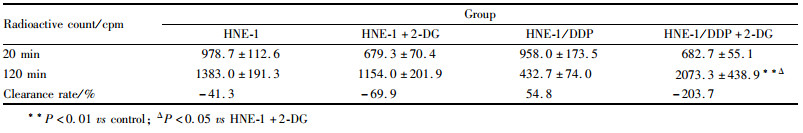 |
视对照组细胞 ATP 生成量为 100%,实验组数据除以对照组后结果为55.69%,结果见Fig1。经 2-DG作用下HNE-1/DDP细胞中 ATP 生成量明显少于对照组,表明2-DG 能够抑制HNE-1/DDP细胞内ATP的生成。
|
| Fig 1 ATP levels in HNE-1/DDP cell after treated with 2-DG(10 mmol·L-1) |
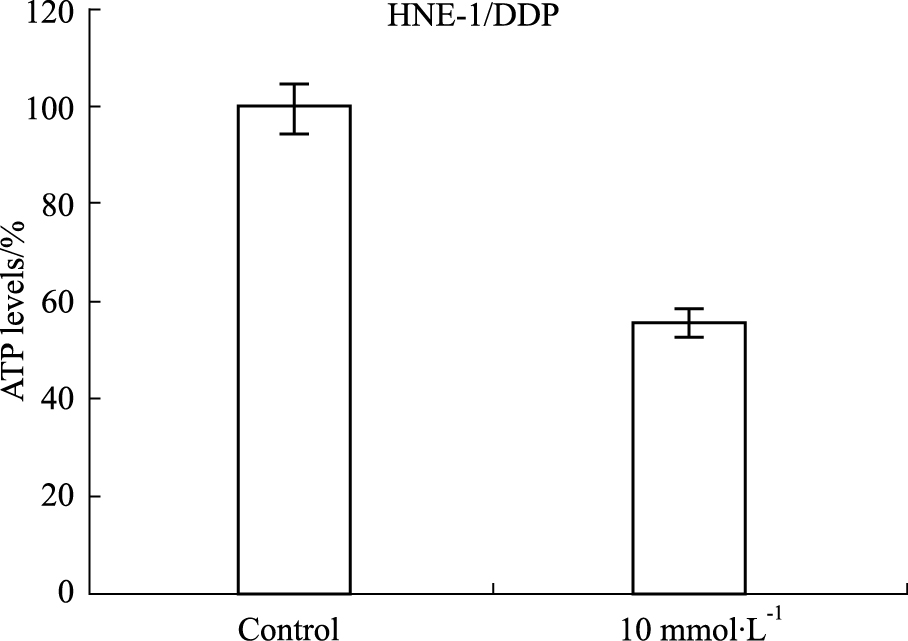
HNE-1/DDP细胞在2-DG作用16 h后收集蛋白,Western blot 检测P-gp、MRP蛋白表达,结果见Fig2。2-DG作用后HNE-1/DDP细胞P-gp、MRP蛋白表达与对照组相比有所降低。
|
| Fig 2 Effect of 2-DG on protein expression of P-gp,MRP in HNE-1/DDP cell |
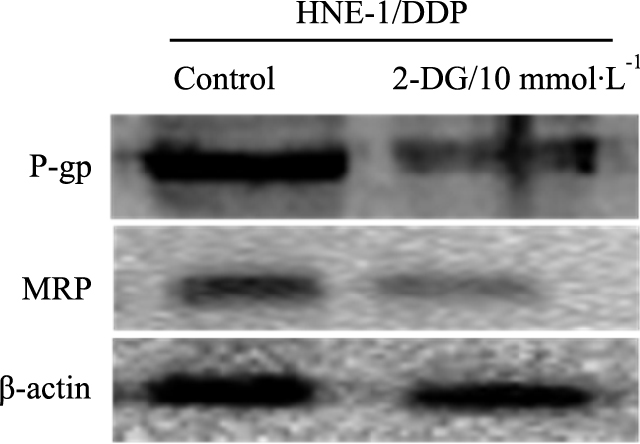
不同因素处理后的细胞进行PI染色并流式细胞仪分析,结果提示,对照组及2-DG组24 h细胞凋亡率分别为5.9%、6.4%。DDP联合2-DG作用24 h后HNE-1/DDP细胞凋亡率为49.4%,高于单独使用DDP时诱导HNE-1/DDP细胞的凋亡率22.5%,见Fig3。
|
| Fig 3 Relative cell number of HNE-1/DDP apoptosis after treated with 2-DG, DDP and 2-DG combination with DDP |
2-DG的抗肿瘤作用在国内外研究较多,主要涉及靶向糖酵解途径以“饿死”肿瘤细胞、影响细胞内信号通路、抑制蛋白糖基化等方式诱导肿瘤细胞凋亡、增强化疗药物或联合肿瘤坏死因子凋亡诱导配体通过诱导内质网应激、下调抑制细胞凋亡蛋白、抑制肿瘤生长因子等途径达到促进肿瘤细胞凋亡的作用[5, 6]。但上述方案可能会引起肿瘤细胞代谢途径变化、诱导时间过长、大剂量限值造成不良反应等问题,以至于2-DG临床使用受限[7]。本研究通过检测99mTc-MIBI在细胞内的动力学变化,验证2-DG作为逆转剂应用后能否逆转肿瘤细胞MDR现象及增强化疗疗效的作用。
99mTc-MIBI被证实在肿瘤细胞内能够作为P-gp及MRP 的转运底物,可以像化疗药物一样被泵出细胞外[8, 9]。本研究发现,99mTc-MIBI在耐药株HNE-1/DDP细胞内的清除率明显高于敏感株HNE-1细胞,且HNE-1/DDP细胞延迟期对99mTc-MIBI摄取的cpm值明显低于早期摄取值,表明肿瘤细胞对99mTc-MIBI具有“泵出”作用,使其不能滞留于细胞内,上述现象的发生可能与耐药株细胞P-gp及MRP等相关转运蛋白的功能有关。因此,99mTc-MIBI在肿瘤耐药细胞内的动力学变化可以评价相关转运蛋白的功能。应用2-DG处理后,发现99mTc-MIBI在HNE-1/DDP细胞内的摄取值明显高于未用2-DG处理的对照组,证实2-DG能够增强99mTc-MIBI在耐药株细胞内的滞留,使其对99mTc-MIBI的“泵出”作用明显减弱。此现象在相关转运蛋白表达较少的敏感株细胞内表现不明显,其摄取值在2-DG处理后差异无显著性(P < 0.01)。因此,2-DG 对P-gp及MRP等相关转运蛋白功能的影响可能是造成99mTc-MIBI在细胞内动力学改变的原因。
依赖ABC转运蛋白家族成员介导的药物外排是肿瘤MDR现象发生的主要机制。此类蛋白共同特点是具有ATP结合域,通过水解ATP获得能量将药物泵出细胞。肿瘤细胞具有高葡萄糖消耗及糖酵解增强的特点,2-DG作为天然葡萄糖的类似物可以被肿瘤细胞高度摄取,通过己糖激酶代谢为6-磷酸-2-脱氧葡萄糖后不能进一步代谢氧化,滞留于肿瘤细胞内的同时消耗大量己糖激酶,造成细胞内“ATP”生成减少,导致细胞内能量缺失[10]。本研究中,ATP检测结果显示,2-DG作用下HNE-1/DDP细胞内ATP值明显低于对照组,Western blot 检测证实2-DG作用下P-gp、MRP蛋白表达量较对照组有所减少,结合99mTc-MIBI细胞内摄取清除实验结果,推测 2-DG可能是通过抑制肿瘤细胞内ATP生成、减少相关转运蛋白的表达,进而抑制P-gp及MRP蛋白的“泵出”功能,增强其转运底物99mTc-MIBI在细胞内滞留。有文献报道,99mTc-MIBI能够用于检测肿瘤细胞多药耐药及评价逆转剂的逆转效果,同 时99mTc-MIBI显像也可用于检测体内肿瘤MDR现象及评价肿瘤化疗疗效[3, 11, 12]。本研究通过99mTc-MIBI在细胞内动力学变化,证实2-DG作用后HNE-1/DDP细胞内对99mTc-MIBI的滞留作用明显增强,说明2-DG对该细胞表现出明显的逆转效果,并以此推论,同是P-gp及MRP转运底物的一些化疗药物在2-DG的作用下,可以提高细胞内的药物浓度,增强化疗疗效。此外,前实验也证实随着2-DG浓度逐渐升高,99mTc-MIBI在细胞内的清除率呈降低趋势,但浓度为20 mmol·L-1时,并没有继续降低其清除率,说明2-DG浓度进一步升高不能持续增强99mTc-MIBI在细胞内的滞留作用,原因可能与肿瘤细胞内转运蛋白数量或2-DG对肿瘤细胞ATP生成抑制达到限值相关,提示2-DG在较低剂量即可达到理想的逆转效果。
鼻咽癌因发病隐蔽多数患者就诊时处于晚期,采用单纯放疗其5年生存率约10~40%[13],因此对晚期鼻咽癌患者多采取同期放疗加辅助化疗[14]。临床应用顺铂联合紫衫醇类、氟尿嘧啶、吉西他滨等药物证实对晚期鼻咽癌患者有效[15]。然而因MDR现象的存在,使病情不能持续缓解,往往会导致治疗失败。本研究进一步借助溴化丙啶(PI)染色实验检测不同因素处理后HNE-1/DDP细胞的凋亡情况,验证2-DG作为逆转剂联合化疗药物对肿瘤细胞的杀伤效果。实验结果显示DDP联合2-DG处理后HNE-1/DDP细胞凋亡率高于其他对照组。目前为止,寻找合适的逆转剂一直是研究热点。2-DG作为肿瘤多药耐药的逆转剂具有以下优势:(1)大多数恶性肿瘤对2-DG大量摄取。18氟-脱氧葡萄糖(18F-DG) PET显像证实大多数恶性肿瘤能够大量摄取并滞留18F-DG[16]。(2)2-DG逆转效果明确、作用迅速,实验证实2-DG 作用240 min后即可明显提高99mTc-MIBI细胞内的摄取值,降低清除率。(3)2-DG为葡萄糖的无毒类似物,体内代谢较快,不会造成体内蓄积[7]。(4)逆转作用广泛,有可能对大多数依赖ABC转运蛋白底物药物均可产生逆转作用(需后续实验验证)。(5)2-DG本身具有抗肿瘤的协同作用。
综上所述,利用 99mTc-MIBI细胞内摄取清除实验检测肿瘤细胞MDR现象以及逆转剂介入后效果评价,发现2-DG对HNE-1/DDP细胞表现出明显的逆转效果,其机制可能与细胞内ATP生成抑制及相关转运蛋白表达减少有关。2-DG作为逆转剂,具有肿瘤细胞高摄取、无毒等优势,联合化疗药物可增强肿瘤细胞的杀伤效果。此外,99mTc-MIBI显像已用于体内肿瘤多药耐药的检测及疗效评价,可通过小鼠或体内实验进一步验证2-DG的逆转效果。
(致谢:本文实验通过蚌埠医学院核医学实验室、蚌埠医学院科研中心及生化药理实验室共同完成,在此表示由衷的感谢。)
| [1] | Sodani K, Patel A, Kathawala R J, et al. Multidrug resistance associated proteins in multidrug resistance[J]. Chin J Cancer, 2012, 31 (2):58-72. |
| [2] | Szakács G, Paterson J K, Ludwig J A, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov, 2006, 5 (3):219-34. |
| [3] | 王恩成, 孙晓光, 刘建军, 等. 99m锝-甲氧基异丁基异腈在人肺癌细胞中的摄取与肺癌细胞耐药间的关系及二氯乙酸盐对肺癌细胞耐药的影响[J]. 肿瘤, 2011, 31 (4):294-8.Wang E C, Sun X G, Liu J J, et al. The uptake of 99mTc-methoxyisobutylisonitrile in human lung adenocarcinoma cells is associated with changes of cellular drug resistance induced by dichloroacetate[J]. Tumor, 2011, 31 (4):294-8. |
| [4] | Gupta S, Farooque A, Adhikari J S, et al. Enhancement of radiation and chemotherapeutic drug responses by 2-deoxy-D-glucose in animal tumors[J]. J Cancer Res Ther, 2009, 5 (Suppl 1):16-20. |
| [5] | 程 秀, 刘 浩, 方 琳, 等. 2-DG增强乳腺癌细胞对阿霉素化疗敏感性的作用[J]. 中国药理学通报, 2010, 26 (10):1371-6.Cheng X, Liu H, Fang L, et al. 2-DG enhances chemosensitivity of breast cancer cells to adriamycin[J]. Chin Pharmacol Bull, 2010, 26 (10):1371-6. |
| [6] | 黄莹莹, 刘 浩, 李 阳, 等. 2-DG增强TRAIL诱导鼻咽癌细胞凋亡的敏感性作用[J].中国药理学通报, 2013, 29 (8):1119-24.Huang Y Y, Liu H, Li Y, et al. 2-DG sensitizes nasopharyngeal carcinoma cells to TRAIL induced apoptosis[J]. Chin Pharmacol Bull, 2013, 29 (8):1119-24. |
| [7] | 程 遥, 刁冬梅, 宋永春,等. 2-脱氧葡萄糖在抗肿瘤领域的研究进展[J].中国肿瘤临床, 2012, 39 (17):1325-8.Cheng Y, Diao D M, Song Y C, et al. Current researeh on 2-deoxyglueose in anti-cancer treatmen[J]. Chin J Clin Oncol, 2012, 39 (17):1325-8. |
| [8] | Piwnica-Worms D, Rao V V, Kronauqe J F, et al. Characterization of multidrug resistance P-glycoprotein transport function with an organotechnetium cation[J]. Biochemistry, 1995, 34 (38):12210-20. |
| [9] | Hendrikse N H, Franssen E J, van der Graaf W T, et al. 99mTc-sestamibi is a substrate for P-glycoprotein and the multidrug resistance-associated protein[J]. Br J Cancer, 1998, 77 (3):353-8. |
| [10] | Hernlund E, Ihrlund L S, Khan O, et al. Potentiation of chemotherapeutic drugs by energy metabolism inhibitors 2-deoxyglucose and etomoxir[J]. Int J Cancer, 2008, 123 (2):476-83. |
| [11] | 杜承润, 应红梅, 程竞仪, 等. 双时相99mTc-MIBI SPECT/CT显像预测局部晚期鼻咽癌对含多西他赛新辅助化疗敏感性的价值[J]. 中国癌症杂志, 2013, 33 (10):834-40.Du C R, Ying H M, Cheng J Y, et al. The role of 99mTc-MIBI SPECT/CT in predicting response to neoadjuvant chemotherapy with docetaxel-based regimen for locoregionally advanced nasopharyngeal carcinoma[J]. China Oncol, 2013, 33 (10):834-40. |
| [12] | Mendes F, Paulo A, Santos I. Metalloprobes for functional monitoring of tumour multidrug resistance by nuclear imaging[J]. Dalton Trans, 2011, 40 (20):5377-93. |
| [13] | Chen C, Wang F, Wang Z, et al. Polymorphisms in ERCC1 C8092A predict progression-free survival in etastatic/recurrent nasopharyngeal carcinoma treated with cisplatin-based chemotherapy[J]. Cancer Chemother Pharmacol, 2013, 72 (2):315-22. |
| [14] | Lee A W, Tung S Y, Chua D T, et al. Randomized trial of radiotherapy plus concurrent-adjuvant chemotherapy vs radiotherapy alone for regionally advanced nasopharyngeal carcinoma[J]. J Natl Cancer Inst, 2010, 102 (15):1188-98. |
| [15] | Vermorken J B, Remenar E, Van Herpen C, et al. Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer[J]. N Engl J Med, 2007, 357 (17):1695-704. |
| [16] | 谢红军, 宋文忠, 刘 浩, 等. 18F-FDG PET/CT双时相显像在肿瘤诊断中的价值[J]. 四川医学, 2015, 36 (3):407-10.Xie H J, Song W Z, Liu H, et al. The value of dual-phase 18F-FDG PET/CT in diagnosing malignant tumor[J]. Sichuan Med, 2015, 36 (3):407-10. |

