


2. 滨州医学院, 山东 烟台 264005
2. Binzhou Medical University, Yantai Shandong 264005, China
人类黑色素瘤尤其是恶性黑色素瘤,是一种明显抗化疗的高转移性肿瘤[1]。经过数十年的治疗与研究,尽管黑色素瘤病人的存活率得到很大提高,但黑色素瘤的发病危险系数与总体死亡率依旧逐年上升,每年增长率为3%~5%,尤其在成人原发性肿瘤中增加更快。因此,寻找高效低毒的中药来改变肿瘤的生物学行为已成为肿瘤治疗的重要策略。
异甘草素(isoliquiritigenin,ISL)(结构式见Fig1)是一种异黄酮类化合物,是甘草中重要的活性成分之一,为黄色针状结晶,难溶于水,具有多种药理活性,诸如抗肿瘤、抗病毒、抗自由基、松弛血管、抑制脂质过氧化等[2]。其中抗肿瘤作用是近年来的研究热点[3]。本实验选用A375细胞来源于转移性人皮肤黑色素瘤,生长特性为贴壁生长,主要目的在于研究异甘草素诱导人黑色素瘤(A375)细胞凋亡及抑制其增殖的机制,为进一步阐明异甘草素对黑色素瘤治疗机制研究提供更多实验依据。

|
| Fig 1 Chemical structure of isoliquiritigenin |
人黑色素瘤细胞A375,购自中国科学院细胞库。
1.2 主要药物及试剂异甘草素(纯度98%),江西本草天工科技有限公司;胰蛋白酶,美国Sigma公司,批号509D043;胎牛血清,杭州四季青生物工程材料有限公司,批号 140710;DMEM细胞培养基,GIBCO公司,批号 1458511;二甲基亚砜(DMSO),批号20140605,磺基罗丹明B,吖啶橙/溴化乙啶,Hoechst 33258均为美国Sigma公司产品;AnnexinV/FITC凋亡检测试剂盒,南京凯基生物科技发展有限公司,批号 20140614,ATP,批号A095,乳酸 批号A019-2,均为南京建成生物公司研究所产品,葡萄糖试剂盒,北京普利莱基因技术有限公司,批号 E1010。
1.3 主要仪器CO2细胞培养箱(Thermo 3131),美国Thermo公司;超净工作台(ZHJH-1112B),上海智诚分析仪器有限公司;倒置荧光显微镜(MIC00266),德国ZEISS公司;倒置生物显微镜(BDS200-PH),重庆奥特光学仪器有限公司;多功能酶标仪(Thermo 3001),美国Thermo公司;离心机(TGL 16 M);美国Thermo;电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;超低温冰箱,美国Thermo公司;流式细胞仪,美国BD公司。
2 方法 2.1 细胞培养取生长状态良好细胞A375,用含10% 胎牛血清、青霉素(终浓度100 kU·L-1)及链霉素(终浓度100 mg·L-1)的DMEM培养液(pH=7.5)在37 ℃、5 % CO2饱合湿度的培养箱中培养,取对数生长期细胞进行各项实验。
2.2 异甘草素对细胞抑制率的测采用SRB法测定异甘草素对细胞生长抑制效应。取对数生长期的A375细胞,按每孔1×105个接种于96细胞培养板中,每孔100 μL,24 h后分别加0、10、20、40、60、80、100 μmol·L-1的异甘草素,于细胞培养箱 37℃培养48 h。细胞培养结束后,取出培养板,在每孔液面上加入50%(质量/体积)的三氯乙酸(TCA)50 μL固定细胞,TCA的终浓度为10%,然后在4℃冰箱中放置1 h。培养板各孔用去离子水洗涤5遍,以去除TCA。在空气中干燥后,每孔加0.4%的SRB 100 μL,室温下放置20 min,弃去各孔内液体(回收)后用1%乙酸洗涤5遍,去除未结合的染料,空气中干燥后用DMSO(二甲基亚砜)150 μL溶解,在平板振荡器上振荡5 min,Thermo 3001多功能酶标仪OD490 nm测量各孔的吸光值[4]。按下式计算药物对细胞增殖的抑制率:
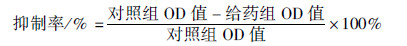
根据药物浓度对应细胞增殖抑制率作线性回归,根据直线方程计算药物对细胞增殖的半数抑制浓度(IC50)。
2.3 倒置显微镜观察异甘草素作用后A375细胞的形态取对数生长期A375细胞,在超净工作台上,用吸管吹打细胞瓶壁,制成细胞悬液,细胞计数并调整细胞悬液的浓度为2×105个接种在6孔板上,每孔加2 mL,置于培养箱中培养,培养24 h后,加药异甘草素,其终浓度分别为 0、60、80和100 μmol·L-1,药物作用48 h后,分别在倒置显微镜下拍照观察其形态的变化。
2.4 AO/EB法观察凋亡形态AO能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。EB仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。在荧光显微镜下可见4种细胞形态:活细胞、早期凋亡细胞、非凋亡的死亡细胞,晚期凋亡细胞。取对数期细胞消化制成细胞悬液,按每孔2×105个置于预先置入玻璃盖玻片的6孔培养板中,每孔加细胞悬液2 mL,24 h后,加入异甘草素(0、60、80、100 μmol·L-1)孵育48 h后,吸尽培养液对细胞消化,将培养细胞用PBS离心洗涤2次。取60 μL AO(100 mg·L-1)和EB(100 mg·L-1)等体积混匀制成AO/EB荧光染液,与1.14 mL PBS 混合,使AO/EB终浓度为5 mg·L-1在荧光显微镜下观察细胞形态[5]。
2.5 Hoechst 33258荧光法观察细胞形态Hoechst为膜通透性的荧光染料,正常细胞和中早期凋亡细胞均可被Hoechst着色,取对数期细胞消化制成细胞悬液,按每孔2×105个置于预先置入玻璃盖玻片的6孔培养板中,每孔加细胞悬液2 mL,24 h后,加入异甘草素(0、60、80、100 μmol·L-1)孵育48 h后,吸尽培养液,PBS洗2遍,每孔加入1 mL固定液(甲醇 ∶ 冰醋酸=3 ∶ 1),固定15 min,去除固定液,用PBS洗2遍,用将盖玻片放于载玻片之上在荧光显微镜下观察细胞内凋亡情况[6]。
2.6 流式细胞技术检测细胞凋亡率取对数期细胞消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后,加入异甘草素(0、40、60、80、100 μmol·L-1)孵育48 h后收集经不同浓度处理后的细胞,用冷PBS洗1遍后置0℃水浴中,加500 μL Binding Buffer悬浮细胞,再加入5 μL AnnexinV 和 5 μL PI,轻轻混匀细胞,10 min后进行流式细胞仪检测[7]。
2.7 异甘草素对A375细胞内ROS水平的影响取对数生长期的A375细胞,按每孔1×105个接种于96细胞培养板中,每孔100 μL,24 h后分别加入0、40、60、80、100 μmol·L-1的异甘草素,于细胞培养箱分别培养2、4、6、12 h。终止培养,吸尽培养基,加入终浓度30 μmol·L-1 DCFH-DA,50 μL,37℃孵育30 min后,PBS冲洗,在激发光波长485 nm,发射光波长535 nm测定细胞荧光强度。用DCF绝对荧光值/SRB绝对荧光值×100%作为细胞ROS相对含量[8]。
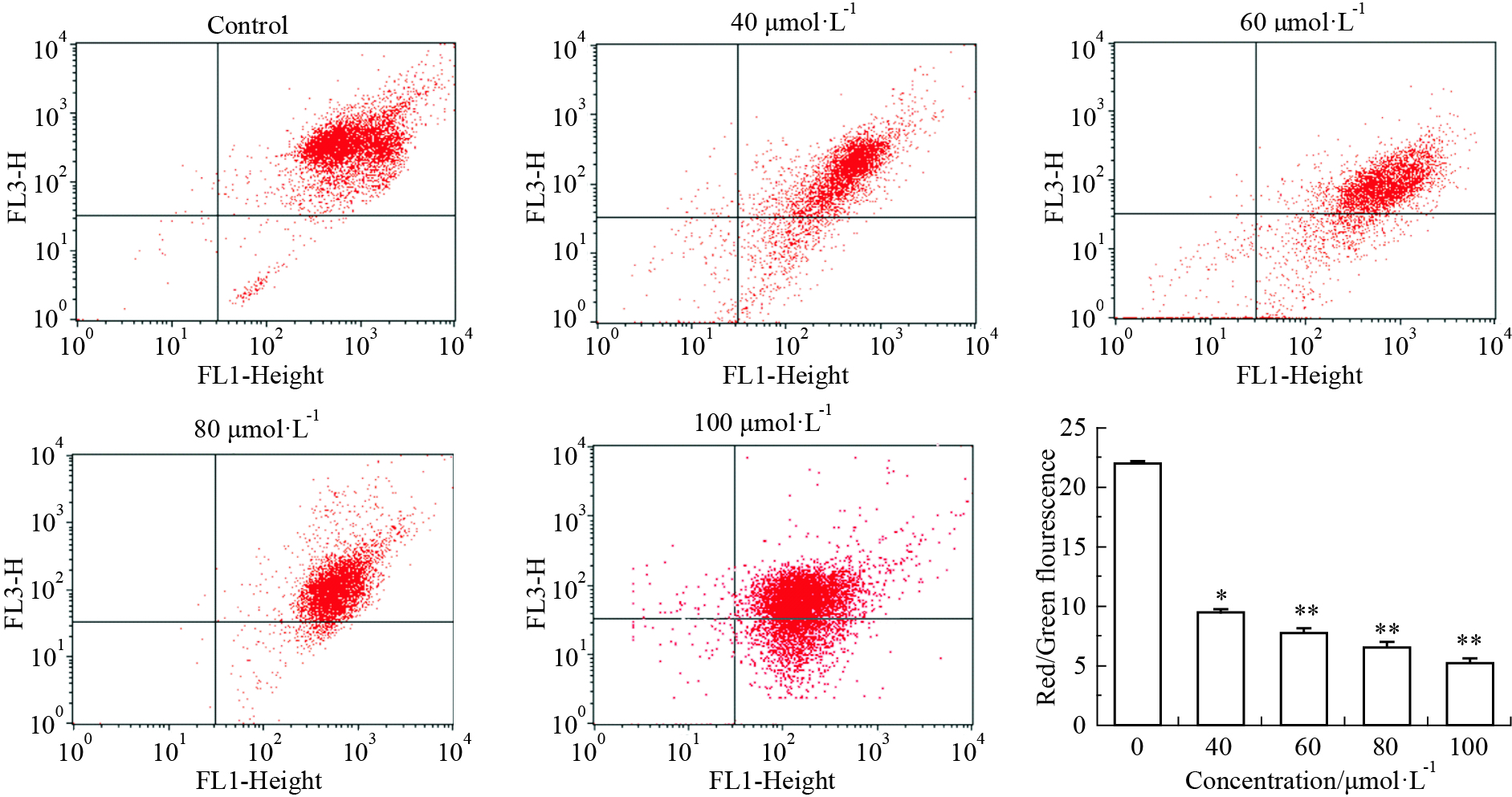
2.8 线粒体膜电势测定取对数生长期的A375细胞,按每瓶1×106个接种于细胞培养瓶中,24 h后分别加入0、40、60、80、100 μmol·L-1的异甘草素,细胞接种24 h后,消化细胞,取1×106个细胞,离心(1 500×g×5 min),弃上清液,加2 mL PBS缓冲液润洗1次,加100 μL的10 μmol·L-1 JC-1荧光染料混匀、重悬细胞,将细胞于37℃水浴中水浴20 min,用PBS 洗2次,洗去未结合的荧光染料,多功能酶标仪及流式细胞仪分别进行线粒体膜电势检测,用红色/绿色荧光强度比值来衡量线粒体去极化程度[9]。
2.9 异甘草素对A375细胞ATP生成的影响取对数期细胞消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后,加入异甘草素0、40、60、80、100 μmol·L-1孵育24、48 h后,收集经不同浓度处理后的细胞,利用南京建成生物公司研究所A095 ATP试剂盒测定。

取对数期细胞消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后,加入异甘草素0、40、60、80、100 μmol·L-1孵育24、48 h后,根据前期研究方法,离心收集上清液,按照南京建成生物公司研究所A0192乳酸测试盒说明书测定。

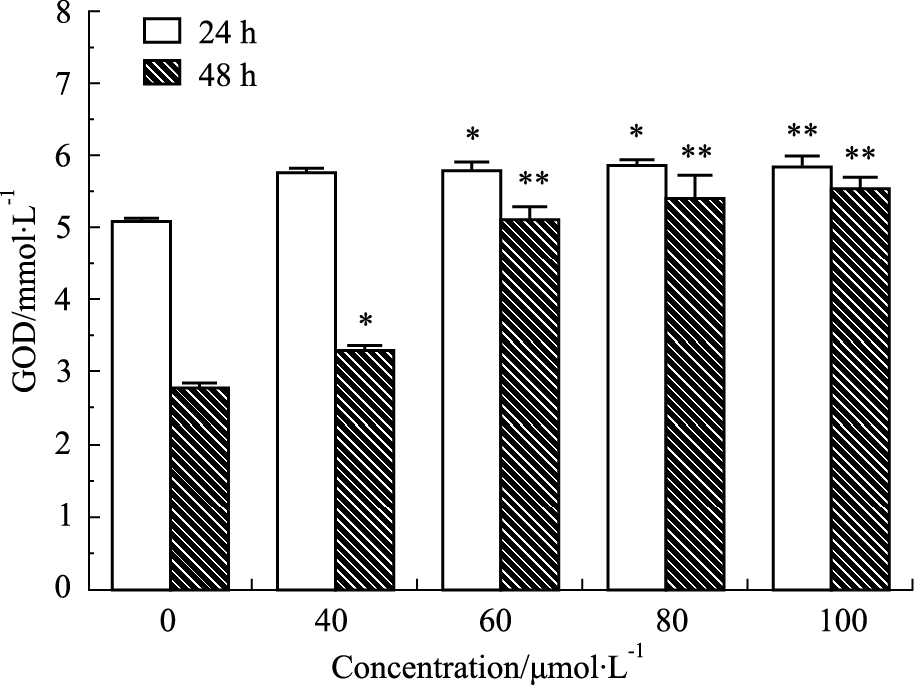
取对数期细胞消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后,加入异甘草素0、40、60、80、100 μmol·L-1孵育24、48 h后,根据前期研究方法,离心收集上清液,按照北京普利莱基因技术有限公司,E1010,葡萄糖氧化酶(GOD)测试盒说明书测定。

所有实验设有3个平行组,结果以 ± s 表示,以t检验进行组间比较。
± s 表示,以t检验进行组间比较。
在对数生长期的A375细胞中,分别加入不同浓度的异甘草素(0、10、20、40、60、80、100 μmol·L-1)继续培养48 h后,如Fig2所示,细胞抑制率分别为(12.59±3.22)%、(21.63±4.28)%、(41.21±2.96)%、(43.97±1.38)%、(49.61±0.53)%和(55.75±0.29)%。IC50为(82.01±1.23)μmol·L-1,随着异甘草素浓度增加,抑制率上升,且呈浓度依赖性。

|
| Fig 2 Effect of isoliquiritigenin on A375 cell inhibition rate (n=3) *P<0.05, **P<0.01 vs control group cells. |
对照组细胞经AO/EB染色,细胞核的DNA为均匀黄绿色荧光;经异甘草素处理后,核染色质出现固缩状(60 μmol·L-1);细胞核内可见致密浓染的黄绿色荧光早期凋亡细胞(60 μmol·L-1);随异甘草素浓度升高,核染色质出现圆珠状的橘红色荧光(80 μmol·L-1),细胞数量也逐渐减少,细胞出现晚期凋亡(100 μmol·L-1)。
由于AO/EB双染不稳定,荧光易淬灭,因此我们又采用荧光比较稳定的Hoechst 33285染料对异甘草素诱导的细胞凋亡进行形态学检测,经Hoechst染色后,在对照组中细胞大而饱满,呈均匀蓝色荧光;在异甘草素处理组中细胞核可见浓染致密的颗粒荧光,细胞缩小(60 μmol·L-1);随异甘草素浓度的增加,细胞出现典型的凋亡形态,高倍镜下可观察到细胞变小,胞核皱缩、碎裂,染色质浓缩,聚集在核膜边缘,形成染色质边集(80、100 μmol·L-1)。
3.3 异甘草素诱导A375细胞凋亡率明显升高AnnexinV/PI双染法结果显示,用不同浓度异甘草素(0、40、60、80、100 μmol·L-1)处理A375细胞48 h后,细胞总凋亡率分别为(21.02±3.15)%、(41.65±1.42)%、(45.35±5.68)%、(67.77±4.25)%,与对照组(14.95±1.23)% 相比,呈明显浓度依赖性,上述结果与荧光显微镜和相差显微镜下观察到的结果相一致,即不同浓度异甘草素作用于A375细胞48 h后,随着浓度增高,细胞凋亡数目增加。

|
| Fig 3 (A) Changes of A375 treated with isoliquiritigenin 48h(×200); (B) Apoptosis visualized by appropriate changes of nuclei stained with AO/EB(×200); (C) Effect of isoliquiritigenin on morphological changes in B16F10 cells observed by Hochest(×200) |

|
| Fig 4 Evaluation of apoptosis in A375 cells by FACS analysis (n=3) *P<0.05, **P<0.01 vs control group cells |

|
| Fig 5 (A) ROS production induced by different concentrations of ISL 12h (×200). (B)ISL increases intracelluar ROS levels in A375 cells in different time and concentrations(n=3). *P < 0.05, **P < 0.01 vs control group cells |
|
| Fig 6 Isoliquiritigenin induced A375 cell mitochondrial membrane potential decreased (n=3) *P<0.05, **P<0.01 vs control group cells. |
不同浓度异甘草素(0、40、60、80、100 μmol·L-1)作用于A375细胞2、4、6、12 h后,可以诱导细胞内总活性氧(ROS)水平明显升高(P < 0.05或P<0.01),并呈浓度依赖关系,根据光学显微镜下拍照观察,异甘草素作用于A375细胞12 h后,随着浓度增加,荧光强度增强。
3.5 异甘草素诱导A375细胞线粒体膜势能下降经异甘草素处理A375细胞24 h后,JC-1染色结果表明,不同浓度异甘草素处理组红、绿色荧光的比值降低,线粒体膜电势降低,并呈现出浓度依赖关系,通过流式细胞仪检测结果显示,随着药物浓度增高膜电位降低,部分以单体形式存在发绿色荧光,与酶标仪检测结果相符。
3.6 异甘草素抑制A375细胞ATP的生成异甘草素处理A375细胞24、48 h,可降低细胞ATP含量且具有浓度依赖性,作用A375细胞24 h加药组100 μmol·L-1及48 h加药组60、80、100 μmol · L-1与对照组相比差异有显著性。

|
| Fig 7 Effects of isoliquiritigenin on A375 intracellular ATP contents (n=3) *P<0.05, **P<0.01 vs control group cells. |

|
| Fig 8 Content of lactic acid in medium of A375 detected by a lactic acid assay kit (n=3) *P<0.05, **P<0.01 vs control group cells. |
|
| Fig 9 Effects of isoliquiritigenin on cell culture fluid glucose contents (n=3) *P<0.05, **P<0.01 vs control group cells |
异甘草素处理A375细胞24、48 h后,可降低细胞培养液LD含量且具有浓度依赖性,作用A375细胞24及48 h后,加药组80、100 μmol · L-1与对照组相比差异有显著性。
3.8 异甘草素抑制A375细胞葡萄糖摄入异甘草素处理A375细胞24、48 h后,测定细胞培养液中的葡萄糖水平,实验表明异甘草素作用A375细胞24 h后随着异甘草素浓度的升高,培养液中葡萄糖浓度明显上升且呈浓度依赖性,作用A375细胞48 h后,较24 h培养液中的浓度明显升高,说明异甘草素可以降低细胞对葡萄糖的摄取。
4 讨论凋亡(apoptosis)是细胞死亡的一种特殊方式,是细胞内外环境改变或死亡信号触发涉及一系列基因的激活、表达及调控等作用的细胞主动死亡过程[10]。
糖酵解是葡萄糖在酶的催化下降解成丙酮酸或乳酸并生成 ATP 的过程,又称 EMP,发生在细胞质中[11]。ATP和乳酸这两者的改变决定着糖酵解途径的改变,肿瘤细胞即使在常氧条件下仍依赖糖酵解产生ATP来进行增殖,因此抑制糖酵解主要是要降低细胞内ATP水平。
在研究浓度范围内,异甘草素能明显抑制A375细胞的增殖,且具有浓度依赖性,流式细胞检测中,细胞的凋亡率可达到67.77%;结果显示,异甘草素可以诱导胞质ROS升高,通过感应使线粒体内ROS增加,引起线粒体膜电势下降,线粒体膜电位改变是细胞凋亡的重要指标之一,综上所述,异甘草素作用于A375细胞主要形式是凋亡。
为了进一步研究异甘草素诱导人黑色素瘤细胞凋亡的机制,根据大量文献表明,在缺氧条件下活性氧的产生能够间接作用于丙酮酸脱氢酶激酶(PDK)[12],实验结果显示,异甘草素作用于A375细胞,可减少细胞内的ATP含量和培养液中乳酸含量,并且可以抑制细胞对葡萄糖的摄取,这表明异甘草素确实可以抑制A375细胞糖酵解途径,推测其作用机制为抑制丙酮酸脱氢酶激酶的活性。
以上结果表明异甘草素能够明显抑制A375细胞的恶性增殖以及诱导细胞的凋亡,但异甘草素对其中糖酵解途径的作用机制还有待于更深一步的研究。
(致谢:本研究在石河子大学药学院新疆特种植物药资源教育部重点实验室完成。感谢导师郑秋生老师和在本课题研究中给予我关怀和支持的同学,他们开创性的研究拓展了我的学术视野,创造了团结而上进的科研氛围,使我的科研工作进展顺利,谨此向我的导师郑秋生博士和实验室全体同学致以衷心的感谢!)
| [1] | Chen X,Zhang B, Yuan X,et al. Isoliquiritigenin-induced Differentiation in mouse melanoma B16F0 cell line[J] Oxid Med Cell Longev, 2012,5, 349-62. |
| [2] | Zhang X I,Yeung E D,Wang J,et al. Isoliquiritigenin, a natural anti-oxidant, selectively inhibits the proliferation of prostate cancer cells[J].Clin Exp Pharmacol Physiol,2010 Aug;37(8):841-7. |
| [3] | Wang Z,Wang N,Liu P,et al. MicroRNA-25 regulates chemo resistance associated autophagy in breast cancer cells, a process modulated by the natural autophagy inducer isoliquiritigenin[J]. Oncotarget, 2014, 5(16):7013-26. |
| [4] | Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening[J]. Nat Protocols, 2006, 1(3):1112-6. |
| [5] | Baski'c D,Popovi'c S,Risti'c P,Arsenijević N N. Analysis of cycloheximide-induced apoptosis in human leukocytes:fluorescence microscopy using Annexin V/propidium iodide versus acridin orange/ethidium bromide[J]. Cell Biol Internat, 2006, 30(11):924-32. |
| [6] | 杨 帆,孙秋艳,刘亮亮,等 维康醇诱导小鼠B16F0细胞凋亡的研究[J]. 中国药理学通报,2013,29(9):1269-74.Yang F,Sun Q Y,Liu L L,et al. Alcohol induced B16F0 apoptosis of mice[J]. Chin Pharmacol Bull,2013,29(9):1269-74. |
| [7] | 李凤金,毕明刚,武 爽,牛雯颖.辽东楤木叶总皂苷抗人乳腺癌作用的研究[J]. 中国药理学通报,2013,29(12):1663-7.Jin F J,Bi M G,Wu S,et al. Total saponins from leaves of Aralia elata Seem exhibit antitumor effects on human breast cancer in vitro and vivo[J]. Chin Pharmacol Bull,2013,29(12):1663-7. |
| [8] | Aranda A1,Sequedo L,Tolosa L,et al. Dichloro-dihydro-fluorescein diacetate (DCFH-DA) assay:A quantitative method for oxidative stress assessment of nanoparticle-treated cells[J]. Toxicol Vitro, 2013, 27(2):954-63. |
| [9] | Martinez-Pastor F1,Johannisson A,Gil J,et al. Use of chromatin stability assay, mitochondrial stain JC-1, and fluorometric assessment of plasma membrane to evaluate frozen-thawed ram semen[J]. Anim Reprod Sci, 2004, 84(1):121-33. |
| [10] | Wang L H, Hu X Y, Zhu W,et al. Increased leptin by hypoxic-preconditioning promotes autophagy of mesenchymal stem cells and protects them from apoptosis[J]. Sci China(Life Sci),2014,2:171-80. |
| [11] | Wong E Y,Wong S C,Chan C M,et al. TP53-induced glycolysis and apoptosis regulator promotes proliferation and invasiveness of nasopharyngeal carcinoma cells[J]. Oncol Let, 2015, 9(2):569-74. |
| [12] | Wu C A, Chao Y,Shiah S G,et al.Nutrient deprivation induces the Warburg effect through ROS/AMPK-dependent activation of pyruvate dehydrogenase kinase[J]. Biochim Biophys Acta (BBA)-Mol Cell Res,2013,1833(5):1147-56. |

