


2. 安徽医科大学附属省立医院, 安徽 合肥 230001
魏伟(1960-),男,博士,教授,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:wwei@ahmu.edu.cn
2. Affiliated Anhui Provincial Hospital, Anhui Medical University, Hefei 230001, China
糖尿病肾病(diabetic nephropathy,DN)是糖尿病引起的严重和危害性最大的微血管并发症之一,也是造成终末期肾衰的主要原因之一。DN的发病机制十分复杂,其确切的机制尚未完全阐明。研究表明,到2015年,世界范围内的糖尿病的人数可能会达到30亿,据估计大约20%的糖尿病患者会发展成为DN[1]。DN的主要特点是糖代谢异常引起的肾小球过度肥大、系膜增生、基底膜增厚,其主要临床表现为蛋白尿排泄增加和尿蛋白含量超标,从微量蛋白尿渐进增至大量蛋白尿,蛋白尿也是加重肾脏损伤的重要危险因素之一。足细胞是肾小球滤过屏障的重要组成部分,主要通过足突黏附于肾小球基底膜,与内皮细胞、基底膜共同维持正常的肾小球滤过功能。足细胞的结构或功能的完整性遭到破坏都会导致蛋白尿的发生,此外,大量研究表明,足细胞损伤在DN的发生发展中起到关键的作用[2]。进一步研究发现,维持足细胞结构和功能的裂孔隔膜蛋白分子如nephrin、podocin等及黏附分子α3β1整合素表达水平改变是足细胞损伤的重要标志,与DN的发生发展有着密切的联系。
小檗碱(berberine,BBR),别称为黄连素,是一种常见的异喹啉生物碱,现用于治疗肠道感染,可以从毛茛科植物黄连干燥根状茎和黄柏皮中提取而得到。研究表明,BBR除了作为植物抗菌素用于抗菌使用外,还具有降低升高的血糖水平,调节血脂水平,减轻炎症反应,改善胰岛素抵抗和提高胰岛素活性等作用[3],这表明BBR对预防和治疗糖尿病及其他并发症方面具有重要的临床价值和潜在的应用前景。课题组前期研究表明,BBR给药能明显降低DN大鼠血糖、血肌酐、尿素氮、尿肌酐和尿蛋白总量的水平; 模型组大鼠肾脏组织出现肾小球过度肥大、系膜增生、肾小管间质炎症细胞浸润和肾小球硬化等征象,同时,不同剂量BBR给药后观察发现,BBR给药组能明显改善肾脏病理异常变化,明显改善肾脏过度肥大和肾脏纤维化状态[5],此外,也有实验证明,BBR可通过抑制肾小球系膜细胞增殖能力,降低IV型胶原和纤维连接蛋白的表达水平来发挥对DN的保护作用[4],但是BBR对足细胞相关蛋白nephrin、podocin和α3β1整合素的表达的影响研究较少。本文旨在通过观察肾脏组织中nephrin和podocin和α3β1整合素在DN大鼠足细胞表达的变化情况,探讨BBR对DN肾脏足细胞相关蛋白表达的影响及可能机制。
1 材料与方法 1.1 材料 1.1.1 动物清洁级♂ SD大鼠,8~10周龄,体质量为(180±20)g,购于安徽医科大学实验动物中心,动物合格证号是:皖医动第028号。
1.1.2 药物和试剂普通饲料及高糖高脂饲料(配制单位:安徽医科大学实验动物中心,高糖高脂饲料配方为:基础饲料64%,猪油8%,蛋黄粉10%,蔗糖18%,胆酸钠1%); STZ(美国Sigma公司 S0130); BBR (配制单位:安徽省立医院药学实验室,含量大于96.5%); 依那普利(批号:014100701,石药集团欧意药业有限公司); 兔抗nephrin多克隆抗体(批号:140629,北京博奥森生物技术有限公司);兔抗podocin多克隆抗体(批号:L0913,美国Santa Cruz Biotechnology);兔抗整合素α3β1多克隆抗体(批号:YSLE27W,北京博奥森生物技术有限公司);免疫组化SP-9000通用型SP检测试剂盒(批号:WP142407,北京中杉金桥生物技术有限公司);免疫组化DAB显色试剂盒(批号:K145213B,北京中杉金桥生物技术有限公司);免疫组化Harris苏木精染液(批号:140521,北京中杉金桥生物技术有限公司); 超敏ECL化学发光显色试剂盒(批号:PI207497,Thermo scientific); RIPA裂解液(P00138);SDS-PAGE蛋白上样缓冲液(5×)(批号:P0015,碧云天公司)
1.2 方法 1.2.1 DN大鼠模型的制备清洁级♂ SD大鼠,普通饲料适应性喂养1周后,换用高糖高脂饲料喂养,持续6周,诱发大鼠产生胰岛素抵抗。禁食不禁水12 h后,按体重35 mg·kg-1剂量一次性腹腔注射STZ诱导建立模型大鼠,72h后尾静脉取血测定空腹血糖。
1.2.2 动物分组及处理腹腔注射STZ 72 h后,测定的空腹血糖值≥11.1 mmol·L-1的SD大鼠视为造模成功,然后随机分为5组,分别为:模型组、BBR(50、100和200 mg·kg-1)给药组和依那普利组阳性药对照组(1 mg·kg-1),每组10只,继续用高糖高脂饲料喂养8周。另外设正常对照组(NC),用普通饲料喂养。造模成功后1周,各给药组灌胃分别给以不同剂量小檗碱和依那普利阳性药,正常组和模型组给以等量溶媒(0.5% CMC-Na)灌胃,每日1次,连续8周。
2 指标收集及检测 2.1 免疫组织化学法观察肾脏足细胞特征蛋白nephrin、podocin和α3β1整合素分布和表达情况灌胃给药8周结束后,取出大鼠肾脏,置于4%中性甲醛缓冲溶液固定,石蜡包埋,4 μm厚度切片,常规脱蜡、水化、组织抗原修复后,用3%过氧化氢阻断内源性氧化物酶20 min,再滴加5%山羊血清封闭,室温孵育20 min;滴加一抗(兔抗nephrin、podocin和α3β1整合素多克隆抗体),4℃过夜;37℃复温20 min;PBS冲洗;滴加生物素化通用型二抗工作液室温孵育30 min;PBS冲洗后,滴加辣根酶标记的链霉素卵白素工作液,37℃烘箱内孵育30 min;用PBS冲洗3次,然后用DAB染液显色15 s,苏木精染液复染50 s,再进行常规脱水、二甲苯透明,中性树胶封片,先用油镜观察各组大鼠肾脏组织nephrin、podocin和α3β1整合素的表达分布情况(×1 000倍)。阳染呈棕色或褐色颗粒状,用PBS代替一抗作为阴性对照组。然后用高倍镜观察各组大鼠肾脏组织nephrin、podocin和α3β1整合素的表达情况,阳染呈棕色或褐色颗粒状。每组取10例切片,采集高倍视野(×400倍)图像,每例计数1张切片,4个视野,采用Imagine-Pro-Plus软件分别对各组大鼠肾脏组织切片的免疫组化染色的阳性表达进行定量分析,测定组织中蛋白染色平均光密度值并分析。染色越深,平均积分光密度越大,反映蛋白的表达越高。
2.2 Western blot法检测肾脏足细胞特征蛋白nephrin、podocin和α3β1整合素表达情况每组样本称取肾皮质约50 mg,用强裂解液按RIPA ∶ PMSF=99 ∶ 1的比例混匀后,提取裂解蛋白30 min,反复冻融3次。4℃,12 000 r·min-1离心15 min后提取上清,再与4×蛋白电泳上样缓冲液混合,100℃煮沸10 min,-20℃保存。制备SDS/PAGE凝胶,吸取适量样本上样,电泳,转膜,后用吐温PBS/牛奶37℃摇床上封闭2 h。放入适宜稀释度的一抗中4℃过夜,次日用辣根过氧化物酶(HRP)标记的二抗孵育2 h,TPBS洗膜3×10 min,PBS 1×10 min,采用Imagine Quant Las 4000mini 化学自发光显影仪器,ECL 试剂盒显影,结果采用Imagine J软件分析蛋白的相对光密度值,以目的蛋白条带与β-actin蛋白条带的灰度值的比值表示。
2.3 统计学处理 计数资料采用 ± s 表示,用单因素方差分析(One-way ANOVA)进行组间比较,全部数据采用SPSS16.0统计软件进行统计分析。肾脏组织免疫组化分析采用Imagine-Pro plus软件进行分析,Western blot 数据结果采用Imagine J软件分析,分别测定平均光密度值。
± s 表示,用单因素方差分析(One-way ANOVA)进行组间比较,全部数据采用SPSS16.0统计软件进行统计分析。肾脏组织免疫组化分析采用Imagine-Pro plus软件进行分析,Western blot 数据结果采用Imagine J软件分析,分别测定平均光密度值。
采集油镜视野(×1000倍)图像,观察nephrin蛋白的表达分布情况。我们发现:neprhin蛋白主要表达在肾小球足细胞上,存在于肾小球基底膜外侧的足细胞裂孔隔膜和足突之间,结果显示,nephrin蛋白也跨膜分布于足细胞胞质中,其阳性产物呈棕褐色,见Fig 1-1。

|
| Fig 1-1 Expression of nephrin in kidney glomerulus by oil mirror observation (×1 000) A: Negative control group; B: Nephrin positive staining control group |
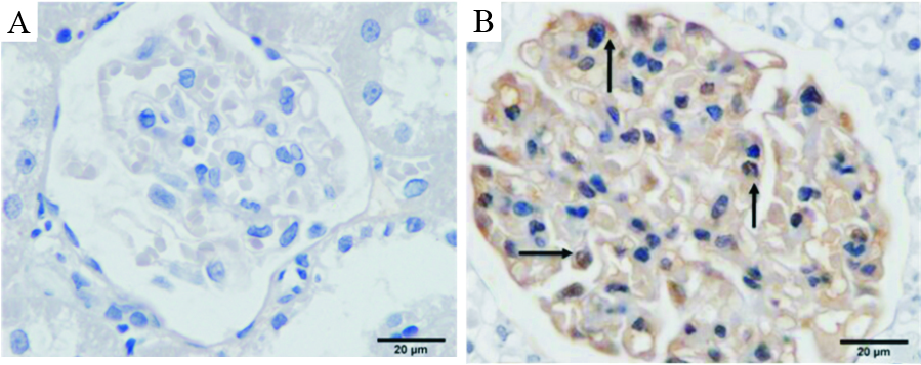
采集油镜视野(×1 000倍)图像,观察podocin蛋白的表达分布情况。我们发现:podocin蛋白主要表达在肾小球足细胞上,分布于足细胞的胞膜上,其阳性产物呈棕褐色,见Fig 2-1。
|
| Fig 2-1 Expression of podocin in kidney glomerulus by oil mirror observation (×1 000) A: Negative control group; B: Podocin positive staining control group |
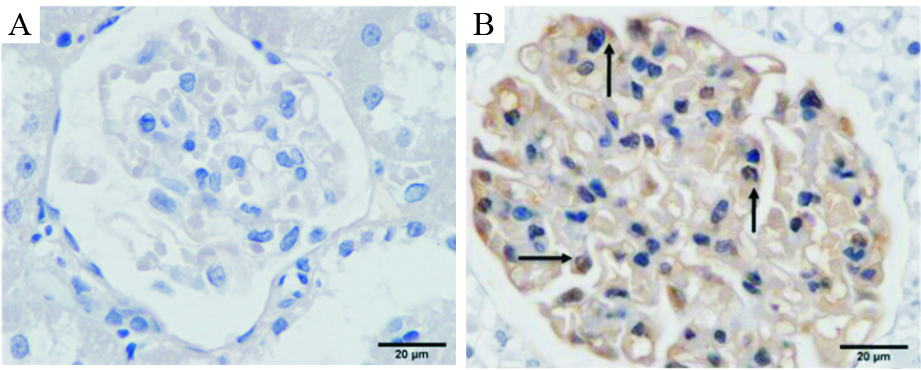
采集油镜视野(×1 000倍)图像,观察α3β1整合素蛋白的表达分布情况。我们发现:α3β1整合素蛋白主要表达在肾小球基底膜和足细胞上,部分也跨膜分布于足细胞胞质中,其阳性产物呈棕褐色,见Fig 3-1。
|
| Fig 3-1 Expression of intergrin α3β1 in kidney glomerulus by oil mirror observation (×1 000) A: Negative control group; B: Intergrin α3β1 positive staining control. |
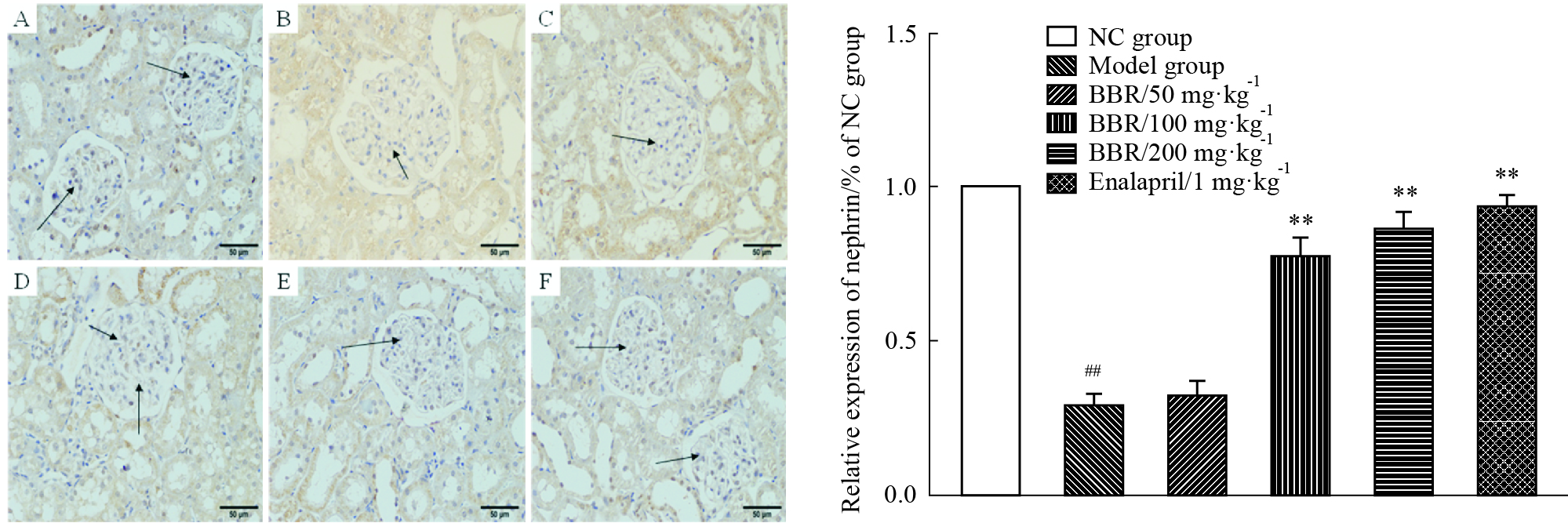
采集高倍视野(×400倍)图像,测定肾脏组织中nephrin蛋白染色平均光密度值,进行半定量分析。结果显示:正常组大鼠肾脏组织nephrin均匀分布于肾小球内,沿肾小球毛细血管袢分布,着色较深;模型组大鼠nephrin蛋白阳性表达明显减少且分散不均一。与正常对照组相比,模型组大鼠肾脏组织nephrin蛋白表达明显降低,BBR(50 mg·kg-1)给药组对大鼠肾脏组织的nephrin表达作用不明显,BBR(100和200 mg·kg-1)给药组和依那普利阳性药对照组(1 mg·kg-1)作用对增强nephrin蛋白表达效果明显,与模型组大鼠肾脏nephrin蛋白表达比较差异均有显著性(P < 0.01)。蛋白染色及分析结果见Fig 1-2。
|
| Fig 1-2 Effect of different dosages of BBR on the expression of nephrin in kidney tissue (IHC×400) A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. |
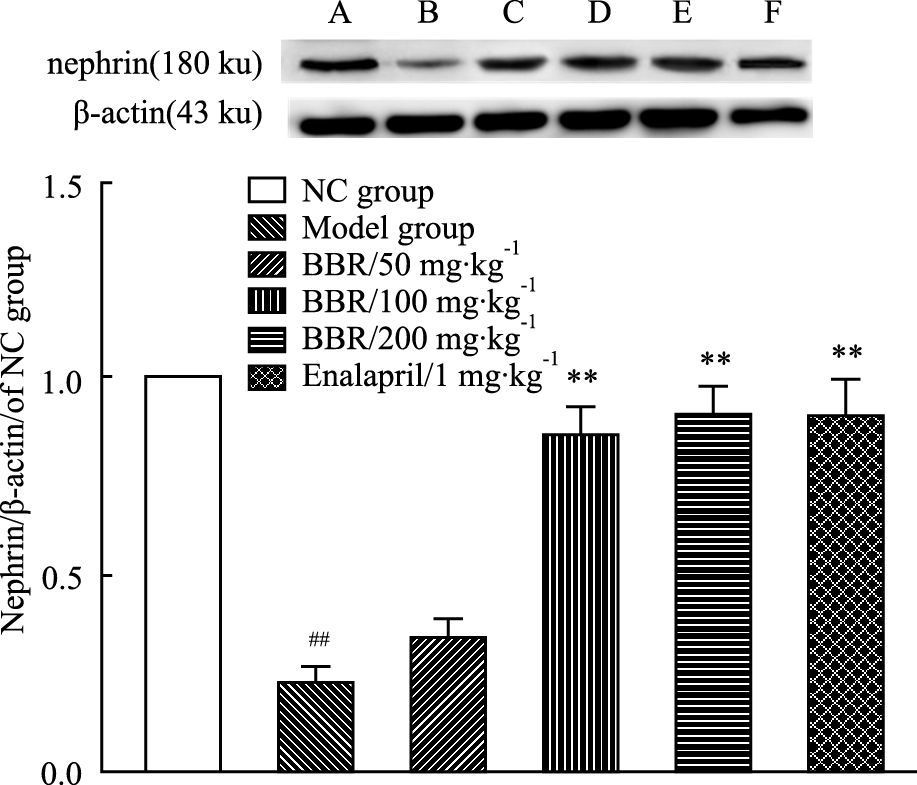
与正常组相比,模型组大鼠肾脏组织nephrin蛋白表达明显降低(P < 0.01);与模型组相比,BBR(100和200 mg·kg-1)给药组和依那普利阳性药对照组(1 mg·kg-1)对上调nephrin蛋白表达效果明显,且差异均有显著性(P < 0.01)。见Fig 1-3。
|
Fig 1-3
Effect of different dosages of BBR on the expression of
nephrin in kidney tissue ( ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group.
|
采集高倍视野(×400倍)图像,测定肾脏组织中podocin蛋白染色平均光密度值,进行半定量分析。结果显示:与正常对照组相比,模型组大鼠肾脏组织podocin蛋白表达明显降低,组织中蛋白染色平均光密度值明显减少,BBR(50、100、200 mg·kg-1)给药组对模型组大鼠肾脏组织的podocin蛋白表达有不同程度的上调作用,其中BBR(100、200 mg·kg-1)给药组上调作用效果较明显,与依那普利给药组(1 mg·kg-1)作用相似,与模型组大鼠比较差异有显著性(P < 0.01)。见Fig 2-2。

|
| Fig 2-2 Effect of different dosages of BBR on the expression of podocin in kidney tissue (IHC×400) A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. |
与正常组相比,模型组大鼠肾脏组织podocin蛋白表达明显降低(P < 0.01);与模型组相比,BBR(100、200 mg·kg-1)给药组和依那普利阳性药对照组(1 mg·kg-1)对上调podocin蛋白表达作用明显,差异均有显著性(P < 0.01)。见Fig 2-3。
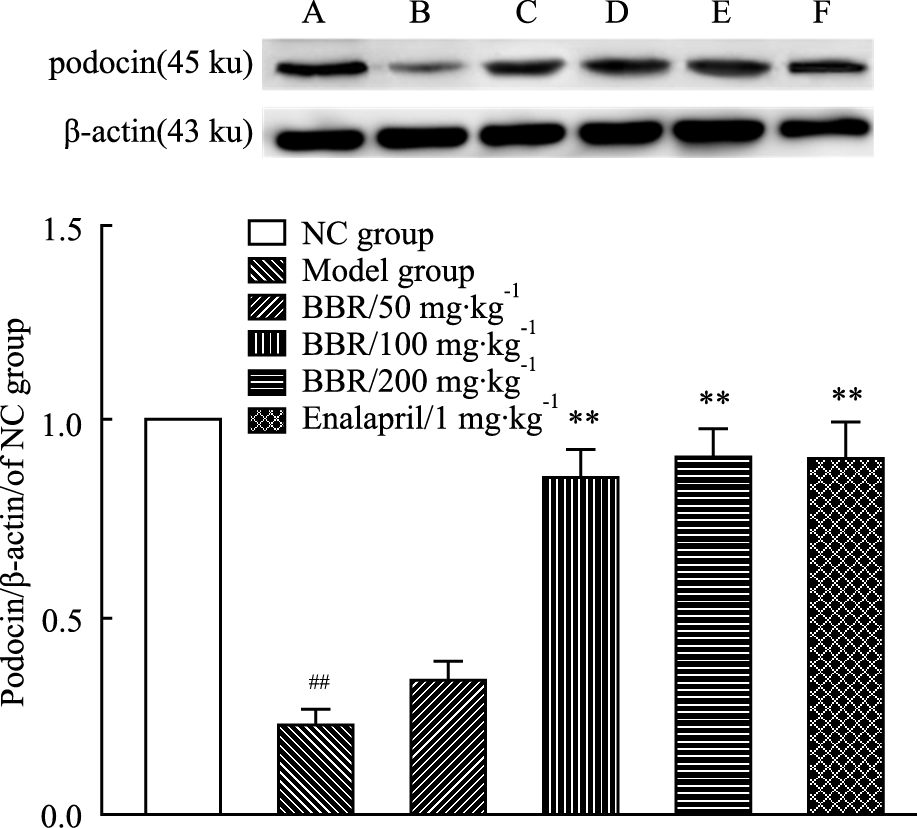
|
Fig 2-3
Effect of different dosages of BBR on the expression
of podocin in kidney tissue ( ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group.
|
采集高倍视野(×400倍)图像,测定肾脏组织中α3β1整合素染色平均光密度值,对切片免疫组化染色的阳性表达进行半定量分析。结果显示:与正常对照组相比,模型组大鼠α3β1整合素蛋白表达明显降低,肾小球α3β1蛋白染色平均光密度值明显减少,BBR(50、100、200 mg·kg-1)给药组对模型组大鼠肾脏组织的α3β1表达有不同程度的上调作用,其中BBR(100、200 mg·kg-1)治疗组升高作用效果明显,与依那普利给药组(1 mg·kg-1)作用相似,与模型组大鼠比较差异有显著性(P < 0.01)。蛋白染色及分析结果见Fig 3-2。
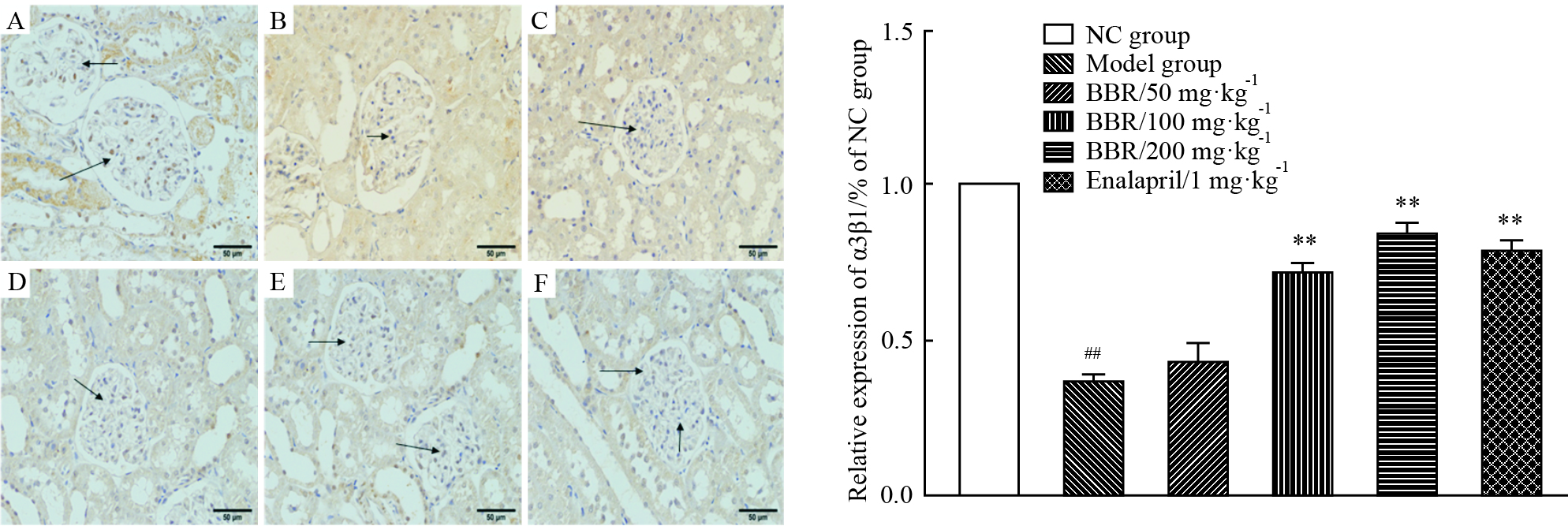
|
| Fig 3-2 Effect of different dosages of BBR on the expression of intergrin α3β1 in kidney tissue (IHC×400) A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. |
与正常组相比,模型组大鼠肾脏组织α3β1整合素蛋白表达明显降低(P < 0.01);与模型组相比,BBR(100、200 mg·kg-1)给药组和依那普利阳性药对照组(1 mg·kg-1)对上调α3β1整合素表达作用明显,差异均有显著性(P < 0.01),而BBR(50 mg·kg-1)给药组对上调大鼠肾脏组织的nephrin表达作用不明显,见Fig 3-3。
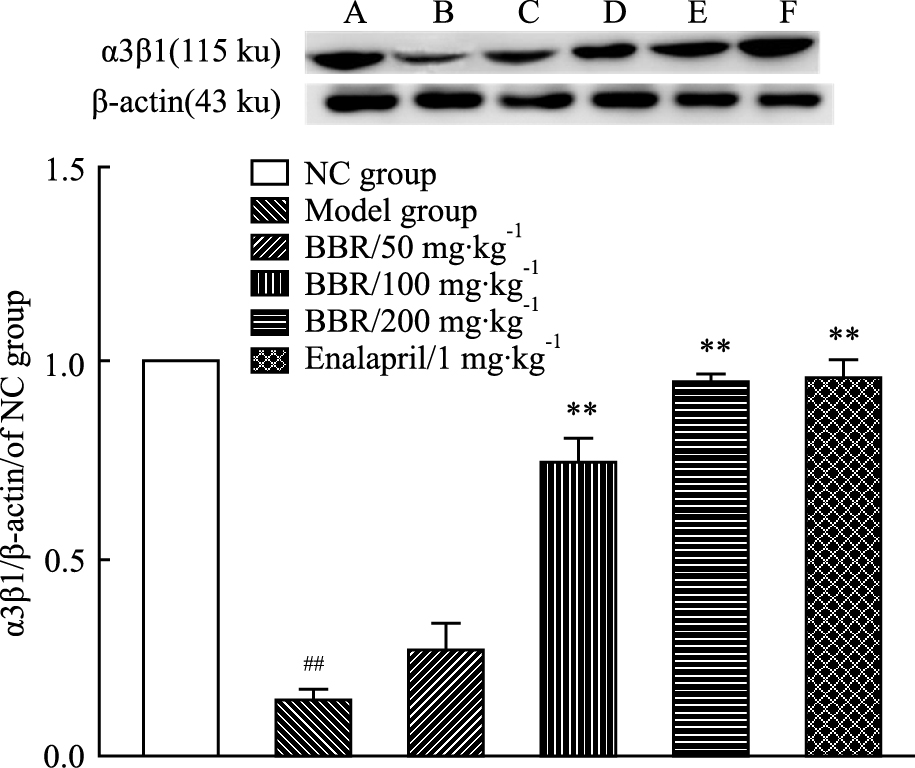
|
Fig 3-3
Effect of different dosages of BBR on the expression of
intergrin α3β1 in kidney tissue ( ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group. ± s ,n=3)
A: NC group; B: Model group; C: BBR (50 mg·kg-1); D: BBR (100 mg·kg-1); E: BBR (200 mg·kg-1); F: Enalapril (1 mg·kg-1). ##P<0.01 vs normal group; **P<0.01 vs model group.
|
糖尿病是一种常见的糖代谢障碍性疾病,DN作为糖尿病严重的并发症之一,也归属于糖尿病微血管病变的范畴,其最终可能导致终末期肾衰,严重影响患者的生活质量。DN在组织学上表现为肾小球过度肥大、系膜增生和肾小球硬化等;在临床上主要表现为血糖、血脂代谢紊乱和进行性肾功能损伤。此外,DN还常常伴有尿蛋白的代谢紊乱[6]。研究表明,BBR在防治DN上有着广泛的应用前景[7],但是目前就BBR在DN中发挥肾脏保护作用,涉及到足细胞的作用研究较少,因此机制尚不明确。我们课题组前期研究发现,BBR可以明显降低DN大鼠肾组织VEGF的异常表达,改善VEGF异常增多引起的肾小球功能紊乱和尿蛋白堆积,减轻肾脏损伤[8]。此外,我们课题组还发现,BBR能明显降低DN诱发的高糖血症,降低糖尿病动物血清的BUN、UTP/C、Scr、TC、TG和LDL-C水平,从而发挥对DN大鼠肾脏的保护作用,进一步深入研究发现,BBR的肾脏保护作用与其调控G蛋白-AC-cAMP信号通路相关[9]。BBR预防给药能够延缓DN的发生发展,研究证实,BBR能够明显抑制肾脏炎性因子如IL-6、TGF-β1和PGE2的表达水平,减轻DN时肾脏的炎症发应,从而发挥肾脏保护作用,其部分机制可能与抑制EP受体相关信号通路密切相关[10]。以上提示,BBR在DN时保护肾脏作用,与抑制肾脏炎症反应关系密切,这可能依赖于对PGE2-EPs-G蛋白-cAMP信号通路的调控作用。
足细胞即肾小球脏层上皮细胞,与GBM和毛细血管内皮细胞共同构成肾小球滤过屏障,足细胞是避免尿蛋白形成的最后一道屏障,足细胞损伤或脱落会导致大量蛋白尿及肾小球硬化。足细胞损伤参与DN的发生发展,足细胞特异性标志蛋白如nephrin、podocin和α3β1整合素和形态结构的异常表达会破坏肾小球滤过屏障结构和功能,进而加速DN的进程。nephrin作为单次跨膜的1型跨膜蛋白,属于免疫球蛋白超家族的一种含1241个残基的细胞黏附分子,维持足细胞的正常形态和黏附能力,保持肾小球滤过屏障的通透性,对足细胞黏附于肾小球基底膜起着关键作用。有研究报道了血管紧张素II可通过抑制Notch通路降低足细胞内nephrin的表达,提示Notch通路在调控nephrin表达方面具有重要作用[11]。podocin通过C-末端与nephrin和CD2AP相互作用,podocin加强nephrin蛋白的信号传递,其表达下降可通过nephrin诱导足细胞内信号传导异常,使肾小球滤过屏障完整性遭到破坏,蛋白滤过增加。研究发现,DN患者足细胞nephrin和podocin蛋白表达降低,且与DN蛋白尿的进展呈负相关,进一步研究表明,BBR干预治疗后,nephrin和podocin表达有所提高,可能与抑制糖基化终产物的形成和氧化应激作用有关[12]。α3β1整合素是足细胞表达的主要整合素,也是基底膜组成成分层黏连蛋白-521的主要受体,故作为基底膜-足细胞连接膜蛋白的α3β1整合素和层黏连蛋白复合物的损伤,将导致足细胞和基底膜之间的作用减弱,进而导致足细胞脱落,促进蛋白尿的产生。研究显示,α3β1整合素水平的变化会导致足细胞与肾小球基底膜之间的黏附功能改变,这是足细胞脱落进而产生蛋白尿的重要原因[13]。研究发现,在STZ诱导的DN大鼠肾脏组织中,α3β1整合素的mRNA和蛋白质的表达均明显下降,这可能促进DN时足细胞减少和蛋白尿发生[14]。但是,BBR对α3β1 整合素的表达是否有影响,目前尚未见相关文献报道。
本实验在前期课题组研究基础上,诱导建立大鼠模型,探讨小檗碱对DN模型大鼠肾脏足细胞相关蛋白nephrin、podocin和α3β1整合素蛋白表达的影响,实验结果表明:足细胞特异性标志蛋白如nephrin、podocin和α3β1整合素均表达在肾小球内,其在足细胞的表达分布各有差异;适宜剂量BBR给药能有效上调模型组大鼠肾脏组织足细胞相关蛋白nephrin、podocin和α3β1整合素在肾小球内的表达水平,nephrin、podocin 等及黏附分子α3β1 整合素表达下调是足细胞损伤的标志,提示BBR可能通过影响DN大鼠肾脏足细胞相关蛋白的表达,来减缓足细胞的损伤而发挥肾脏保护作用,为BBR应用于DN 早期防治提供可能。BBR可通过影响DN模型组大鼠足细胞相关蛋白表达,减轻足细胞损伤而发挥肾脏保护作用,使其成为未来防治DN的重要药物。但这一作用是通过何种途径调控nephrin、podocin 等及黏附分子α3β1 整合素及这几种蛋白之间是否存在内部联系尚需进一步研究,拟在今后的体内、体外实验中进一步阐明,为BBR早日应用于临床防治DN提供重要的参考价值。
(致谢:本实验在安徽医科大学临床药理研究所实验室完成,实验中涉及到的病理切片技术获得安徽省立医院病理科胡闻主任的技术指导,在开展实验过程中也获得了临床药理研究所各位老师和同学的支持,在此表示感谢!)
| [1] | Tang S C. Diabetic nephropathy:a global and growing threat[J]. Hong Kong Med J, 2010, 16(4):244-5. |
| [2] | Ziyadeh F N, Wolf G. Pathogenesis of the podocytopathy and proteinuria in diabetic glomerulopathy[J]. Curr Diabetes Rev, 2008, 4(1):39-45. |
| [3] | Zhang Y, Li X, Zou D, et al. Treatment of type 2 diabetes and dyslipidemia with the natural plant alkaloid berberine[J]. J Clin Endocrinol Metab, 2008, 93(7):2559-65. |
| [4] | Tang L Q, Wang F L, Zhu L N et al. Berberine ameliorates renal injury by regulating G proteins-AC-cAMP signaling in diabetic rats with nephropathy[J]. Mol Biol Rep, 2013, 40(6):3913-23. |
| [5] | Yang Y, Ni W J, Cai M, et al.The renoprotective effects of berberine via the EP4-Galphas-cAMP signaling pathway in different stages of diabetes in rats[J]. J Recept Signal Transduct Res, 2014, 34(6):445-55. |
| [6] | Ni W J, Tang L Q, Wei W. Research progress in signalling pathway in diabetic nephropathy[J]. Diabetes Metab Res Rev, 2015, 31(3):221-33. |
| [7] | Ni W J, Ding H H, Tang L Q. Berberine as a promising anti-diabetic nephropathy drug:An analysis of its effects and mechanisms[J]. Eur J Pharmacol, 2015, 760:103-12. |
| [8] | 倪伟建, 丁海华, 唐丽琴,等.小檗碱对糖尿病肾病大鼠肾组织VEGF表达的影响[J].中国药理学通报, 2015, 31(6):795-800.Ni W J, Ding H H, Tang L Q, et al. Effect of berberine on expression of vascular endothelial growth factor in diabetic nephropathy rats[J]. Chin Pharmacol Bull, 2015, 31(6):795-800. |
| [9] | Wang F L, Tang L Q, Yang F, et al. Renoprotective effects of berberine and its possible molecular mechanisms in combination of high-fat diet and low-dose streptozotocin-induced diabetic rats[J]. Mol Biol Rep, 2013, 40(3):2405-18. |
| [10] | Tang L Q, Liu S, Zhang S T, et al. Berberine regulates the expression of E-prostanoid receptors in diabetic rats with nephropathy[J]. Mol Biol Rep, 2014, 41(5):3339-47. |
| [11] | 高 峰, 张 涛,王晓梅, 等. 血管紧张素Ⅱ对足细胞Notch通路及Nephrin表达的影响[J].中国药理学通报, 2015, 31(2):247-50.Gao F, Zhang T, Wang X M, et al. Effect of angiotensin on expression of Notch pathway and Nephrin in podocyte[J]. Chin Pharmacol Bull, 2015, 31(2):247-50. |
| [12] | Wu D, Wen W, Qi C L, et al. Ameliorative effect of berberine on renal damage in rats with diabetes induced by high-fat diet and streptozotocin[J]. Phytomedicine, 2012, 19(8-9):712-8. |
| [13] | Chen J, Gui D, Chen Y, et al. Astragaloside IV improves high glucose-induced podocyte adhesion dysfunction via alpha3beta1 integrin upregulation and integrin-linked kinase inhibition[J]. Biochem Pharmacol, 2008, 76(6):796-804. |
| [14] | Chen J, Chen Y, Luo Y, et al. Astragaloside IV ameliorates diabetic nephropathy involving protection of podocytes in streptozotocin induced diabetic rats[J]. Eur J Pharmacol, 2014, 736:86-94. |

