


阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的中枢神经系统退行性疾病,随着人口老龄化进程的加快,其影响已经不容忽视,其主要临床表现为进行性认知功能障碍、记忆力衰退、语言以及社会适应程度的改变[1]。研究表明[2],Aβ沉积可导致神经元突触缺失及神经功能退化,但是目前还没有明显有效的治疗手段。蛇床子素((7-methoxy-8-isopentenoxycoumarin,C15H16O3,osthole,Ost)是从伞形科植物如独活和蛇床子等提取分离出来的香豆素类化合物[3]。许多研究证明,Ost具有抗氧化、抗凋亡等神经保护作用[4, 5, 6]。本研究采用含有突变位点的APP(amyloid precursor protein)基因感染神经元来构建体外AD细胞模型,观察Ost对感染APP形成Aβ沉积导致神经元突触功能的影响并探讨其机制。
1 材料与方法 1.1 动物清洁级昆明种小鼠,购于辽宁长生生物有限公司,许可证号: SCXK(辽) : 2010-0001,取新生48 h内小鼠用于实验。
1.2 试剂蛇床子素购于成都普菲德生物有限公司(纯度>98%,批号:JOT-10359),溶于二甲亚砜(dimethyl sulfoxide,DMSO,Sigma公司),终浓度 < 0.01%,用DMEM (Dulbecco′s modified eagle medium,Gibco公司)培养液配成各浓度待用。 胎牛血清(fetal calf serum,FBS,Gibco公司),青-链霉素(penicillin-strepotomycin,P/S,Thermo公司),一抗分别为兔抗NF-M、APP、Aβ1-42、synapsin-1、CAMKK2、p-AMPKα1、AMPKα1、β-actin(北京博奥森);二抗为Cy3 标记驴抗兔 IgG (Jackson)、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG(北京鼎国);4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染液(Sigma),Cell Counting Kit CCK-8 试剂盒(Dojindo),全蛋白提取试剂盒(南京凯基),5×SDS-PAGE蛋白上样缓冲液(南京凯基),ECL检测试剂盒(南京凯基)。
1.3 仪器Ti-S型荧光显微镜 (日本尼康)、超低温冰箱 (青岛海尔,DIV-86L386)、CO2培养箱 (NUAIRE,BPN)、酶标仪 (深圳迈瑞,MR-96A)、紫外-可见光分光光度计 (上海元析,UV-5600)、PCR仪 (杭州朗基,MG96G)、凝胶成像系统 (UVP,GeneGenius)、水平核酸电泳仪(Bio-Rad)、半干式蛋白转膜仪(Bio-Rad)。
1.4 神经元的分离、培养与鉴定取新生 (48 h内) 小鼠大脑并分离出大脑皮层,剪碎并用0.05%胰蛋白酶于37℃消化15 min,终止消化后经筛网过滤,得到细胞悬液。细胞悬液以5×109·L-1的密度接种于经多聚赖氨酸包被过的24孔板中,培养于含有10% FBS和1% P/S的DMEM完全培养基中,置于37℃,5% CO2-95% 空气培养箱中培养。3~4 d后加入4 mg·L-1的阿糖胞苷,48 h后更换新的培养基,以后每3 d半量换液。培养14 d后用兔抗NF-M抗体进行免疫荧光染色,并在倒置荧光显微镜下进行观察鉴定[7]。
1.5 APP基因转染神经元及APP表达的检测将委托北京奥科生物技术有限公司合成含突变位点的APP基因片段用 XbaI 和 NotI 双酶切后插入同样酶切的System Biosciences (SBI)公司的pCDH-CMV-MCS-EF1-copGFP的目标载体构建为慢病毒载体,按实验室所述方法[8, 9]按一定比例将其转染293T (天津医科大学) 包装细胞,对照组转染GFP。培养293T细胞,24 h后荧光显微镜下观察两组细胞都呈现绿色荧光。分别收集72 h内上述293T细胞培养液上清(含病毒),离心、浓缩并检测病毒滴度; 用浓缩的病毒上清感染12 d的神经元; 感染3 d后,用免疫细胞化学法检测APP在神经元中的表达。
1.6 实验分组对照组:感染GFP的神经元;模型组:感染APP-GFP共表达的神经元;给药组:给予24 h 不同浓度(10、50、100 μmol·L-1)Ost的感染APP-GFP共表达的神经元。
1.7 CCK-8检测细胞的活力CCK-8试剂中含有的WST-8在电子偶合试剂存在的作用下,被细胞中线粒体内的脱氢酶还原为具有水溶性的黄色甲臜产物。使用酶标仪在450 nm处测吸光度值来反映活细胞数量。故而将神经元以5×109·L-1的密度接种于经多聚赖氨酸包被过的96孔板中,并以上述分组每组设3个复孔。培养15 d后,每孔加入10 μL CCK-8溶液,37℃孵育4 h,并在450 nm 处检测吸光度。
1.8 免疫荧光细胞化学法观察各组细胞synapsin-1表达经过分组处理的各组神经元,弃去培养基,用4%多聚甲醛室温固定30 min,1×PBS洗3次;1% Triton X-100通透30 min,1×PBS洗3次;加入兔抗synapsin-1(1 ∶ 150)4℃孵育过夜;1×PBS洗3次,加入Cy3标记驴抗兔lgG(1 ∶ 150)孵育1 h;1×PBS洗3次,加入DAPI染色液(1 ∶ 50)孵育15 min。荧光显微镜下观察拍照。
1.9 ELISA法检测各组细胞PSD-95 和SYP 蛋白的表达收集分组处理的各组细胞上清液,按照ELISA试剂盒说明书所示方法,利用酶标仪检测各组在450 nm处的吸光度。
1.10 Western blot 检测Aβ1-42、 CAMKK2、p-AMPKα1、AMPKα1的蛋白表达水平原代培养的神经元,经各组处理后,用冷的PBS冲洗,立即放入预冷的裂解缓冲液中,12 000 r·min-1,离心15 min,取上清,用BSA法测定蛋白质含量,将各组蛋白质浓度调成一致。用10%的分离胶分离蛋白,每个泳道蛋白质上样量为50 μg。电泳后将凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入含5%BSA的TBST中封闭30 min,再用TBST缓冲液洗膜3次。将膜放入装有兔抗Aβ1-42、CAMKK2、p-AMPKα1、AMPKα1、β-actin(1∶1000)抗体的自封袋中,4℃孵育过夜;TBST冲洗3次,将膜放入HRP标记的山羊抗兔的二抗(1∶2 000) 中,室温孵育1 h,然后用 TBST洗膜3次;按试剂盒配制ECL工作液,暗室中将处理好的膜片放入ECL工作液中,反应1-3 min至蛋白的荧光条带可见终止显色;凝胶成像仪观察显色情况,拍照记录,并用Image J软件分析相对灰度。相对灰度=灰度目的蛋白/灰度β-actin。
1.11 统计学分析采用 SPSS 17.0 版统计软件对数据进行处理,所有数据均以  ± s表示,组间采用t检验或单因素方差分析。
± s表示,组间采用t检验或单因素方差分析。
显微镜下观察培养3 d后发现细胞已有神经元形态,大部分已发出突起。14 d后神经元较成熟,经免疫荧光染色可见,神经元胞体饱满,突起较长,连接较紧密(Fig 1)。

|
| Fig 1 Neurons identified by immunofluresence Neurons were immunostained with anti-NF-M antibody (red) and their nuclei were immunostained with DAPI (blue). |
免疫荧光细胞化学法检测经感染3 d后的神经元,结果显示,感染了APP-GFP共表达的神经元和感染了GFP的神经元都明显表达GFP(绿色),效率达95%以上,说明感染成功;但APP(红色)只在APP感染的神经元中明显表达,而在对照组中几乎不表达(Fig 2A)。Western blot 结果显示(Fig 2B),感染了APP-GFP共表达的神经元的Aβ1-42蛋白表达水平较对照组明显升高(P < 0.01),证实了体外构建AD细胞模型的成功。

|
| Fig 2 Accessed of APP and Aβ1-42 expression in lentivirus infected neurons A: Immunocytochemistry staining, DAPI+ nuclei(Blue), GFP+(green), APP+(Red); B: The expreesion of Aβ1-42 assessed by Western blot. |
如Fig 3所示,与对照组相比,模型组的细胞存活率为57.4%(P < 0.01);而给予了不同浓度Ost的给药组的细胞存活率明显升高(P < 0.01),且以给予50 μmol·L-1 Ost的实验组细胞活力更为明显。因此,以下实验均以给予50 μmol·L-1 Ost作为给药组(简称Ost组)。
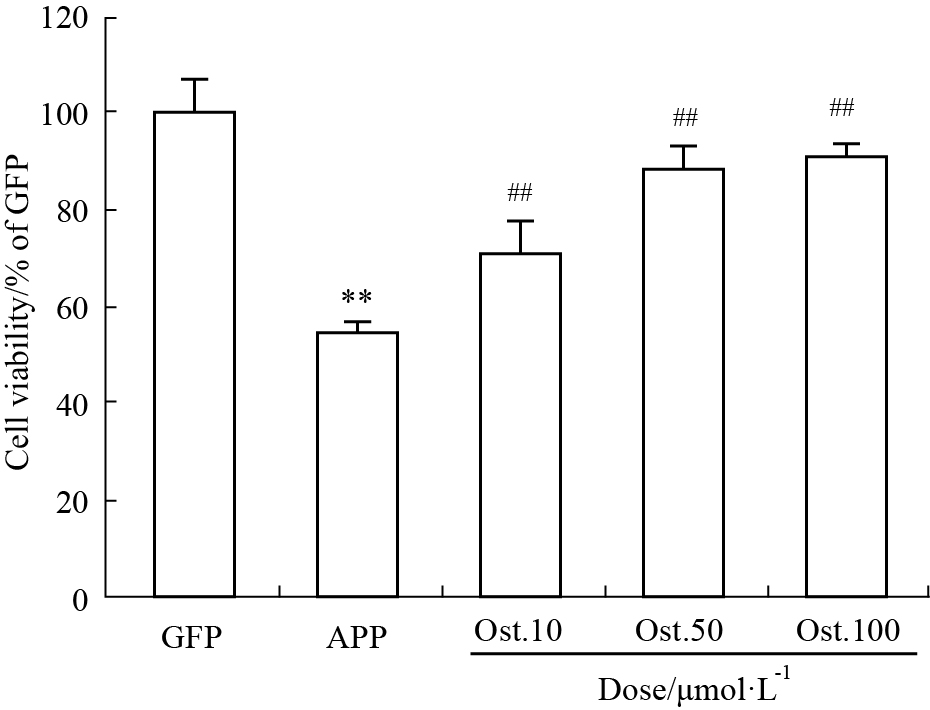
|
| Fig 3 Comparison of cell viability among all groups by CCK-8 **P < 0.01 vs GFP; ##P < 0.01 vs APP. |
通过免疫荧光结果(Fig 4A)发现,对照组的synapsin-1阳性表达较多,突触形态比较明显。模型组的synapsin-1 的荧光强度较弱为(57.00±3.21)%(与对照组相比),而给予Ost 对synapsin-1的表达明显增强,荧光强度达到(79.10±4.01)%,差异具有显著性(Fig 4B)。说明Ost 可对抗感染APP所引起的synapsin-1的减少。

|
| Fig 4 Comparison of expression of synapsin-1 among all groups A: Immunocytochemistry staining, synapsin-1+ (red), DAPI+ nuclei(Blue). B: Quantitative analysis of synapsin-1 immunofluorescence intensity, **P < 0.01 vs GFP; ##P < 0.01 vs APP. |
ELISA结果显示(Fig 5),相比于对照组,模型组的PSD-95和SYP分别下调了44.7 μg·L-1与3.2 μg·L-1 (P < 0.01);而给予了Ost 的给药组与模型组相比2种突触相关蛋白分别上调了20 μg·L-1与2.3 μg·L-1(P < 0.01)。说明Ost 对感染APP造成的突触功能损伤具有保护作用。
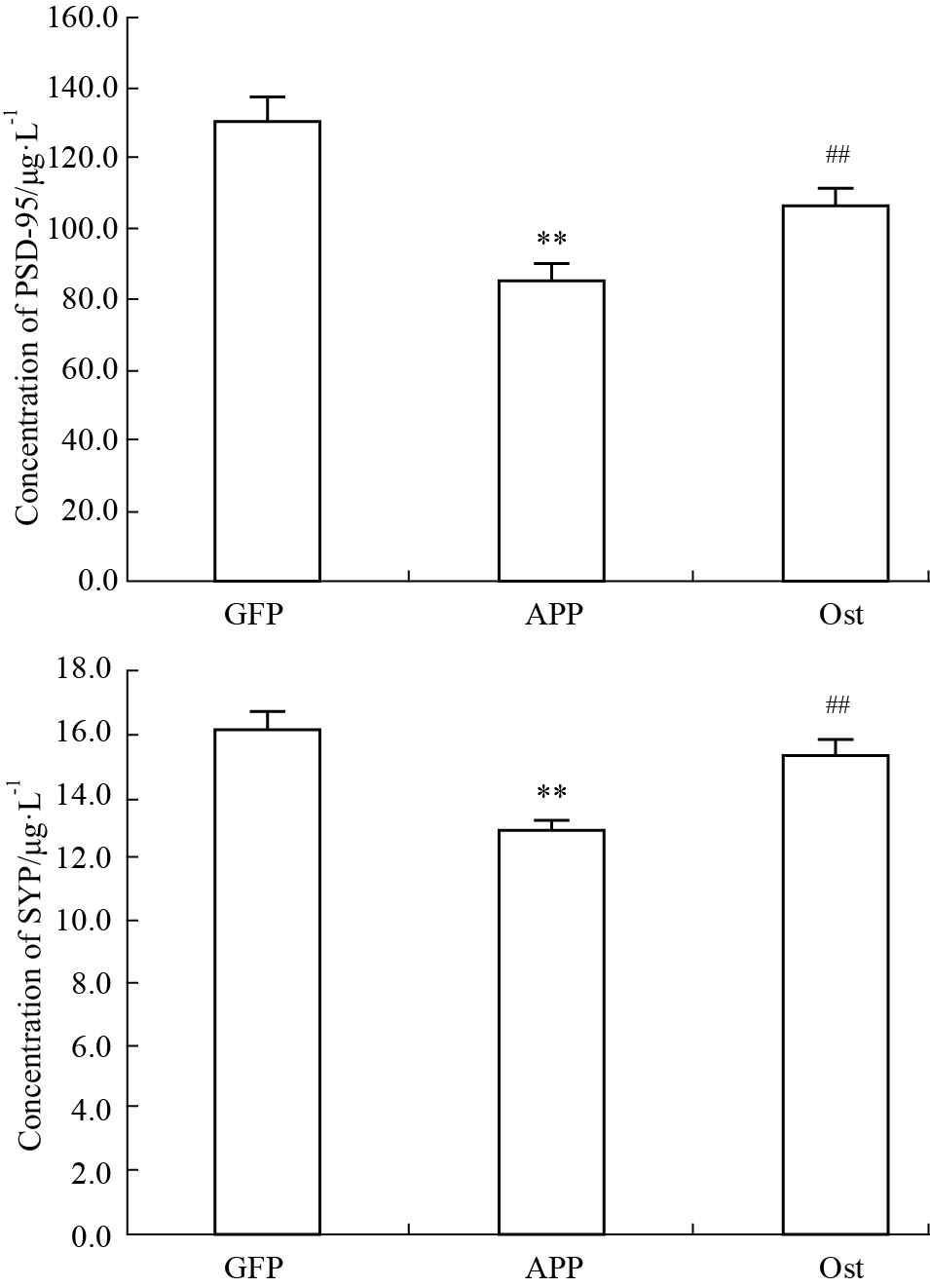
|
| Fig 5 PSD-95 and SYP concentrations measured by ELISA assay **P < 0.01 vs GFP;##P < 0.01 vs APP |
根据Western blot结果可知(Fig 6),与对照组相比,模型组的CAMKK2、p-AMPKα1蛋白的表达量明显增多(P < 0.01),但对AMPKα1无明显影响;而给药组与模型组比较而言,CAMKK2下降明显(P < 0.05),p-AMPKα1下降明显(P < 0.01),对AMPKα1无影响。
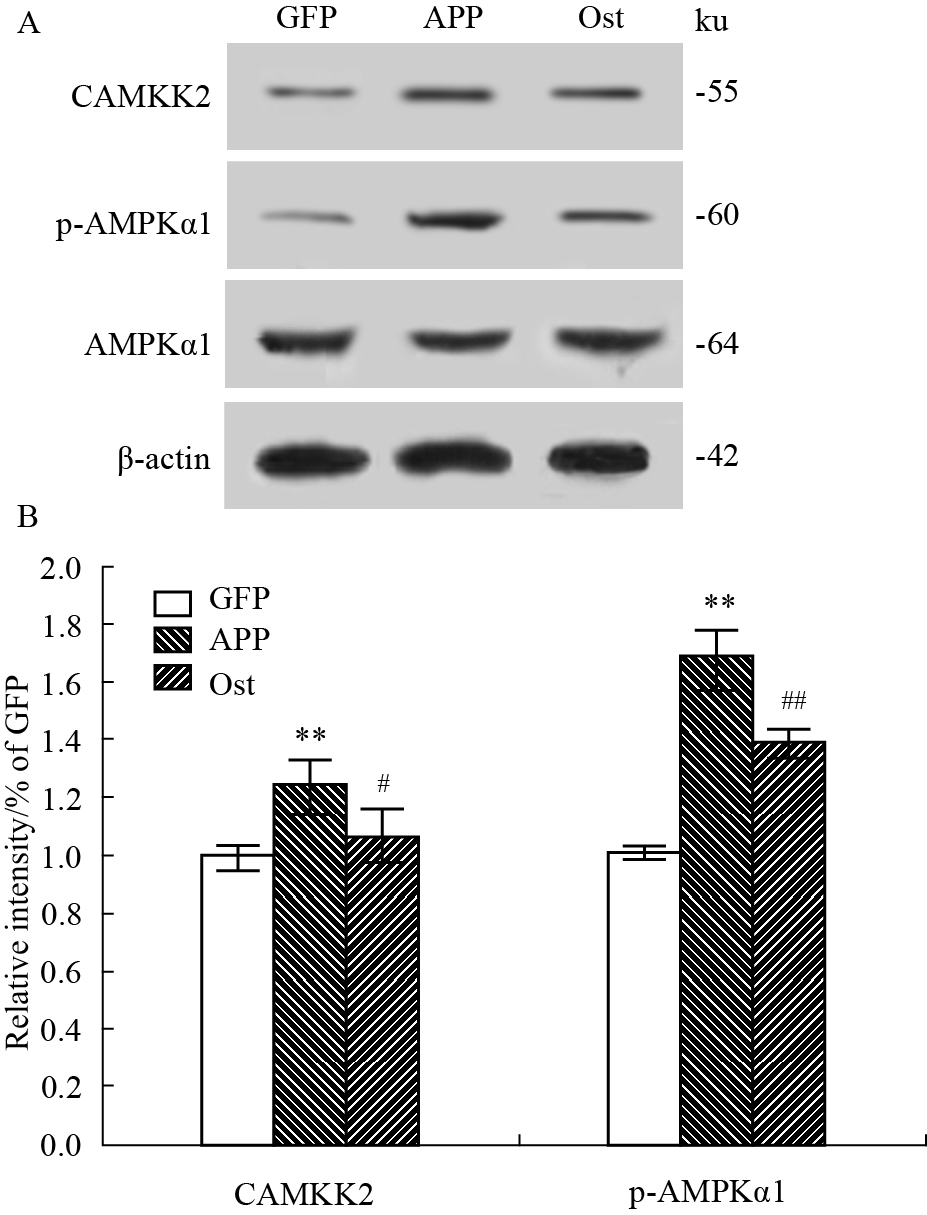
|
| Fig 6 Comparison with relative protein expression of CAMKK2/AMPK **P < 0.01 vs GFP; #P < 0.05,##P < 0.01 vs APP |
阿尔茨海默病是一种神经退行性疾病,主要集中在中老年时期发病。以 β-淀粉样蛋白(Aβ)沉积形成的老年斑(SP)、细胞骨架蛋白 tau 的高度磷酸化产生的神经纤维缠结(NFTs)以及神经元和突触的缺失等为主要病理特征[10, 11, 12]。研究证实,由于位 于21号染色体上的APP基因突变可生成具有神经毒性的Aβ42,所以笔者采用具有突变位点的APP基因转染神经元模拟AD来进行实验。
突触是两个神经元之间的紧密接触并形成特殊结构的功能接触部位,在传递信息方面起重要的作用。研究表明,多种突触相关蛋白一起来维持突触的功能并调控神经递质的释放,其中synapsin-1、SYP位于突触前膜,是有代表性的与突触囊泡相关的蛋白,主要调节神经递质的释放;PSD-95作为重要的骨架蛋白在突触兴奋和维持突触结构和功能可塑性上发挥着重要的作用[13, 14]。研究表明,突触相关蛋白含量的降低与突触的丢失是AD的典型现象[15]。因此本实验在造模成功的基础上用synapsin-1染色来显示观察突触的密度和分布情况,ELISA检测相关蛋白PSD-95和SYP的表达。最后发现Ost能明显逆转感染APP引起的突触相关蛋白的降低,说明Ost能对抗感染APP引起的突触损伤和丢失。
CAMKK2/AMPK信号通路是Aβ42诱导突触毒性过程中非常重要的调控因子,有毒性的Aβ沉积刺激了特定的神经元受体,该受体使Ca2+大量内流从而激活了CAMKK2酶,继而激活了AMPK,作为其中的蛋白质亚型α1上的172位苏氨酸(Thr172)的磷酸化是AMPK激活的主要机制[16, 17, 18, 19]。所以本实验从CAMKK2与pT172-AMPKα1入手来探讨Ost对神经元突触的保护作用,最后Western blot结果发现模型组的CAMKK2与p-AMPKα1蛋白表达量明显升高(P < 0.01),Ost组的蛋白表达量较模型组明显降低,差异有显著性(P < 0.05,P < 0.01)。综上所述,Ost有可能通过抑制CAMKK2/AMPK信号通路来逆转Aβ对神经元突触造成的损伤与丢失,但是具体的机制需要进一步研究。
(致谢:实验在导师杨静娴教授的精心指导,师兄师姐们的热情帮助下顺利进行,论文也在闫老师的辛苦修改下顺利完成。)
| [1] | Selkoe D J.Alzheimer's disease is a synaptic failure[J]. Science, 2002, 298(5594):789-91. |
| [2] | Pannese E. Morphological changes in nerve cells during normal aging[J].Brain Struct Funct, 2011, 216(2):85-9. |
| [3] | 马玉明. 蛇床子素的药理进展及剂型开发[J]. 中国现代药物应用,2008,2(15):112-4. Ma Y M. Pharmacological progress and formulation development of osthole[J]. Chin J Mod Drug App, 2008, 2(15):112-4. |
| [4] | Hu Y, Wen Q, Liang W, et al. Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation[J]. Biol Pharm Bull, 2013, 36(12):1950-8. |
| [5] | 孔亮,姚璎珈,教亚男,等. 蛇床子素对机械性脑损伤小鼠的抗炎抗凋亡作用研究[J]. 中国药理学通报,2015,31(7):999-1004. Kong L, Yao Y J, Jiao Y N, et al. Anti-apoptosis and anti-inflammatory effect of osthole in mice following stab would injury[J]. Chin Pharmacol Bull, 2015, 31(7):999-1004. |
| [6] | Gao Z, Wen Q, Xia Y,et al. Osthole augments therapeutic efficiency of neural stem cells-based therapy in experimental autoimmune encephalomyelitis[J]. J Pharmacol Sci, 2014, 124(1):54-65. |
| [7] | 周 明,聂 菁,吕 诚,胡小令. 一种大鼠海马神经元的原代培养方法[J]. 南昌大学学报(医学版),2010,50(3):1-3. Zhou M, Nie J, Lyu C, Hu X L. A cultural method of hippocampal neurons of rats[J]. J Nanchang Unv (Med Sci), 2010, 50(3):1-3. |
| [8] | Yang J, Jiang Z, Fitzgerald D C, et al. Adult neural stem cells expressing IL-10 confer potent immunomodulation and remyelination in experimental autoimmune encephalitis[J]. J Clin Invest, 2009, 119(12):3678-91. |
| [9] | Yang J, Yan Y, Xia Y, et al. Neurotrophin 3 transduction augments remyelinating and immunomodulatory capacity of neural stem cells[J]. Mol Ther, 2014, 22(2):440-50. |
| [10] | Kudinov A R, Khdinova N V, Kezlia E V, et al. Compensatory mechanisms to heal neuroplasticity impairment under Alzheiemer's disease neurodegeneration.I:The role of amyloid beta and its' precursor protein[J].Biomed Khim, 2012, 58(4):385-99. |
| [11] | Malthankar-Phatak G H, Lin Y G, Giovannone N, Siman R. Amyloid deposition and advanced age fails to induce Alzheimer's type progression in a double knock-in mouse model[J]. Aging Dis, 2012, 3(2):141-55. |
| [12] | Wilcock D M, Gharkholonarehe N, Van Nostrand W E, et al. Amyloid reduction by amyloid-beta vaccination also reduces mouse tau pathology and protects from neuron loss in two mouse models of Alzheime's disease[J]. J Neurosci, 2009, 29(25):7957-65. |
| [13] | Woods G F, Oh W C, Boudewyn L C, et al. Loss of PSD-95 enrichment is not a prerequisite for spine retraction[J]. J Neuroscience, 2011, 31:12129-38. |
| [14] | Sheng M, Hoogenraad CC. The postsynaptic architecture of excitatory synapses:amore quantitative view[J]. Annu Rev Biochem, 2007, 76:823-47. |
| [15] | Chen Y, Wang B, Liu D, et al. Hsp90 chaperone inhibitor 17-AAG attenuates Aβ-induced synaptic toxicity and memory impairment[J]. J Neurosci, 2014, 34(7):2464-70. |
| [16] | 杨子初,廖焌伶. AMPK在转化医学研究中的意义与展望[J]. 中国细胞生物学学报,2013,35(3):357-66. Yang Z C, Liao J L. Implication and prospect of AMPK in translational medical research[J]. Chin J Cell Biol, 2013, 35(3):357-66. |
| [17] | 贺文彬,张俊龙,于龙川,陈乃宏. 钙调素依赖性蛋白激酶Ⅱ的分子调节与突触可塑性[J]. 中国药理学通报,2014,30(7):897-901. He W B, Zhang J L, Yu L C, Chen N H. CAMKⅡ:A molecular switch of synaptic plasticity[J]. Chin Pharmacol Bull, 2014, 30(7):897-901. |
| [18] | Mairet-Coello G, Courchet J, Pieraut S, et al. The CAMKK2-AMPK kinase pathway mediates the synaptotoxic effects of Aβ oligomers through Tau phosphorylation[J]. Neuron, 2013, 78(1):94-108. |
| [19] | Chang F, Zhang L H, Xu W P, et al. microRNA-9 attenuates amyloidβ-induced synaptotoxicity by targeting calcium/calmodulin-dependent protein kinase kinase 2[J]. Mol Med Rep, 2014, 9(5):1917-22. |

