


2. 上海交通大学医学院, 上海 200233
张庆勇(1972-),男,博士,副教授,硕士生导师,研究方向:糖尿病心律失常发病机制,E-mail:zhang_qingyong71@hotmail.com
2. Shanghai Jiaotong University School of Medicine, Shanghai 200233, China
他汀类药物(statins),羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,已成为临床上治疗高脂血症和降低心血管疾病发病率及死亡率的一线药物。大型临床数据研究发现,急性心肌梗死后(AMI)早期使用他汀类药物能明显提高AMI后1年生存率[1]。近年研究发现,他汀类药物的一些额外收益并非完全归功于其降低血脂作用[2]。临床数据和基础实验已经证实在发生心衰情况下,活性氧类物质增多,其参与脂质过氧化物的形成,破坏细胞膜,降低内源性的抗氧化防御系统[3, 4]。因此,通过有效的干预手段抑制自由基的产生或增强抗氧化防御系统或许可以改善心功能。
近来实验发现,丝氨酸/苏氨酸激酶(Akt)及其下游靶蛋白eNOS(内皮型一氧化氮合酶)参与调控缺血组织血管再生及改善缺血组织血流动力学异常改变[5, 6, 7]。但是在AMI情况下,辛伐他汀对内源性抗氧化系统的影响还鲜有报道,同时对他汀类药物心肌保护作用的研究大多数集中在心梗后重构期[8]。所以本实验制作大鼠急性心肌梗死模型,观察辛伐他汀对急性期内源性抗氧化系统的影响及其与Akt/eNOS通路的关系,探讨辛伐他汀改善心肌梗死后急性期心功能的潜在分子机制。
1 材料与方法 1.1 药物与试剂辛伐他汀(批号100035)由默沙东公司提供;抗磷酸化的Akt(p-Aktser473)及磷酸化的eNOS(p-eNOSser1177)购自Cell Signaling Technology 公司;BCA蛋白定量试剂盒购自碧云天公司;化学发光试剂购自Millipore公司。SOD与GP试剂盒购自南京建成生物工程研究所。
1.2 动物模型建立与分组健康SD ♂大鼠(上海西普尔-必凯实验动物有限公司提供),体质量200~250 g。将5%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉大鼠,背位固定,行气管切开并连接到微型动物呼吸机(ALC-V8,上海奥尔科特生物科技有限公司)行呼吸支持,使用GE Pruka Mac-Lab2000心电生理工作站(GE,美国)实时记录常规肢体导联及V1、V3、V6胸前导联心电图。于大鼠胸骨左缘第3-4肋间开胸,暴露心脏,剪开心包膜,于左心耳及肺动脉圆锥之间距左心耳下缘1-2 mm处穿线(6/0丝线)结扎冠状动脉左前降支。结扎成功的标志:心电图Ⅱ导联J点明显抬高和结扎线以下心肌组织颜色由正常变苍白。另设假手术组(Sham组,n=12),在相同位置只挂线不结扎。24 h后存活的SD大鼠随机分为心肌梗死组(MI组,n=12),辛伐他汀组(Sim组,n=12,20 mg·kg-1·d-1),剂量参考文献[8]。Sim组术后24 h以辛伐他汀(批号100035,默沙东公司)灌胃,连续7 d。Sham组和MI组以等量的生理盐水灌胃。
1.3 血流动力学测定7 d后以同样的方法进行腹腔麻醉。分离右颈总动脉,经右颈总动脉插入PE-20导管至左心室,导管另一端经能量转换器连接MPA-2000生理记录仪,测定心率(HR)、左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室压力最大上升和下降速率(±LVdp/dtmax)。
1.4 血脂、心肌损伤标记物及抗氧化系统标记物测定血流动力学测定完之后开腹,在腹腔静脉处取血5 mL,离心取上清送至上海市第六人民医院检验科,测定胆固醇(TG)、甘油三酯(TC)、肌钙蛋白I(c-TnI)、乳酸脱氢酶(LDH)水平,同时用ELISA试剂盒测定超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GP)水平。
1.5 Western blot检测心肌p-Akt/p-eNOS的表达提取心肌蛋白样本,采用BCA蛋白定量试剂盒测定蛋白浓度,调至等浓度后加入上样缓冲液混合,离心后上样。恒压80 V电泳,30 min后改为恒压120 V至电泳结束。将蛋白转至PVDF膜上(恒流250 mA,4℃转膜2 h),用5%脱脂奶粉室温封闭3 h,加入相应一抗,在摇床上4℃孵育过夜,0.1%TBST洗膜3次后加相应二抗室温孵育2 h,洗膜后显色,使用凝胶成像系统拍照分析,计算各条带OD值,以靶蛋白与内参蛋白的OD值比值代表相应蛋白的表达量。
1.6 统计学分析采用SPSS 17.0软件进行统计学分析,计量资料以x±s 表示,多组间比较采用方差检验,两两比较分析采用LSD-q检验。
2 结果 2.1 各组血流动力学比较与Sham组相比,MI组LVEDP明显升高,LVdp/dtmax,LVdp/dtmin及LVSP却明显降低(P < 0.05)。与MI组相比,Sim组明显改善心功能,逆转血流动力学这些异常指标(P < 0.05)。HR在各组间差异无统计学意义(P>0.05),见Tab1。
| Group | LVSP/kPa | LVEDP/kPa | LVd p/LVd t max/kPa·s -1 | LVd p/LVd t min/kPa·s -1 | HR/bpm·min -1 |
| Sham | 15.86±0.98 | 0.39±0.09 | 1243.82±104.51 | 810.06±78.51 | 438.00±5.20 |
| MI | 12.26±0.88 * | 0.77±0.15 * | 739.95±28.39 * | 574.12±30.66 * | 456.00±19.40 |
| Sim | 15.32±0.79 # | 0.43±0.11 # | 1179.44±79.98 # | 785.27±94.78 # | 451.00±13.10 |
| * P<0.05 vs Sham group;# P<0.05 vs MI group | |||||
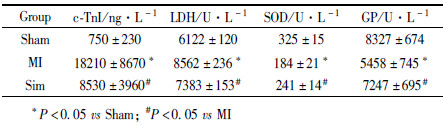
与Sham组相比,MI组TG和TC均呈上升趋势,但差异未达到统计学意义(P>0.05)。与MI组相比,Sim组TG和TC呈下降趋势,差异也未达到统计学意义(P>0.05)。
2.3 各组心肌损伤标记物及抗氧化系统标记物测定与Sham组相比,MI组血清c-TnI和LDH水平明显升高(P < 0.05),与MI组相比,Sim组c-TnI和LDH水平明显降低(P < 0.05),但较Sham组升高(P < 0.05)。与Sham组相比,MI组血清SOD和GP水平明显降低(P < 0.05),与MI组相比,Sim组SOD和GP水平明显升高(P < 0.05),但较Sham组降低(P < 0.05),见Tab2。
 |
|
| Fig.1 Effect of simvastatin on lipid level in rats (n=12) Lipid levels of the rats in the three groups were detected by Elisa kit. The data showed that there was no significant difference in the serum levels of TG and TC in each group. |
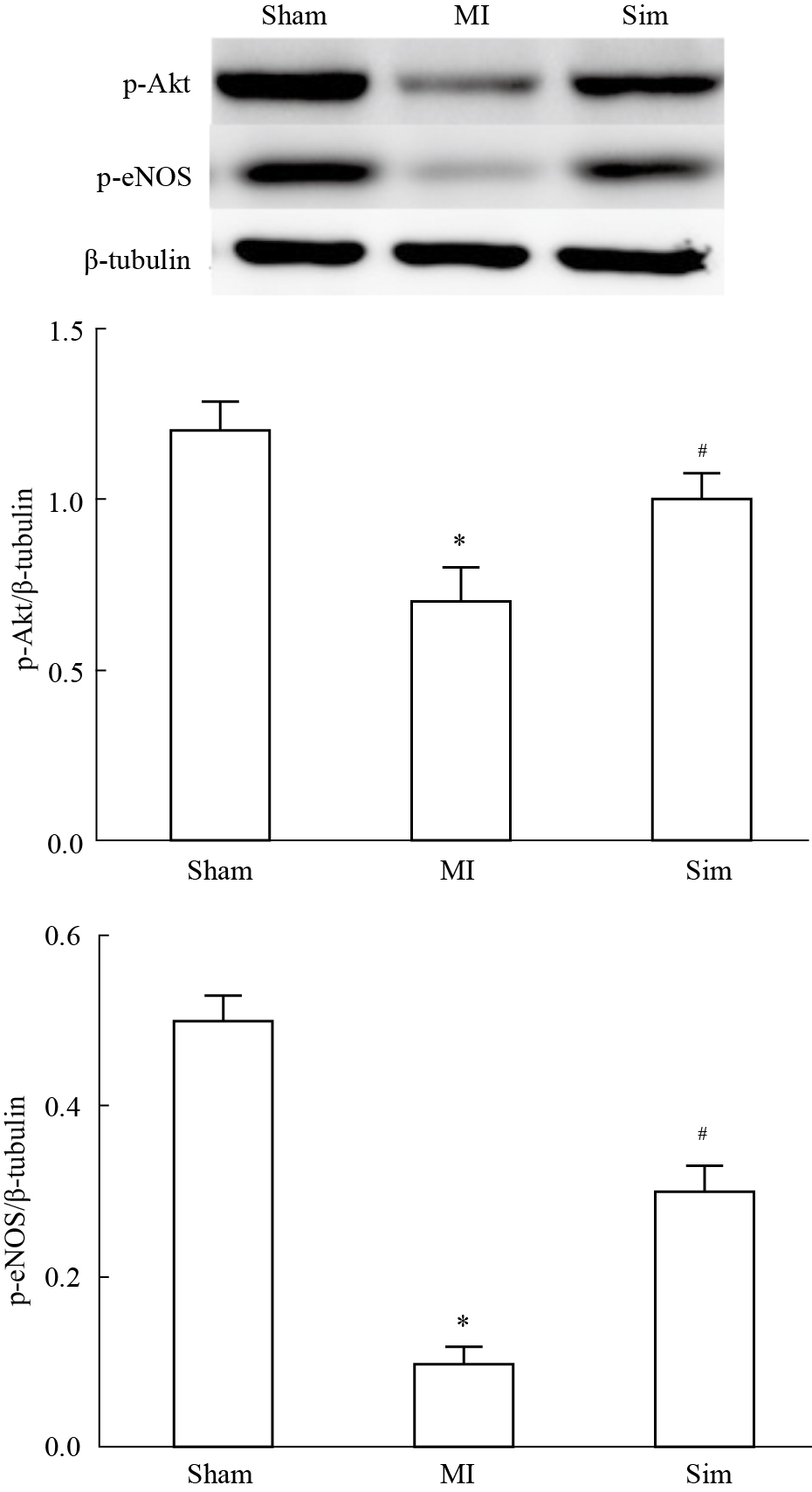
与Sham组相比,MI组p-Akt水平明显降低(P < 0.05),与MI组相比,Sim组p-Akt水平明显升高(P < 0.05)。与Sham组相比,MI组p-eNOS水平明显降低(P < 0.05),与MI组相比,Sim组p-eNOS水平明显升高。
|
| Fig.2 Effect of simvastatin on p-Akt and p-eNOS expression in rats (n=12) The protein levels of p-Akt and p-eNOS were examined by Western blot. One of three representative experiments is shown. Data are the mean ±SD of band intensities volume/tubulin intensities volume from three different experiments. *P<0.05 vs Sham group; #P<0.05 vs MI group |
本实验观察到急性心肌梗死后急性期心功能明显降低,LVSP,±LVdp/LVdtmax明显降低 ,LVEDP升高,用辛伐他汀20 mg·kg-1连续灌胃7 d可以明显改善心功能。急性心肌梗死后,细胞坏死释放大量肌钙蛋白I[9, 10],急性心肌梗死后使用辛伐他汀可以明显降低c-TnI水平[11]。LDH也是诊断心肌损伤的标志物,当细胞膜通透性升高或者破裂,胞质内的LDH就会释放到细胞外,血清浓度也随之升高。前期研究也表明发生心肌梗死大鼠,血清LDH浓度会明显升高,本次研究结果和前期研究结果一致[12]。使用辛伐他汀可以明显减少LDH水平,表明辛伐他汀可以保持细胞膜完整性,从而限制胞质内LDH外溢。所以,辛伐他汀改善心功能或许和稳定细胞膜完整相关,减少心肌细胞的破坏。
急性心肌梗死可引起严重的氧化应激反应,进而导致心肌细胞的坏死。活性氧类物质的增多或者抗氧化防御系统能力的减弱都会加重心肌细胞的坏死,加重心肌病理生理变化[13]。Zhou等[14]报道氟伐他汀可以减少心肌细胞氧化物质产生,增加抗氧化系统性能。这和此次试验结果一致,SOD和GP在MI组都明显降低,辛伐他汀处理可以明显提升SOD和GP水平,表明急性期使用辛伐他汀可以增强内源性抗氧化防御系统,加快应激状态下自由基的清除,减少心肌损伤,从而改善心梗急性期心功能,此外也表明辛伐他汀的心脏保护作用机制可能与增加SOD和GP水平有关。
蛋白激酶B(PKB/Akt)是一种多功能调控因子,参与内皮细胞的生长、生存等调节。在缺血/再灌注动物模型中,激活Akt可以减少心肌细胞凋亡[15]。Kureishi等[7]研究表明,在正常血脂的动物中,辛伐他汀可以明显改善缺血肢体的血流动力学参数,促进血管再生。进一步研究发现,Akt/eNOS信号通路在此过程中扮演着举足轻重的作用。在本次实验中,我们也观察到辛伐他汀改善急性期心肌梗死大鼠血流动力学参数,同时也发现辛伐他汀组提高p-Akt和p-eNOS水平。所以据此推测辛伐他汀促进心梗后大鼠心肌Akt激活,从而使血管内皮细胞生成NO增加,促进血管扩张,增加缺血心肌的灌注,从而改善心功能。NO还可以抑制血小板的聚集、炎症反应和平滑肌细胞增殖。此外,Akt是血管内皮细胞生长因子(VEGF)下游靶蛋白,在Kureishi等研究中发现激活Akt发挥血管再生作用,因此,在本次实验中不能排除Akt也发挥同样的作用进而改善心功能。故激活Akt途径加快再内皮化和增加NO合成体现了心肌梗死早期使用他汀类药物保护益处。总之,这些潜在的心脏保护作用机制或许可以部分解释辛伐他汀改善急性期心功能的分子机制。当然还有其他许多机制,如辛伐他汀减少心梗后心肌细胞凋亡和减轻心肌细胞水肿参与心功能的改善[16]。
综上所述,本实验证实辛伐他汀对心肌梗死大鼠急性期具有重要的保护作用,增加血清SOD和GP水平,降低c-TnI和LDH水平和激活Akt/eNOS信号通路都参与其中。这为早期使用他汀类药物治疗急性心肌梗死改善心功能提供了重要的实验依据。至于辛伐他汀调节Akt磷酸化和Akt促进eNOS磷酸化增加NO释放的具体过程还是不清楚,需要以后的进一步研究。
(致谢:本文所有实验过程及数据都是在上海市第六人民医院心血管内科实验室完成,在此感谢实验室研究员卿艳维老师在实验中给予的帮助。)
| [1] | Stenestrand U, Wallentin L. Early statin treatment following acute myocardial infarction and 1-year survival[J]. JAMA, 2001, 285(4):430-6. |
| [2] | Adameova A, Harcarova A, Matejikova J, et al. Simvastatin alleviates myocardial contractile dysfunction and lethal ischemic injury in rat heart independent of cholesterol-lowering effects[J]. Physiol Res, 2009, 58(3):449-54. |
| [3] | Rajadurai M, Prince P S. Preventive effect of naringin on isoproterenol-induced cardiotoxicity in Wistar rats:an in vivo and in vitro study[J]. Toxicology, 2007, 232(3):216-25. |
| [4] | Rajadurai M, Stanely Mainzen Prince P. Preventive effect of naringin on cardiac markers, electrocardiographic patterns and lysosomal hydrolases in normal and isoproterenol-induced myocardial infarction in Wistar rats[J]. Toxicology, 2007, 230(2-3):178-88. |
| [5] | Fujio Y, Walsh K. Akt mediates cytoprotection of endothelial cells by vascular endothelial growth factor in an anchorage-dependent manner[J]. J Biol Chem, 1999, 274(23):16349-54. |
| [6] | Datta S R, Brunet A, Greenberg M E. Cellular survival:a play in three Akts[J]. Genes Dev, 1999, 13(22):2905-27. |
| [7] | Kureishi Y, Luo Z, Shiojima I, et al. The HMG-CoA reductase inhibitor simvastatin activates the protein kinase Akt and promotes angiogenesis in normocholesterolemic animals[J]. Nat Med, 2000, 6(9):1004-10. |
| [8] | 胥雪莲, 覃 数, 雷 寒, 等. 辛伐他汀改善大鼠心肌梗死后心室重塑与p-ERK1/2的关系[J]. 中国药理学通报, 2008, 24(2):258-61. Xu X L, Qin S, Lei H, et al. Simvastatin ameliorates rat ventricular remodeling after myocardial infarction:the role of phosphorylating extracellular signal-regulated kinase1/2[J]. Chin Pharmacol Bull, 2008, 24(2):258-61. |
| [9] | Li X D, Yang Y J, Geng Y J, et al. The cardioprotection of simvastatin in reperfused swine hearts relates to the inhibition of myocardial edema by modulating aquaporins via the PKA pathway[J]. Int J Cardiol, 2013, 167(6):2657-66. |
| [10] | Yao H C, Zhao A P, Han Q F, et al. Correlation between serum high-mobility group box-1 levels and high-sensitivity C-reactive protein and troponin I in patients with coronary artery disease[J]. Exp Ther Med, 2013, 6(1):121-4. |
| [11] | Yao H C, Yang L J, Han Q F, et al. Postconditioning with simvastatin decreases myocardial injury in rats following acute myocardial ischemia[J]. Exp Ther Med, 2015, 9(4):1166-70. |
| [12] | Gurgun C, Ildizli M, Yavuzgil O, et al. The effects of short term statin treatment on left ventricular function and inflammatory markers in patients with chronic heart failure[J]. Int J Cardiol, 2008, 123(2):102-7. |
| [13] | Nakamura T, Nishi H, Kokusenya Y, et al. Mechanism of antioxidative activity of fluvastatin-determination of the active position[J]. Chem Pharm Bull (Tokyo), 2000, 48(2):235-7. |
| [14] | Zhou R, Xu Q, Zheng P, et al. Cardioprotective effect of fluvastatin on isoproterenol-induced myocardial infarction in rat[J]. Eur J Pharmacol, 2008, 586(1-3):244-50. |
| [15] | Fujio Y, Nguyen T, Wencker D, et al. Akt promotes survival of cardiomyocytes in vitro and protects against ischemia-reperfusion injury in mouse heart[J]. Circulation, 2000, 101(6):660-7. |
| [16] | Luo K Q, Long H B, Xu B C. Reduced apoptosis after acute myocardial infarction by simvastatin[J]. Cell Biochem Biophys, 2015, 71(2):735-40. |
