


2. 湖北医药学院药理教研室,湖北 十堰 442000;
3. 湖北医药学院武当特色中药湖北省重点实验室,湖北 十堰 442000
 , TAN Yan2, WANG Xuan-bin3, PAN Long-rui2, LI Hong-liang3, LIU Hui1, XIANG Ji-zhou1, FU Qin1
, TAN Yan2, WANG Xuan-bin3, PAN Long-rui2, LI Hong-liang3, LIU Hui1, XIANG Ji-zhou1, FU Qin1

2. Dept of Pharmacology,Hubei University of Medicine,Shiyan Hubei 442000,China;
3. Hubei Key Laboratory of Wudang Local Chinese Medicine Research(Hubei University of Medicine,Shiyan Hubei 442000 China
研究表明,再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)信号系统,包括细胞外信号调节激酶(ERK)、磷酸肌醇3激酶(PI3K)-蛋白激酶Akt途径,p38及丝氨酸激酶JNK等[1],在缺血/再灌中对心肌细胞起重要的保护作用,是治疗急性心梗(acute myocardial infarction,AMI)的新靶点。在再灌初期,加入PI3K的抑制剂可取消缺血后处理(ischemic postconditioning)的心肌保护作用[2]。ERK抑制剂也会取消缺血预适应(ischemic preconditioning)的心肌保护作用[3],提示再灌注后的补救激酶系统在缺血/再灌损伤中起着重要的保护作用,也是缺血预适应与缺血后处理共同激活的激酶系统[2, 4, 5],是缺血预适应与缺血后处理提供保护作用的共同通路。RISK信号系统的上游是G蛋白偶联受体[1],而β受体是GPCRs家族中的一员,提示β受体可能在保护心肌缺血/再灌注损伤中起重要的作用。克伦特罗(clenbuterol,Clen)作为β2受体激动剂,对血管、支气管、子宫平滑肌都有舒张作用[6]。近年来的研究发现,clenbuterol对心肌细胞具有促“生理”性增生肥大作用[7]。而对右心衰后右心收缩功能有改善作用。临床上已将clenbuterol应用于心力衰竭患者除去左室辅助装置后的恢复治疗[8]。虽然Burniston等[9, 10]报道clenbuterol可诱导正常健康大鼠心肌出现凋亡,但Xydas等[11]和Ahmet等[12]发现clenbuterol及其他选择性β2受体激动剂fenoterol 或zinterol等可改善冠脉左前降支(LAD)结扎后的心室舒张功能。Clenbuterol还可减少缺血性心肌病左室重塑,降低心肌细胞凋亡,改善钙稳态等;另外,clenbuterol还可上调暂时性前脑缺血模型中的Bcl-2/Bax[13]。而本课题组已经报道clenbuterol对缺血/再灌注的心肌细胞有抗凋亡作用[14, 15],但clenbuterol 对缺血/再灌注损伤的保护作用是否与RISK通路有关,需进一步探索。 本实验拟采用原代培养心肌细胞,建立缺氧/复氧实验模型以模拟缺血/再灌注损伤,观察clenbuterol对缺氧/复氧损伤的作用,并采用PI3K/Akt抑制剂LY294002和ERK1/2抑制剂PD98059,探索clenbuterol对缺氧/复氧损伤的保护作用是否与RISK信号通路有关。
1 材料与方法 1.1 药品与试剂高糖DMEM培养基购自Gibco公司;胎牛血清(fetal calf serum,FCS)购自杭州四季青公司;胰蛋白酶购自Amerco公司;PD98059(167869-21-8)和LY294002(154447-36-6)购自Promega corporation公司; ICI 118,551、克伦特罗(clenbuterol) (批号:MFCD00083280)、胶原酶I(批号:MFCD00130830)和 Hoechst33342(批号:MFCD00012678)购自Sigma;LDH试剂盒购自南京建成生物工程研究所;ROS试剂盒购自碧云天生物技术研究所;其他试剂均为市售分析纯。
1.2 乳鼠原代心肌细胞培养取新生1~2 d Wistar 乳鼠(由华中科技大学同济医学院实验中心提供),在无菌条件下,在其剑突下剪开十字切口,取下心脏下1/3,用预冷D-Hanks洗去残血,将心肌组织剪碎,并用冷D-Hanks清洗3遍,加入0.08%胰酶37℃消化1次,然后以0.08%胶原酶37℃消化数次,每次10 min,弃去第1次消化所得上清液,收集其余几次消化所得上清液,以1 ∶ 1(体积)加入含10%胎牛血清高糖DMEM终止消化,1 000 r·min-1离心10 min,弃去上清,以含10%胎牛血清高糖DMEM重悬细胞,接种于50 mL培养瓶中,用差速贴壁法于CO2培养箱中培养90 min,使成纤维细胞贴壁,然后转移细胞悬液并计数,调整细胞密度至2×108·L-1,并加入终浓度为0.1 mmol·L-1 5-BrdU (Sigma-Aldrich)以抑制成纤维细胞的生长,接种至24、96或6孔板内,置入CO2细胞培养箱,培养3 d后,更换无血清的培养基同步化12h开始做实验。
1.3 建立心肌细胞缺氧/复氧(anoxia/reoxygenation,A/R)损伤模型心肌细胞生长接近融合状态,呈现同步搏动时开始实验。模拟缺血溶液(mmol·L-1:NaCl 98.5,KCl 10,NaCl 98.5,KCl 10,MgSO4 1.2,CaCl2 1.0,HEPES 20,sodium lactate 40,pH 6.8)。以95%N2+5%CO2预饱和1 h,将培养的细胞以拟缺血溶液置换无血清的培养基,并置于95%N2+5%CO2,37℃的密闭容器中,持续正压通混合气95%N2+5%CO2,为心肌细胞缺氧即缺血;然后恢复心肌细胞的有糖复氧液(mmol·L-1:NaH2PO4 0.9,NaHCO3 20.0,CaCl2 1.0,MgSO4 1.2,HEPES 20.0,NaCl 129.5,KCl 5.0,glucose 5.5,pH 7.4,37℃)[16]于37℃,95%空气+5%CO2的培养箱中培养,为心肌细胞复氧即再灌。心肌细胞缺氧培养4 h和复氧培养2 h后做相应指标的检测。
1.4 实验分组实验分组:①正常培养组(Normal组):心肌细胞以10%高糖DMEM培养,不进行A/R处理;②缺氧/复氧(A/R)组: 心肌细胞缺氧(采用上述的缺血溶液培养并在37℃,95%N2+5%CO2)培养4 h,复氧(采用上述有糖复氧液在37℃,95%空气+5%CO2的培养箱中)培养2 h; ③clenbuterol (1 μmol·L-1)+A/R组:缺氧前30 min加入clenbuterol,缺氧/复氧时加入相应终浓度的clenbuterol,缺氧/复氧方法同A/R组; ④ICI118,551(10 μmol·L-1)+clenbuterol(1 μmol·L-1)+A/R组;⑤美托洛尔(metoprolol 10 μmol·L-1)+clenbuterol (1μmol·L-1) + A/R组;⑥ Metoprolol(10 μmol·L-1) + A/R组;⑦PD98059(20 μmol·L-1)+ clenbuterol(1 μmol·L-1)+A/R组;⑧ LY294002(10 μmol·L-1)+ clenbuterol(1 μmol·L-1)+ A/R组;相应浓度的β2受体阻断剂ICI118,551,ERK抑制剂PD98059和PI3K抑制剂LY294002在clenbuterol前30 min预给予,其他同clenbuterol (1 μmol·L-1)+A/R组。
1.5 MTT 法检测细胞存活率细胞存活率通过活细胞中线粒体琥珀酸脱氢酶将MTT还原紫色结晶物甲臜(Formazan)的量来判断。按实验分组作相应处理,处理结束后,每孔加入终浓度为0.5 g·L-1 MTT,37℃孵育4 h后,吸弃上清液,PBS 洗1次,加入150 μL DMSO,待结晶完全溶解后,以620 nm为参比,用酶标仪在波长570 nm 测定吸光度值(OD),按公式:细胞存活率/%=(测定孔OD-空白孔OD)/(对照孔OD-空白孔OD)×100%。
1.6 培养液中LDH测定造模给药处理后收集培养液,按LDH试剂盒说明操作,采用化学比色法测定LDH的释放量。
1.7 ROS的测定原代心肌细胞按上述实验分组处理结束后,用温HBSS/Ca/Mg液轻柔洗心肌细胞1次,96孔板每孔加入100 μL的终浓度为10 μmol·L-1的DCFH-DA,37℃细胞培养箱内孵育20 min,用温HBSS/Ca/Mg液轻柔洗心肌细胞3次,用荧光酶标仪测定OD值,DCFH-DA波长选择Ex/Em:488/525 nm。阳性对照孔中加入终浓度100 μmol·L-1的H2O2,37℃细胞培养箱内孵育3 h。
1.8 Western blot检测心肌细胞P-ERK的水平经处理后用RIPA裂解细胞,BCA法蛋白定量。将蛋白样本进行SDS-PAGE凝胶电泳,转膜至PVDF膜,5%牛血清蛋白(BSA)室温封闭1 h,加入p-ERK和ERK2一抗,4℃孵育过夜,二抗室温孵育1h。加入ECL反应体系,曝光,成像,利用 Syngene 凝胶成像分析系统,计算磷酸化蛋白与总蛋白的比值。
1.9 统计学处理采用SPSS 13.0软件包对数据进行统计分析,数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较用LSD (least significant difference)检验。
2 结果 2.1 不同浓度的clenbuterol对缺氧/复氧后心肌细胞存活率的影响结果显示,缺氧/复氧组与正常对照组相比,细胞存活率降低(60.40%±1.60%,P < 0.01)。而不同浓度的clenbuterol(0.1、1、10 μmol·L-1)+A/R组与A/R组相比,只有clenbuterol(1 μmol·L-1)+ A/R组的细胞存活率与A/R组间差异有显著性(70.67%±4.81% vs 60.40%±1.60%,P < 0.05),这为clenbuterol浓度的选择提供依据(Fig1)。
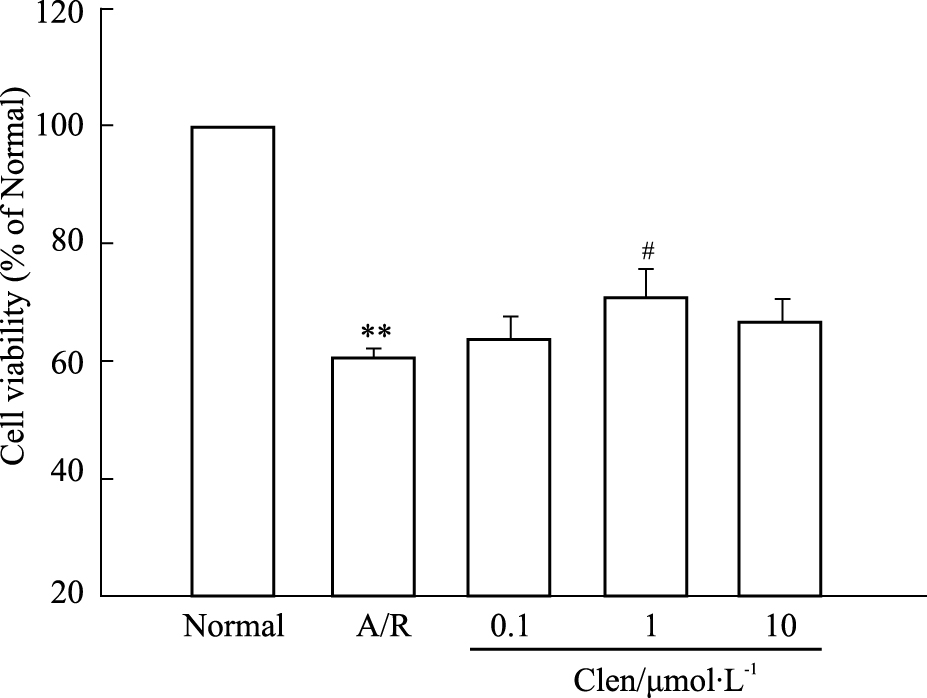
|
| Fig.1 Effect of different concentrations of clenbuterol on viability of cardiomycytes subjected to 4 h of anoxia/2h of reoxygenation (A/R) **P < 0.01 vs normal; #P < 0.05 vs A/R; Clen:clenbuterol |
缺氧/复氧组与正常对照组相比细胞存活率明显降低,培养液中LDH释放量增高(P < 0.01);clenbuterol+A/R组、metoprolol+A/R组和clenbuterol+metoprolol+A/R组与A/R组相比,细胞存活率增高,LDH释放量减少(P < 0.05);而ICI 118,551+clenbuterol+A/R组与A/R组差异无显著性(Fig2、3)。
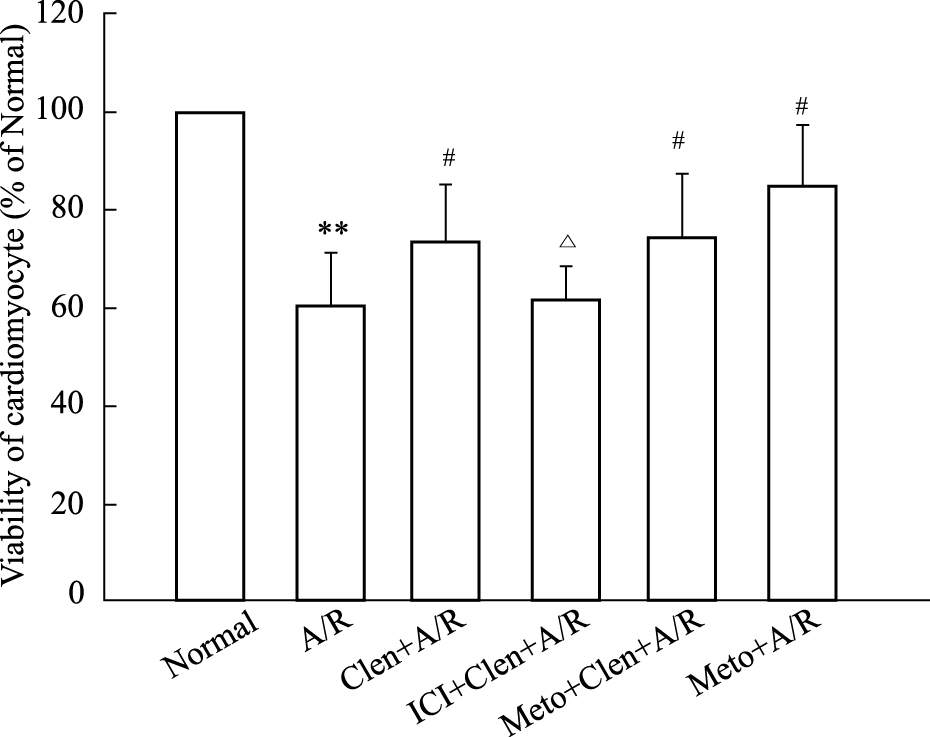
|
| Fig.2 Effect of clenbuterol,Metoprolol and in combination on viability of cardiomycytes subjected to 4 h of anoxia/2h of reoxygenation (A/R).Cell viability was measured by MTT assay as decribed in the material and|methods section **P < 0.01 vs normal; #P < 0.05 vs A/R;△P < 0.05 vs Clen+A/R; Clen:clenbuterol; ICI:ICI 118,551; Meto:metoprolol |
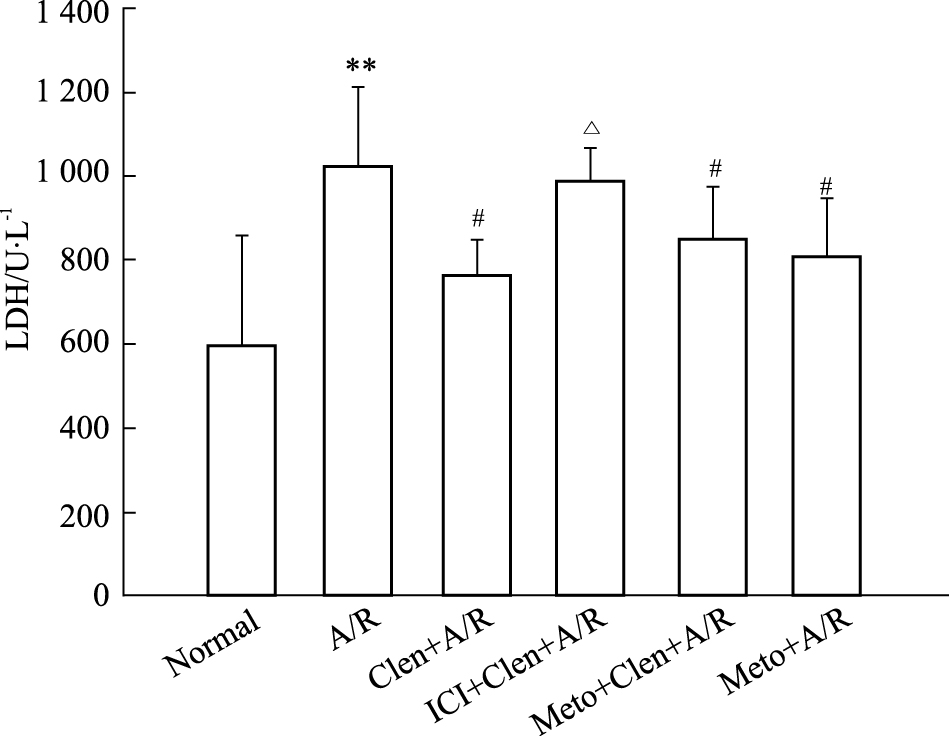
|
| Fig.3 Effects of Metoprolol,clenbuterol and clenbuterol combination with ICI or Metoprolol on LDH activity in cardiomyocytes subjected to anoxia/reoxygenation (A/R) **P<0.01 vs normal; #P<0.05 vs A/R; △P<0.05 vs Clen+A/R; Clen:clenbuterol; ICI:ICI 118,551; Meto:metoprolol |
正常培养组心肌细胞只产生少量ROS,缺氧/复氧组ROS明显增加(与正常培养组相比,P < 0.01);clenbuterol+A/R组,metoprolol+A/R组,clenbuterol+metoprolol+A/R组与A/R组相比较,ROS产生明显减少(与缺氧/复氧组比较,P < 0.05);ICI 118,551+clenbuterol+A/R组与A/R组相比差异没有显著性(P>0.05),但与clenbuterol+A/R组相比,ROS明显增高;而clenbuterol+metoprolol+A/R组与clenbuterol+A/R组相比较,差异无显著性(Fig4)。
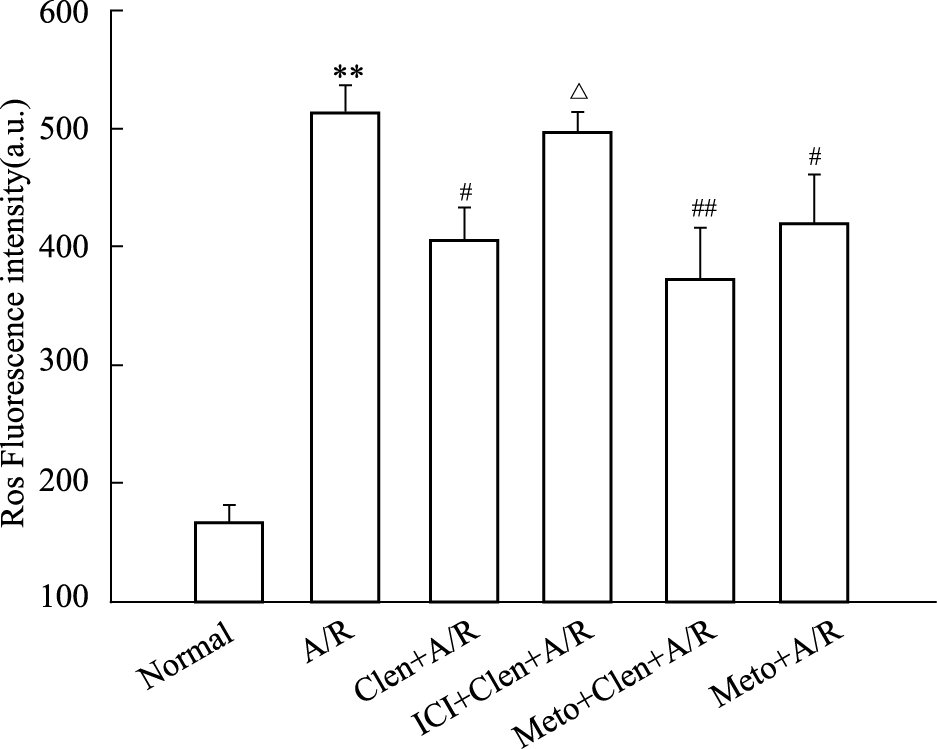
|
| Fig.4 Effects of clenbuterol,metoprolol,and clenbuterol combination with ICI or Metoprolol on the formation of ROS induced by A/R in cardiomyocytes **P<0.01 vs normal;#P<0.05 vs A/R;##P<0.01 vs A/R; △P<0.05 vs Clen+A/R. Clen:clenbuterol; ICI:ICI 118,551; Meto:metoprolol |
为了进一步探讨ERK1/2途径是否参与clenbuterol对缺氧/复氧心肌细胞的保护作用,本实验预先给予ERK1/2抑制剂PD98059,采用MTT法检测缺氧/复氧后心肌细胞的存活率,用Hoechst荧光染色观察心肌细胞凋亡情况。结果显示,缺氧/复氧组与正常培养组比较,细胞生存率下降至63%,凋亡率升高至48%。而给予clenbuterol后,缺氧/复氧后存活率上升至70%,凋亡率降低24.6%,但预先加入PD98059后,细胞存活率下降至56%,凋亡率(50.8%)比clenbuterol+A/R组高,并差异具有显著性(P < 0.05)。(Fig5、6)。
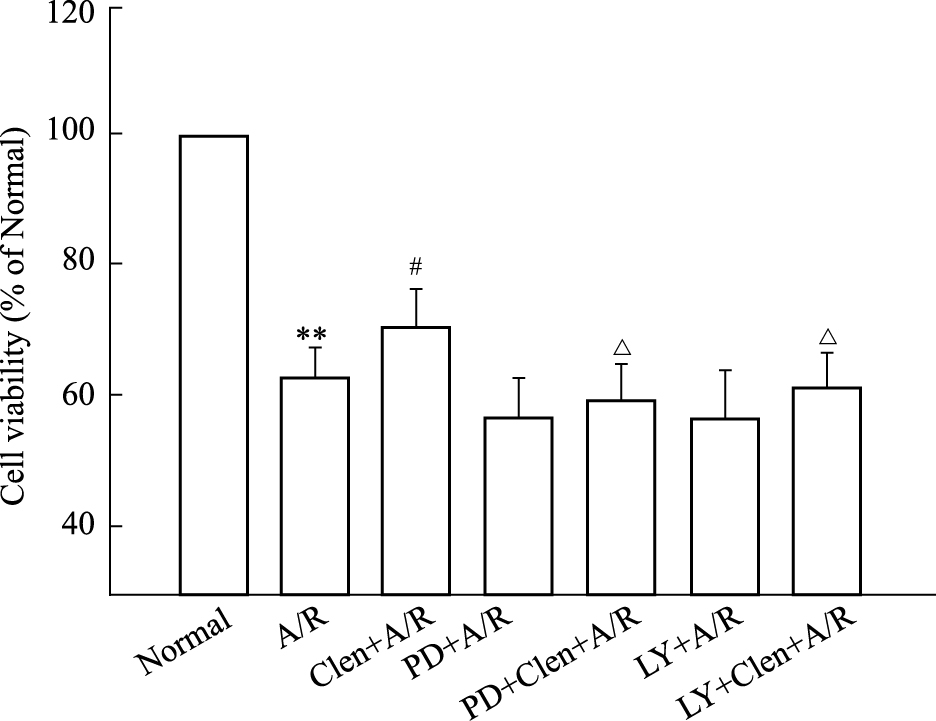
|
| Fig.5 Effects of clenbuterol and combination with LY294002(LY) or PD98059(PD) on viability of cardiomyocytes subjected to anoxia/reoxygenation (A/R) **P < 0.01 vs normal; #P < 0.05 vs A/R; △P < 0.05 vs Clen+A/R. Clen:clenbuterol; ICI:ICI 118,551; Meto:metoprolol |
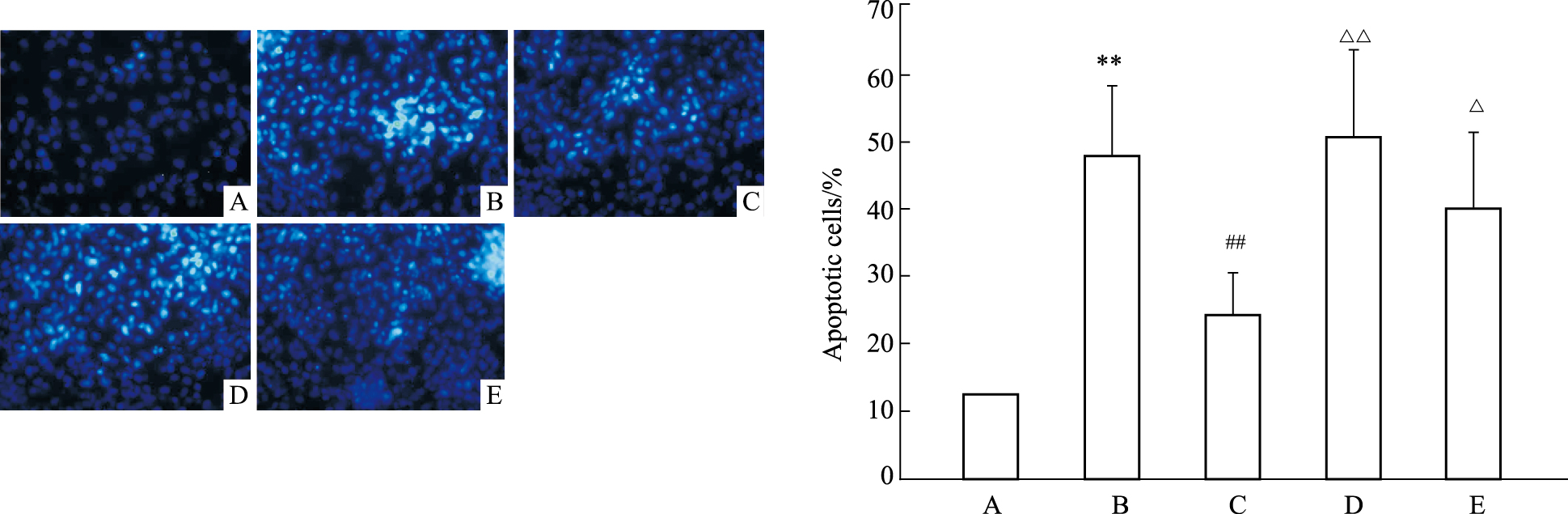
|
| Fig.6 Effects of Clenbuterol and combination with LY294002(LY) or PD98059(PD) on A/R-induced apoptosis as stained by Hoechst 33342 A:Normal;B:A/R;C:Clen+A/R;D:PD+Clen+A/R;E:LY+Clen+A/R.**P<0.01 vs normal;##P<0.01 vs A/R;△P<0.05,△△P<0.01 vs Clen+A/R;Clen:clenbuterol;ICI:ICI 118,551;Meto:metoprolol |
为 了进一步观察PI3K/Akt途径是否参与clenbuterol对缺氧/复氧心肌细胞的保护作用,本实验预先给予PI3K 抑制剂LY294002,MTT法检测缺氧/复氧后的存活率和Hoechst荧光染色检测细胞凋亡率。与正常培养组相比,缺氧/复氧组细胞存活率明显下降,凋亡率明显上升(P < 0.01)。而预先给予clenbuterol后,细胞存活增加,凋亡率下降。但预加入LY294002后,clenbuterol对缺氧/复氧诱导细胞损伤的保护作用被取消(Fig5、6)。
2.6 对心肌细胞p-ERK的表达水平的影响各组缺氧复氧后心肌细胞ERK2蛋白表达差异无统计学意义。但缺氧/复氧组p-ERK蛋白水平比正常培养组降低,而clenbuterol+A/R组较缺氧/复氧组p-ERK蛋白水平明显增高(P < 0.01),加入ERK1/2阻断剂PD98059后,p-ERK蛋白表达水平明显降低;而PI3K/Akt阻断剂LY294002对clenbuterol诱导的ERK磷酸化无阻断作用(Fig7)。
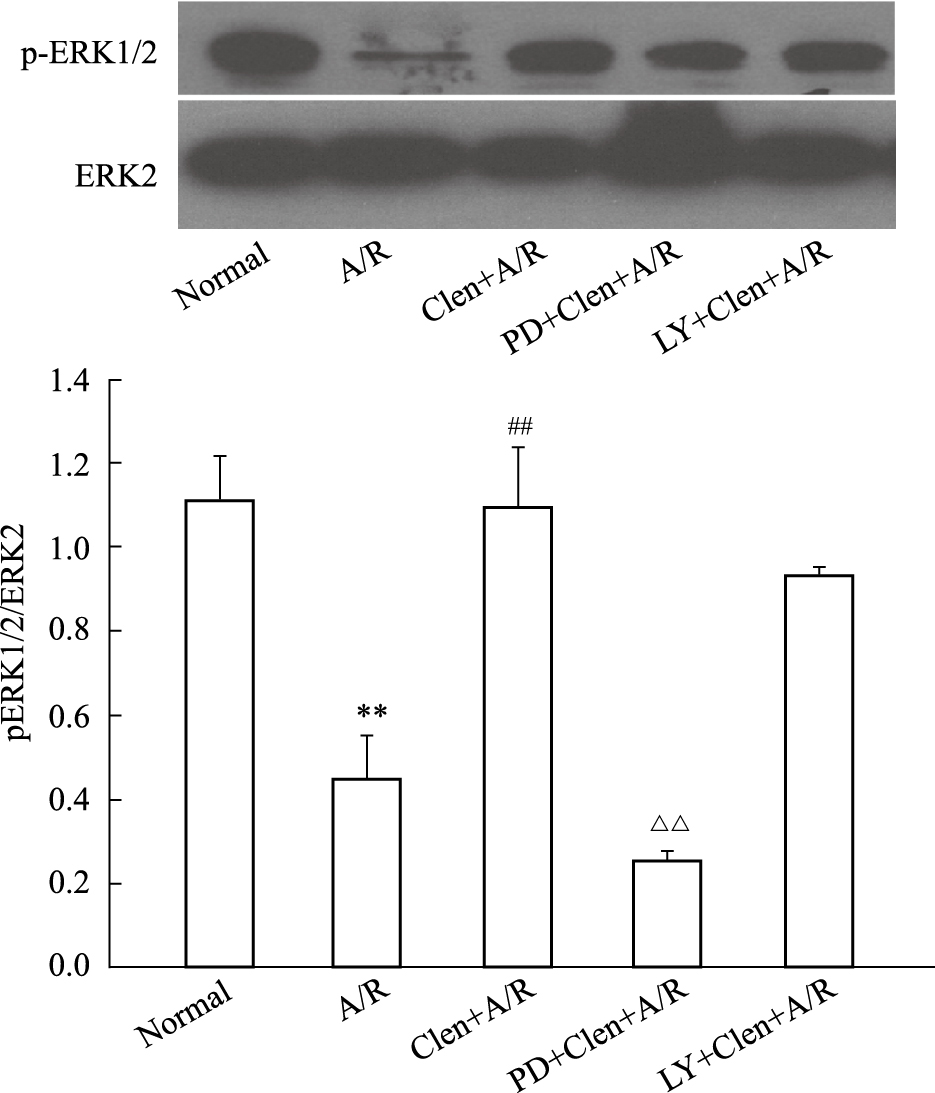
|
| Fig.7 Effects of clenbuterol and combination with LY294002(LY) or PD98059(PD) on the expressions of p-ERK1/2 in cardiomyocytes subjected to anoxia/reoxygenation (A/R). The expression of p-ERK1/2 and ERK2 were assessed by Western blotting as described in the Materials and methods section.**P<0.01 vs normal;##P<0.01 vs A/R;△△P<0.01 vs Clen+A/R.Clen:clenbuterol;ICI:ICI 118,551;Meto:metoprolol |
有研究表明,心肌缺血/再灌注损伤涉及多方面因素,如自由基大量堆积、细胞内超载、炎症因子释放等。心肌缺血/再灌注过程,大量的氧自由基爆发式产生,氧自由基通过过氧化生物膜上的多价不饱和脂肪酸和产生的过氧化物损伤心肌细胞膜,并刺激线粒体细胞色素C释放,后者进一步激活Caspase 信号,诱导细胞凋亡[17]。LDH是细胞损伤程度的标志。正常生理情况下,LDH存在于心肌细胞内,只有当细胞膜受损,通透性发生改变时,LDH才会外漏,所以通常检测LDH评价细胞损伤的程度。本实验结果发现,缺氧/复氧后心肌细胞存活率降低,LDH释放增多,表明缺氧/复氧后心肌受到严重损伤,ROS产生增多,给予clenbuterol可增加原代培养新生大鼠乳鼠的心肌细胞缺氧/复氧损伤存活率,减少LDH释放量,降低ROS,这说明β2-肾上腺素受体激动剂clenbuterol可通过减少氧自由基的产生,降低缺氧/复氧损伤,从而发挥对心肌细胞有保护作用,而β2-肾上腺素受体阻断剂ICI 118,551可以取消上述作用,而β1-肾上腺素受体阻断剂美托洛尔不能阻断clenbuterol的作用,但两者之间也无协同作用,表明clenbuterol是通过激动β2-肾上腺素受体而对缺氧/复氧损伤发挥保护作用。
RISK信号系统包括PI3K-Akt和ERK途径[18]。Tong等[2]首次确定PI3K-Akt途径的作用,在离体再灌心脏模型发现预适应能增加Akt的磷酸化,而其磷酸化抑制剂wortmannin和LY294002能取消缺血预适应的保护作用。细胞外信号调节激酶(ERK1/2)是MAPK家族中的一员,调节细胞的生长、分化、存活。缺血/再灌、低氧或激动β受体等可活化ERK1/2。虽然有少部分学者对p-ERK在缺血后再灌中的有争议;大部分学者都认为激活ERK有利于细胞的存活,如ERK磷酸化也参与了缺血预适应的保护作用[19],而MEK-1抑制剂PD98059也可取消缺血预适应的保护作用。RISK的上游是G蛋白偶联受体(G-protein coupled receptor,GPCR)。研究表明,许多药物或内源肽(如Urocorin、肾上腺髓质素等)都可通过激活GPCR,从而激活RISK从而对缺血/再灌后损伤的心肌细胞产生保护作用。而β受体是GPCRs家族中的一员,提示β受体可能在保护心肌缺血/再灌注损伤中起重要的作用。Stevens等[20]研究表明,clenbuterol主要通过β2-AR/Gi信号途径,改善心肌病理性损伤,减轻凋亡。Lochner等[21]研究发现,Isopreterol提供的心肌保护作用与缺血预适应相似[21]。Tong等[22]也证明在β2受体被敲除的小鼠心肌,缺血预适应并不能保护心肌细胞。Hedin等[23]研究表明:在培养的成熟大鼠心肌细胞,β2受体激动剂的抗凋亡作用可能是通过激活ERK。最近研究报道,选择性β2-受体激动剂Zinterol对原代培养的新生大鼠心肌低氧和H2O2引起的凋亡有保护作用,并且是通过Gi偶联受体,激活下游的PI3K/Akt发挥效应的[24]。本研究发现,clenbuterol在保护缺氧/复氧损伤心肌细胞的同时,亦可提高p-ERK1/2水平,而应用ICI118551阻断β2受体或LY294002阻断PI3K/Akt通路或PD98059阻断ERK1/2信号通路,均可明显抑制clenbuterol对心肌的保护作用,表现为细胞存活率下降,LDH释放量增高,细胞凋亡率增加。
大量的动物实验和临床应用病例都证实,β1受体拮抗剂具有抗氧化、抗凋亡和膜稳定作用,对缺血/再灌心肌有保护作用。本实验结果发现在心肌细胞缺氧-复氧模型单独给予metoprolol中可提高细胞存活率,降低LDH及ROS,减少心肌细胞凋亡。这与文献报道相一致,但与clenbuterolol联合应用既不能抑制clenbuterolo对缺氧/复氧损伤的保护作用,也无协同抗心肌细胞凋亡作用。
综上所述,clenbuterol 对缺氧/复氧诱导原代培养的心肌细胞损伤的保护作用与激动β2-AR,激活RISK信号通路有关,关于clenbuterol对其通路上下游蛋白的影响,本实验未进行验证,仍需进一步研究。
(致谢:本实验在华中科技大同济医学院药理系向继洲实验室完成,感谢实验室老师与同学提供的大力帮助。)
| [1] | Hausenloy D J, Yellon D M. Reperfusion injury salvage kinase signalling:taking a RISK for cardioprotection[J]. Heart Fail Rev, 2007, 12(3-4):217-34. |
| [2] | Tsang A, Hausenloy D J, Mocanu M M, et al. Postconditioning:a form of "modified reperfusion" protects the myocardium by activating the phosphatidylinositol 3-kinase-Akt pathway[J]. Circ Res, 2004, 95(3):230-2. |
| [3] | Yang X M, Philipp S, Downey J M, et al. Postconditioning's protection is not dependent on circulating blood factors or cells but involves adenosine receptors and requires PI3-kinase and guanylyl cyclase activation[J]. Basic Res Cardiol, 2005, 100(1):57-63. |
| [4] | Yellon D M, Baxter G F.Reperfusion injury revisited:is there a role for growth factor signaling in limiting lethal reperfusion injury[J]? Trends Cardiovasc Med, 1999, 9(8):245-9. |
| [5] | Hausenloy D J, Yellon D M. New directions for protecting the heart against ischaemia-reperfusion injury:targeting the reperfusion injury salvage kinase (RISK)-pathway[J]. Cardiovasc Res, 2004, 61(3):448-60. |
| [6] | Salorinne Y, Stenius B, Tukiainen P, et al. Double-blind cross-over comparison of clenbuterol and salbutamol tablets in asthmatic out-patients[J]. Eur J Clin Pharmacol, 1975, 8(3-4):189-95. |
| [7] | Wong K, Boheler K R, Bishop J, et al. clenbuterol induces cardiac hypertrophy with normal functional, morphological and molecular features[J]. Cardiovasc Res, 1998, 37(1):115-22. |
| [8] | Soppa G K, Smolenski R T, Latif N, et al. Effects of chronic administration of clenbuterol on function and metabolism of adult rat cardiac muscle[J]. Am J Physiol Heart Circ Physiol, 2005, 288(3):H1468-76. |
| [9] | Burniston J G, Tan L B, Goldspink D F. Relative myotoxic and haemodynamic effects of the beta-agonists fenoterol and clenbuterol measured in conscious unrestrained rats[J]. Exp Physiol, 2006, 91(6):1041-9. |
| [10] | Burniston J G, Chester N, Clark W A, et al. Dose-dependent apoptotic and necrotic myocyte death induced by the beta2-adrenergic receptor agonist, clenbuterol[J]. Muscle Nerve, 2005, 32(6):767-74. |
| [11] | Xydas S, Kherani A R, Chang J S, et al. beta(2)-Adrenergic stimulation attenuates left ventricular remodeling, decreases apoptosis, and improves calcium homeostasis in a rodent model of ischemic cardiomyopathy[J]. J Pharmacol Exp Ther, 2006, 317(2):553-61. |
| [12] | Ahmet I, Krawczyk M, Heller P, et al. Beneficial effects of chronic pharmacological manipulation of beta-adrenoreceptor subtype signaling in rodent dilated ischemic cardiomyopathy[J]. Circulation, 2004, 110(9):1083-90. |
| [13] | Zhu Y, Prehn J H, Culmsee C, et al. The beta2-adrenoceptor agonist clenbuterol modulates Bcl-2, Bcl-xl and Bax protein expression following transient forebrain ischemia[J]. Neuroscience, 1999, 90(4):1255-63. |
| [14] | Zhang Q, Xiang J, Wang X, et al. Beta(2)-adrenoceptor agonist clenbuterol reduces infarct size and myocardial apoptosis after myocardial ischaemia/reperfusion in anaesthetized rats[J]. Br J Pharmacol, 2010, 160(6):1561-72. |
| [15] | Fu Q, Xu B, Parikh D, et al. Insulin induces IRS2-dependent and GRK2-mediated beta2AR internalization to attenuate betaAR signaling in cardiomyocytes[J]. Cell Signal, 2015, 27(3):707-15. |
| [16] | Koyama T, Temma K, Akera T. Reperfusion-induced contracture develops with a decreasing[Ca2+]i in single heart cells[J]. Am J Physiol, 1991, 261(4 Pt 2):H1115-22. |
| [17] | Rohrbach S, Troidl C, Hamm C, et al. Ischemia and reperfusion related myocardial inflammation:A network of cells and mediators targeting the cardiomyocyte[J]. IUBMB Life, 2015, 67(2):110-9. |
| [18] | 王雨晴, 吴艳娜, 李 欣, 等. RISK信号通路在1-磷酸鞘氨醇后适应减轻心肌细胞缺氧/复氧损伤中的作用[J]. 中国药理学通报, 2015, 31(2):181-5. Wang Y Q, Wu Y N, Li X, et al. Role of risk signal pathway in reducing cardiomyocytes hypoxia/reoxygenation injury induced by S1P postconditioning[J]. Chin Phamacol Bull, 2015, 31 (2):181-5. |
| [19] | Hausenloy D J, Mocanu M M, Yellon D M. Cross-talk between the survival kinases during early reperfusion:its contribution to ischemic preconditioning[J]. Cardiovasc Res, 2004, 63(2):305-12. |
| [20] | Stevens L, Gohlsch B, Mounier Y, et al. Upregulation of myosin heavy chain MHClalpha in rat muscles after unweighting and clenbuterol treatment[J]. Biochem Biophys Res Commun, 2000, 275(2):418-21. |
| [21] | Lochner A, Genade S, Tromp E, et al. Ischemic preconditioning and the beta-adrenergic signal transduction pathway[J]. Circulation, 1999, 100(9):958-66. |
| [22] | Tong H, Rockman H A, Koch W J, et al. G protein-coupled receptor internalization signaling is required for cardioprotection in ischemic preconditioning[J]. Circ Res, 2004, 94(8):1133-41. |
| [23] | Hedin K E, Bell M P, Huntoon C J, et al. Gi proteins use a novel beta gamma-and Ras-independent pathway to activate extracellular signal-regulated kinase and mobilize AP-1 transcription factors in Jurkat T lymphocytes[J]. J Biol Chem, 1999, 274(28):19992-20001. |
| [24] | Kim S O, Baines C P, Critz S D, et al. Ischemia induced activation of heat shock protein 27 kinases and casein kinase 2 in the preconditioned rabbit heart[J]. Biochem Cell Biol, 1999, 77(6):559-67. |