


2. 广东医学院广东天然药物研究与开发重点实验室, 广东 湛江 524023
2. Guangdong Key Laboratory for Research and Development of Natural Drugs, Guangdong Medical College, Zhanjiang Guangdong 524023, China
糖皮质激素性骨质疏松(glucocorticoid-induced osteoporosis,GIOP)是在使用糖皮质激素(glucocorticoid,GC)治疗疾病过程中引起的骨量丢失,以骨量减少,骨微结构破坏,骨强度下降为特征的一种疾病[1],易增强骨脆性,致患者发生骨折。GIOP是应用GC后出现的常见不良反应之一。GIOP的主要原因是骨形成明显的下降,所以寻找疗效确切、经济易得、不良反应小的促骨形成药物一直是骨药理学,尤其是糖皮质激素性骨质疏松防治的研究热点。何首乌(Polygonum Multiflorum,PM)作为一种中国传统药材,临床上被广泛应用。已有研究报道,何首乌及其提取物有防治骨质疏松的作用[2, 3, 4]。何首乌主要含3类成分:二苯乙烯苷类化合物、蒽醌类以及磷脂。我们前期研究初步探讨了何首乌的主要成分大黄素,二苯乙烯苷(tetrahydroxystilbene glucoside,TSG)对骨代谢相关细胞的作用,发现大黄素能促进骨髓基质干细胞(bone marrow stromal cells,BMSCs)向成骨细胞方向分化,抑制BMSCs向脂肪细胞方向分化[5, 6, 7, 8]。二苯乙烯苷能促进BMSCs碱性磷酸酶表达,刺激骨钙素分泌,上调Col1a1和Runx2 mRNA的表达,增加Wnt信号通路核心蛋白(β-catenin)mRNA和蛋白的表达,本研究在活性指导下进行何首乌提取、分离和纯化[9],并进一步观察其在动物体内对GIOP的防治效果。我们课题组也曾发现何首乌能有效预防去卵巢大鼠的骨丢失[10],但对何首乌及其有效成分对糖皮质激素诱导大鼠骨丢失的效果如何,目前仍不清楚,本文主要探讨何首乌对糖皮质激素致大鼠骨丢失的影响,为研究和开发何首乌抗骨质疏松的作用及发现其抗骨质疏松的有效成分提供实验依据。
1 材料与方法 1.1 实验动物90只♂6月龄SD大鼠,由广东医学院实验动物中心提供,体质量(210±20)g,动物合格证号:SCXK(粤)2008-0008。
1.2 药品及仪器生何首乌药材购自广西玉林市祥生中药饮片有限责任公司(产地:河南),醋酸泼尼松片购自广东华南药业集团有限公司(批号:140602),罗盖全购自上海罗氏制药有限公司(批号:B40B5)。viva micro-CT 40 (SCANCO MedicalAG,瑞士)、858 Mini Bionix 型材料测试机及测试系统(MTS,美国)。何首乌总提取物是采用75%乙醇温浸提取后浓缩得浸膏,何首乌30%醇提取物是采用何首乌总提取物经D101大孔树脂富集,按照0~90%乙醇梯度洗脱,收集30%乙醇洗脱部位,浓缩制得。
1.3 糖皮质激素骨丢失模型的建立及动物分组6月龄SD♂大鼠按体重随机分成9组:空白对照组、泼尼松模型组(6 mg·kg-1·d-1);何首乌30%醇提取物高、中、低剂量组分别为:泼尼松6 mg·kg-1·d-1+何首乌30%醇提取物400 mg·kg-1·d-1、泼尼松6 mg·kg-1·d-1+何首乌30%醇提取物200 mg·kg-1·d-1、泼尼松6 mg·kg-1·d-1+何首乌30%醇提取物100 mg·kg-1·d-1;何首乌总提取物高、中、低剂量组分别为:泼尼松6 mg·kg-1·d-1+何首乌总提取物400 mg·kg-1·d-1、泼尼松6 mg·kg-1·d-1+何首乌总提取物200 mg·kg-1·d-1、泼尼松6 mg·kg-1·d-1+何首乌总提取物100 mg·kg-1·d-1;阳性对照组:泼尼松6 mg·kg-1·d-1+罗盖全0.045 μg·kg-1·d-1。每组大鼠按5 mL-1·d-1灌胃给药,连续给药21周。每周称体重1次,并按体重变化调整给药量。实验结束时,大鼠麻醉后心脏抽血处死,迅速取出右股骨保存。
1.4 Micro-CT测量股骨远端松质骨定量参数将右股骨上面残存的肌肉剔除处理好的股骨远心端(完整)标本沿长轴垂直固定于样品固定器内。Viva CT 40选择扫描参数:图像矩阵为2048×2048,整合时间(integration time)为200 ms,能量/强度为70kVp、114 μA、8W。以0°旋转,进行扫描。扫描完成后,选取距生长板远端1.0 mm、层厚3.0 mm的骨组织为松质骨感兴趣区域(ROI)行三维重组,以最低阈值为170提取图像信息。获得重组图像后,使用Micro-CT自带的软件进行定量分析。物理参数分析如下:骨密度(bone mineral density,BMD)、骨体积分数(bone volume/total volume,BV/TV)、结构模型指数(structure model index,SMI)、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp)、骨小梁厚度(trabecular thickness,Tb.Th)、连接密度(Dens)、H-h、B-b,见Fig1。
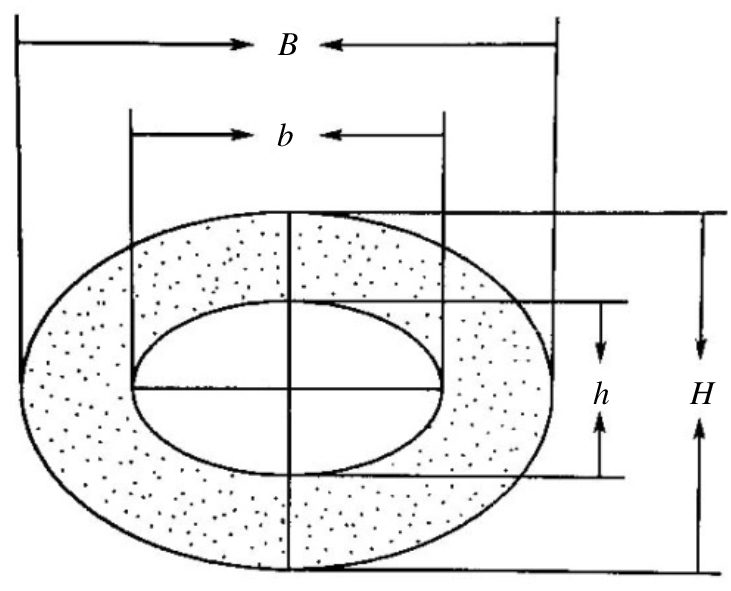
|
| Fig.1 The cross-sectional diagram of femur |
检测时,将50%乙醇—生理盐水保存的右股骨置于流变仪上分别进行三点弯曲试验,加载速度为0.01 mm·s-1,跨距为15 mm[11]。记录载荷-变形曲线,从曲线上直接获取或依公式计算出相应的力学指标:弹性载荷(elastic load)、最大载荷(maximum load)、断裂载荷(break load)、刚度(stiffness)参数。
1.6 统计学分析所有数据均以 ± s 形式表示,采用SPSS 22.0 软件对数据进行方差分析及组间比较。
± s 形式表示,采用SPSS 22.0 软件对数据进行方差分析及组间比较。
随机分组后,每周称体重1次调节饲料重量,自由饮水与进食。实验初期各组体重差别不大,实验后期模型组体重比正常组、给药组体重低。给药期间各组大鼠的体重变化,见Fig2。
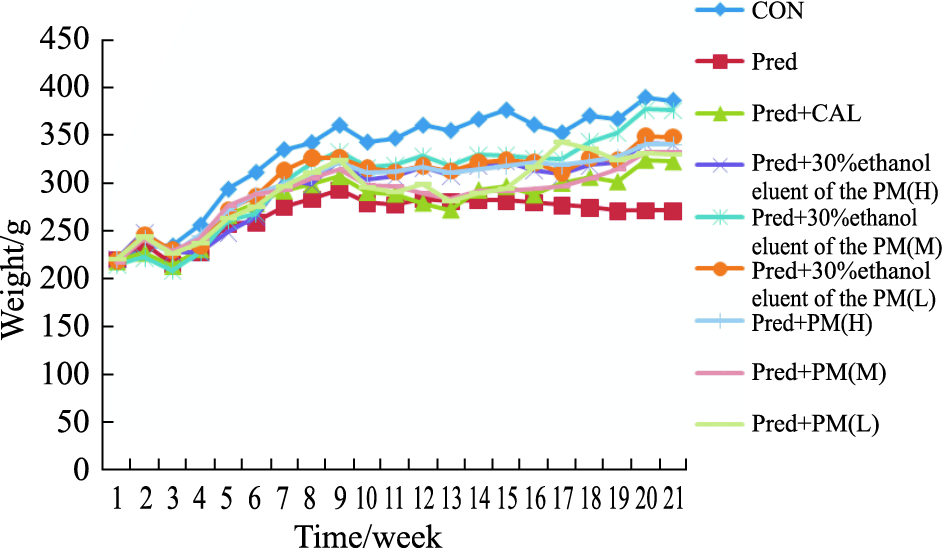
|
| Fig.2 Changes of administration period (21 weeks) of weight in rats in different group |
与空白对照组比较,模型组Micro-CT结果显示,BV/TV下降28.6%(P < 0.05)、连接密度、H-h、B-b下降(P < 0.05),骨微结构出现异常。①与模型组比较,罗盖全组大鼠的BV/TV上升46.7%(P < 0.01)、连接密度、H-h、B-b、骨小梁数目明显增加(P < 0.01),骨小梁分离度明显减少(P < 0.01),骨微结构有明显的改善。②与模型组比较,何首乌30%醇提取物高剂量组的连接密度、H-h明显上升(P < 0.01)、B-b上升(P < 0.05),对骨微结构有一定程度的改善,骨密度无明显改变。③与模型组比较,何首乌30%醇提取物中剂量组BV/TV上升46.7%(P < 0.01)、连接密度、H-h、B-b、骨密度明显上升(P < 0.01),结构模型指数下降、骨小梁分离度下降(P < 0.05),骨微结构明显改善。④与模型组比较,何首乌30%醇提取物低剂量组BV/TV上升40%(PP < 0.05)、连接密度、骨密度上升(P < 0.05),H-h、B-b明显上升(P < 0.01),结构模型指数、骨小梁分离度下降(P < 0.05),骨微结构明显改善。⑤与模型组比较,何首乌总提取物高剂量组连接密度、H-h、B-b明显上升(P < 0.01),骨小梁数目增加(P < 0.05),对骨微结构有一定程度的改善,骨密度无明显改变。⑥与模型组比较,何首乌总提取物中、低剂量组H-h明显上升(P < 0.01)、B-b上升(P < 0.05),对骨微结构、骨密度无明显改变。何首乌30%醇提取物中剂量、低剂量与何首乌总提取物高剂量可以预防泼尼松导致的大鼠股骨松质骨微结构破坏,增加骨密度,但作用不及阳性组,与阳性组相比,连接密度、Tb.N、BMD等参数降低,其他剂量组对此无明显的预防作用。见Tab1。
 ± s )
± s )
| Group | BV/TV/% | Dens | SMI | H-h/mm | B-b/mm | Tb.N/mm-1 | Tb.Th/mm | Tb.Sp/mm | BMD/mg·cm-2 |
| *P<0.05,**P<0.01 vs CON;△P<0.05,△△P<0.01 vs Pred;#P<0.05,##P<0.01 vs CAL | |||||||||
| CON | 0.21±0.04 | 56.18±9.53 | 1.54±0.295 | 1.04±0.13 | 1.14±0.11 | 2.34±0.51 | 0.09±0.01 | 0.48±0.14 | 155.40±30.39 |
| Pred | 0.15±0.04* | 39.25±8.20** | 1.96±0.42 | 0.73±0.08** | 0.83±0.084** | 1.89±0.36 | 0.08±0.01 | 0.58±0.12 | 116.68±38.35 |
| CAL | 0.22±0.08△△ | 66.03±16.41△△ | 1.54±0.57 | 0.94±0.09△△ | 0.97±0.05△△ | 3.04±0.82△△ | 0.09±0.01 | 0.37±0.13△△ | 178.06±50.44△△ |
| 30% ethanol eluent of the PM(H) | 0.18±0.05 | 54.94±11.38△△ | 1.73±0.44 | 0.90±0.11△△ | 0.93±0.08△ | 2.25±0.46## | 0.08±0.01 | 0.49±0.10# | 145.52±42.46 |
| 30% ethanol eluent of the PM(M) | 0.22±0.05△△ | 58.74±9.78△△ | 1.37±0.51△ | 0.93±0.08△△ | 0.97±0.05△△ | 2.37±0.39# | 0.09±0.01 | 0.46±0.08△ | 172.27±35.76△△ |
| 30% ethanol eluent of the PM(L) | 0.21±0.07△ | 54.07±11.90△# | 1.39±0.66△ | 0.91±0.04△△ | 1.01±0.06△△ | 2.31±0.32## | 0.09±0.01 | 0.47±0.06 | 161.01±48.97△ |
| PM(H) | 0.19±0.02 | 62.13±13.11△△ | 1.59±0.25 | 0.90±0.05△△ | 1.03±0.09△△ | 2.55±0.71△ | 0.08±0.01 | 0.45±0.14△ | 150.74±15.68 |
| PM(M) | 0.18±0.07 | 47.67±13.29## | 1.73±0.59 | 0.94±0.08△△ | 0.93±0.09△ | 2.13±0.49## | 0.09±0.01 | 0.51±0.10# | 133.85±54.79# |
| PM(L) | 0.19±0.05 | 56.06±11.93△△ | 1.66±0.43 | 0.91±0.10△△ | 0.91±0.21 | 2.30±0.61## | 0.09±0.01 | 0.49±0.15# | 142.74±41.03 |
Micro-CT的三维可视化成像结果形象地展示了各组大鼠股骨远心端松质骨的形态变化情况。空白对照组骨小梁走向一致,粗细均匀,形状规则,排列密集;模型组骨小梁稀疏、排列不均、网状结构消失、呈现明显的骨微结构破坏,不能保持完整的微观构筑。与模型组比较,阳性对照组、何首乌30%醇提取物中、低剂量组、何首乌总提取物高剂量组的骨微结构破坏较模型组有所减轻,表现为骨小梁增多,间隙变小,出现较多完整的骨小梁连接结构,其中阳性组尤为明显。与模型组相比,何首乌30%醇提取物高剂量组、何首乌总提取物中、低剂量组对此无改善作用。见Fig3。
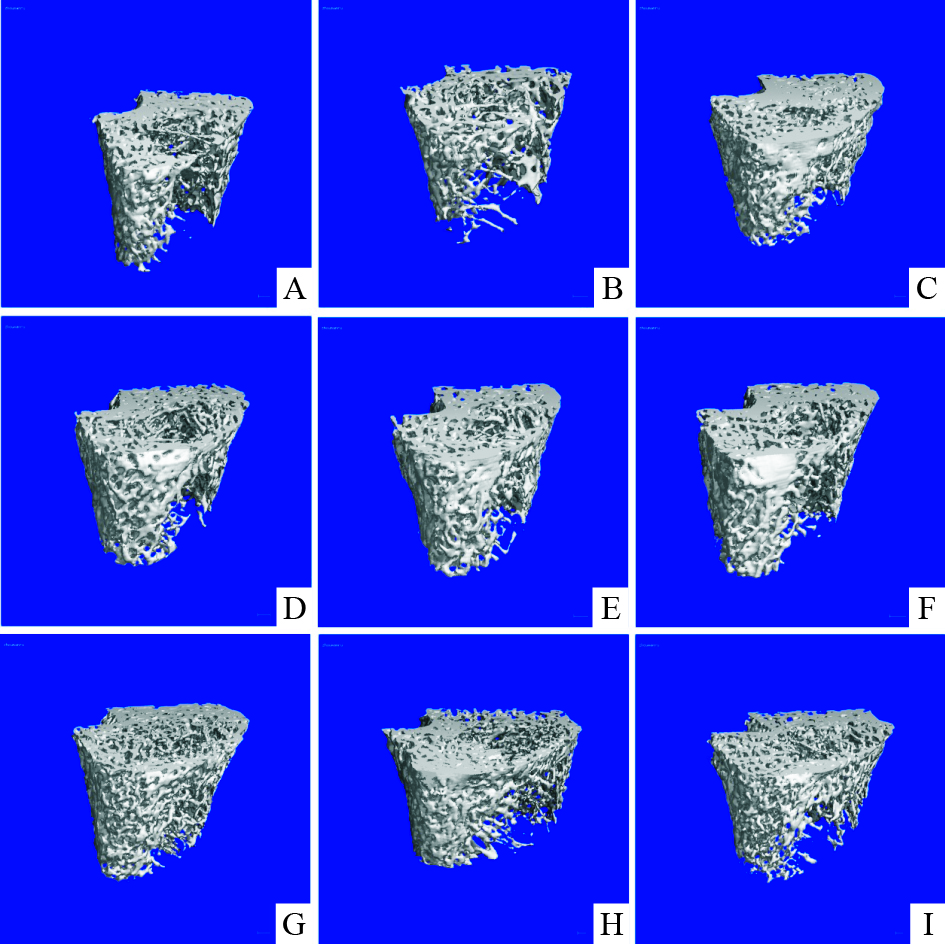
|
| Fig.3 Segmented (SEG) image of micro-CT of distalfemur in rats in different groups A:CON;B:Pred (6mg·kg-1·d-1);C:CAL (0.045μg· kg-1·d-1);D:30% ethanol eluent of the PM (H)(400mg·kg-1· d-1);E:30% ethanol eluent of the PM (M)(200mg·kg-1·d-1);F:30% ethanol eluent of the PM (L)(100mg·kg-1·d-1);G:PM (H)(400mg·kg-1·d-1);H:PM (M)(200mg·kg-1·d-1);I:PM (L)(100mg·kg-1·d-1) |
与阴性对照组比较,骨小梁分离度图中模型组红色部分明显增多,橙色、黄色也较多,提示模型组分离度增大,骨小梁之间的距离明显变大。与模型组比较,阳性对照组、何首乌30%醇提取物中、低剂量组绿色增多,红色、橙色、黄色减少,提示这些组骨小梁分离度变小,骨小梁之间的距离变小,阳性组的现象更为明显。何首乌30%醇提取物高剂量组、何首乌总提取物高、中、低剂量组的绿色变多,红色、橙色、黄色变少,提示这些组的骨微结构有一定改善作用。见Fig4。
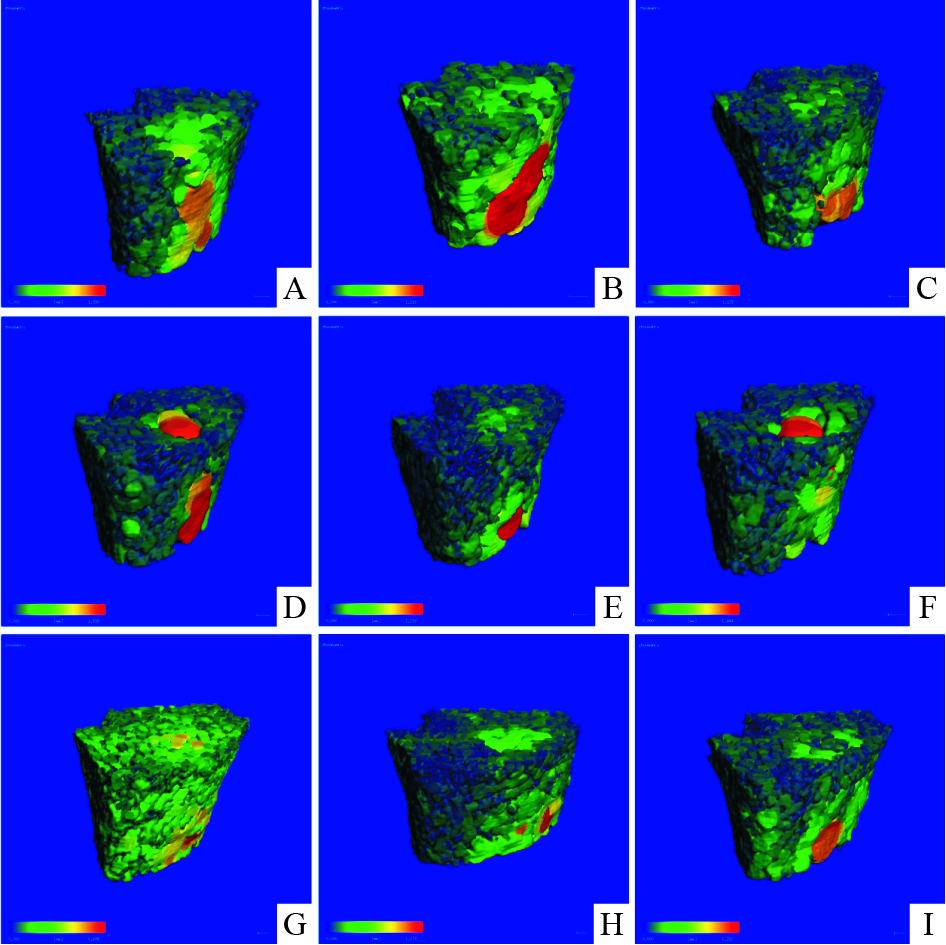
|
| Fig.4 Trabecular separation image of micro-CT of distal femur in rats in differen tgroups A:CON;B:Pred (6mg·kg-1·d-1);C:CAL (0.045μg· kg-1·d-1;D:30% ethanol eluent of the PM (H)(400mg·kg-1· d-1);E:30% ethanol eluent of the PM (M)(200mg·kg-1·d-1);F:30% ethanol eluent of the PM (L)(100mg·kg-1·d-1);G:PM (H)(400mg·kg-1·d-1);H:PM (M)(200mg·kg-1·d-1);I:PM (L)(100mg·kg-1·d-1) |
与阴性对照组比较,骨小梁厚度图中模型组红色部分减少不明显,说明骨小梁厚度变薄不明显。与模型组比较,所有的给药组红色部分都没有明显增多,说明厚度增加不明显。见Fig5。
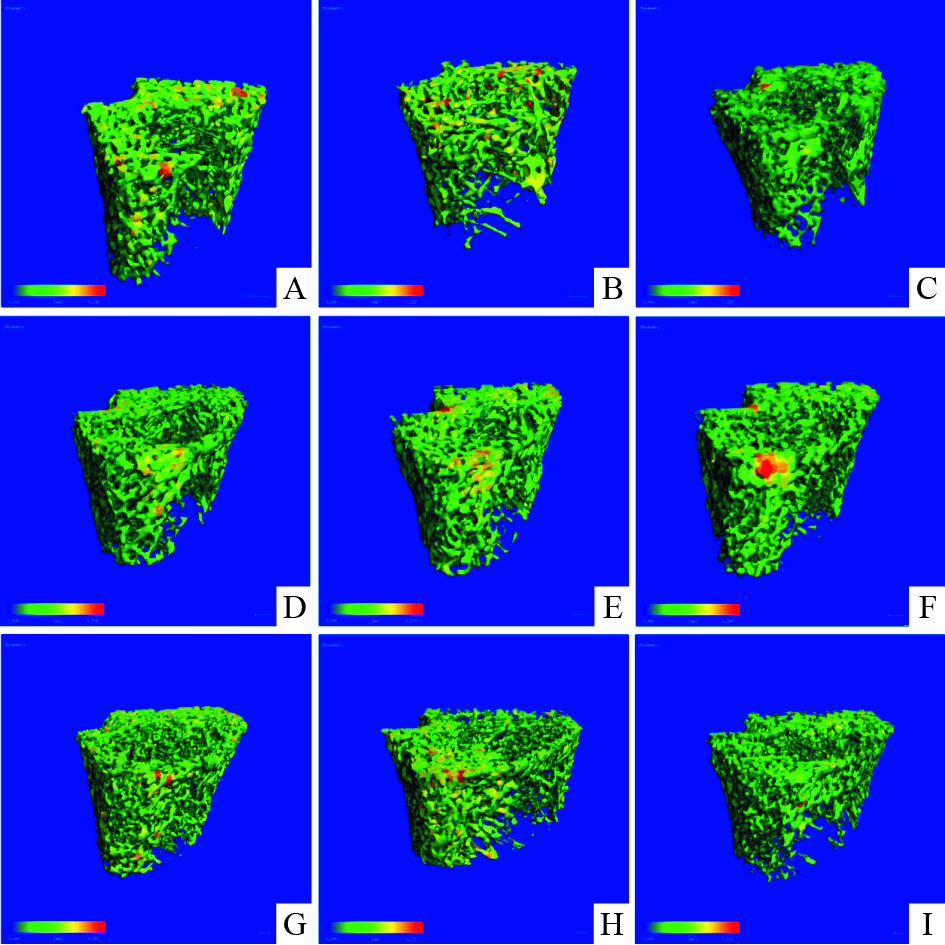
|
| Fig.5 Trabecular thickness image of micro-CT of distal femur in rats in different groups A:CON;B:Pred (6mg·kg-1·d-1);C:CAL (0.045μg· kg-1·d-1);D:30% ethanol eluent of the PM (H)(400mg·kg-1· d-1);E:30% ethanol eluent of the PM (M)(200mg·kg-1·d-1);F:30% ethanol eluent of the PM (L)(100mg·kg-1·d-1);G:PM (H)(400mg·kg-1·d-1);H:PM (M)(200mg·kg-1·d-1);I:PM (L)(100mg·kg-1·d-1) |
与空白对照组比较,模型组出现骨生物力学参数减小,弹性载荷下降19.7%(P < 0.01)、最大载荷下降14.6%(P>0.05)、断裂载荷下降16.2%(P>0.05)、刚度下降29.7%(P < 0.01)。与模型组比较,阳性组生物力学参数弹性载荷上升21.9%(P < 0.05)、断裂载荷上升12.2%(P>0.05)、最大载荷上升8.7%(P>0.05)、刚度上升25.9%(P < 0.01),提示对骨生物力学性能有明显改善作用。与模型组比较,何首乌30%醇提取物中剂量弹性载荷上升8.1%(P >0.05)、最大载荷上升10.7%(P>0.05)、断裂载荷上升15.1%(P>0.05)、刚度上升15.7%(P> 0.05)。与模型组比较,何首乌30%醇提取物低剂量组弹性载荷上升12.3%(P>0.05)、最大载荷上升9.1%(P>0.05)、断裂载荷上升4.8%(P> 0.05)、刚度上升14.5%(P>0.05)。与模型组比较,何首乌总提取物高剂量组弹性载荷上升24.1%(P < 0.05)、最大载荷上升9.3%(P>0.05)、断裂载荷上升8.1%(P>0.05)、刚度上升24.7%(P < 0.05),提示对生物力学参数有一定改善作用,但改善作用不及阳性组。何首乌30%醇提取物高剂量与何首乌总提取物中、低剂量对骨微结构和生物力学参数改善作用不明显。见Tab2。
| Group | Elastic load/N | Maximum load/N | Break load/N | Stiffness/N·mm-1 |
| **P<0.01 vs CON;△P<0.05,△△P<0.01 vs Pred;#P<0.05 vs CAL | ||||
| CON | 100.60±15.77 | 199.25±27.99 | 192.33±36.27 | 733.60±101.84 |
| Pred | 80.80±16.70** | 170.24±22.36 | 161.19±30.45 | 515.57±127.80** |
| CAL | 98.52±15.14△ | 185.03±26.45 | 180.78±32.70 | 649.34±110.87△△ |
| 30% ethanol eluent of the PM(H) | 84.25±16.22 | 183.00±34.09 | 180.18±31.56 | 546.11±93.56# |
| 30% ethanol eluent of the PM(M) | 87.31±9.68 | 188.48±27.78 | 185.59±28.64 | 596.70±81.76 |
| 0% ethanol eluent of the PM(L) | 90.73±11.07 | 185.78±35.82 | 168.94±46.64 | 603.23±98.72 |
| PM(H) | 100.25±16.27△ 185.99±23.94 | 174.23±37.78 | 642.83±89.27△ | |
| M(M) | 86.52±18.98 | 181.10±38.01 | 175.96±37.56 | 575.74±120.33 |
| PM(L) | 90.08±16.45 | 179.41±29.95 | 169.61±26.57 | 595.99±97.08 |
由Tab1~2和Fig3~5可见,与空白对照组比较,模型组大鼠体重明显下降。Micro-CT结果显示,模型组骨体积分数、连接密度、H-h、B-b下降。骨体积分数是描述松质骨细微结构一个非常重要的参数,其意义在于能反映松质骨样本内骨组织体积的含量。从Micro-CT的三维重建图像和数据中,可以直接得出骨体积分数准确值,结果提示,泼尼松可使大鼠股骨的骨体积分数下降。此外,可从三维结构重建后的大鼠股骨远心端股骨分割图直接观察骨小梁的结构形态。骨小梁分离度图可直接反映骨小梁的距离情况,从绿到红,反映了骨小梁之间的距离越来越大,骨质疏松越来越严重。骨小梁厚度图除了可见骨小梁的结构和几何信息外,还可直接反映骨小梁的厚度分布情况,从绿到红,反映了骨从薄到厚,从骨骼的结构参数及力学参数的定量数值,观察骨微结构变化[11]。本实验从Micro-CT的3D图可见,泼尼松组大鼠骨小梁变稀疏、数目减少、变细、间距变宽、形态不规则、网状结构稀疏、排列不均,呈现出明显的骨微结构异常,不能保持完整的微观构筑,表明大鼠股骨骨微结构发生了骨质疏松样改变。同时泼尼松组骨生物力学参数(弹性载荷、刚度)减小,提示骨量减少的同时骨的结构、力学特性也明显减弱,内在硬度、抗变形能力下降,承重负重能力下降。
糖皮质激素诱发骨质疏松的可能机制为[12, 13]:①激素直接抑制成骨细胞产生,加速成骨细胞凋亡,同时可抑制胰岛素样生长因子在成骨细胞表达,降低骨转换率。②增加继发性甲状旁腺素分泌,激活破骨细胞,促进骨吸收,导致骨量减少。③抑制胃肠道对钙的吸收,增加钙磷排泄。④引起睾酮缺乏,抑制十二指肠跨膜钙离子转运载体活性,减少钙离子结合蛋白的合成,导致肠道钙吸收障碍,继而抑制骨形成,促进骨吸收。⑤抑制雌激素分泌,降低钙磷在骨质的沉着。⑥引起脂质代谢异常,造成骨髓微脂肪栓形成,骨髓微循环压力增高,骨缺血坏死。
3.2 罗盖全和何首乌提取物对糖皮质激素大鼠骨微结构及生物力学改变的预防作用由Tab1~2,Fig3~5可见,与模型组比较,罗盖全组大鼠的骨体积分数、连接密度、H-h、B-b、骨小梁数目明显增加,骨小梁分离度明显减少,骨微结构有明显的改善。弹性载荷、刚度明显增加,骨生物力学性能得到改善。罗盖全即骨化三醇,是维生素D3生物活性的主要代谢产物,其作用机制主要为通过与作用部位的受体结合,促进肠道对钙离子的吸收及肾小管对钙的重吸收,抑制甲状旁腺激素的合成与分泌,从而调节骨代谢,促进骨形成[14]。
由Tab1~2,Fig3~5可见,与模型组比较,①何首乌30%醇提取物高剂量组的连接密度、H-h明显上升、B-b上升,结果提示该组对骨微结构与生物力学虽有一定趋势的改善,但并无明显变化。②何首乌30%醇提取物中、低剂量组骨体积分数、连接密度、H-h、B-b、骨密度明显上升,结构模型指数下降、骨小梁分离度下降,结果提示该组对骨微结构明显改善,但对骨生物力学性能并无明显改变。③何首乌总提取物高剂量组连接密度、H-h、B-b明显上升,骨小梁数目、弹性载荷、刚度上升。结果提示该组对骨微结构与生物力学都有一定程度的改善。④何首乌总提取物中、低剂量组H-h明显上升、B-b上升,结果提示该组对骨微结构、骨密度与骨生物力学性能无明显改变。此外,本实验从Micro-CT的3D图可见,与模型组比较,阳性对照组、何首乌30%醇提取物中、低剂量组、何首乌总提取物高剂量组的骨微结构破坏较模型组有所减轻,表现为骨小梁增多,间隙变小,出现较多完整的骨小梁连接结构。同时骨小梁分离度变小,骨小梁之间的距离变小。这3个何首乌提取物组对泼尼松大鼠骨的改善作用相近,他们之间的差异无统计学意义。其余用药组没有看到这种对骨的改善作用。所有给药组骨的厚度增加都不明显,厚度与模型组相近。
何首乌是中医常用的传统药材,补肾活血,药理作用广,药用价值高。有效预防去卵巢大鼠的骨量丢失,具有抑制骨吸收的作用[10],但目前还不清楚何首乌有效成分及其提取物对抗糖皮质激素引起的骨质疏松的防治作用。本文主要从股骨远端松质骨Micro-CT定量参数和骨生物力学观察何首乌对糖皮质激素致大鼠骨质疏松的预防作用。现代文献对何首乌抗骨质疏松的机制研究主要归结为“肾论”和雌激素样作用[2]。已经有研究结果表明,何首乌抗骨质疏松机制可能为提高肾的1α-羟化酶活性,增加骨钙、骨磷和骨羟脯氨酸含量,增加碱性磷酸酶活性,减少骨丢失。何首乌饮片还可作为氧化自由基清除剂,提高血清中超氧化物歧化酶活性,降低丙二醛含量,改善肾脏形态学结构,减少肾小球和肾小管间质纤维化从而对抗骨质疏松[15]。此外,何首乌抗骨质疏松还与激素水平有关。何首乌中抗骨质疏松的主要有效成分为二苯乙烯苷类和何首乌多糖[2],有氧自由基清除剂作用,增加机体抗氧化酶活性,延缓肝肾衰老。二苯乙烯苷还具有植物雌激素功效,从雌激素替代治疗来抗骨质疏松。另外,何首乌本身含有丰富的钙,亦能增加机体骨钙含量。已有实验表明,何首乌煎剂可以抑制去卵巢大鼠骨质疏松可能与其抑制大鼠的骨吸收增强和骨高转换有关[9]。何首乌提取液明显增强去卵巢大鼠中血清和骨组织中成骨细胞的标志酶(ALP)活性,但降低破骨细胞的标志酶(TRAP)活性的作用不明显,提示何首乌的防治作用以促骨形成为主[2]。
综上所述,泼尼松可引起大鼠股骨生物力学性能降低,骨微结构异常;何首乌30%醇提取物中剂量(200 mg·kg-1·d-1)、何首乌30%醇提取物低剂量组(100 mg·kg-1·d-1)、何首乌总提取物高剂量(400 mg·kg-1·d-1)给药21周可预防泼尼松致大鼠骨密度的下降、改善股骨松质骨微结构、提高股骨生物力学性能。但此防治作用的具体作用机制、发挥作用的有效成分、最佳剂量等都有待更多的体内外实验进行研究和探讨。
(致谢:本文在广东医学院药理学教研室、广东天然药物研究与开发重点实验室、深圳清华大学研究院创新中药平台完成,在此对以上实验室的老师们表示感谢。 )
| [1] | 任 辉,魏秋实,江晓兵,崔健超.糖皮质激素性骨质疏松的研究新进展 [J]. 中国骨质疏松杂志,2014,20(9):1138-42.Ren H,Wei Q S,Jiang X B,Cui J C. The advance in the glucocorticoid-induced osteoporosis[J]. Chin J Osteop, 2014,20(9):1138-42. |
| [2] | 陈少茹,邹丽宜,吴 铁.何首乌防治骨质疏松症的研究进展 [J].现代医药卫生, 2011, 27(22):3428-31.Chen S R, Zou L Y, Wu T.Research progress of Polygonum multiflorum for preventing and treating osteoporosis[J].J Mod Med Health, 2011, 27(22):3428-31. |
| [3] | 张 进,黄 进,徐志伟.何首乌补肾作用的相关药理研究进展[J].中药新药与临床药理,2009, 20(5):496-8. Zhang J,Huang J,Xu Z W. Research progress of Polygonum multiflorum for kidney function on pharmacological[J]. Tradit Chin Drug Res Clin Pharmacol, 2009, 20(5):496-8. |
| [4] | 杨利娟,黄君梅,王 飞.何首乌、骨碎补和淫羊藿的植物雌激素作用研究[J].中药与临床, 2012, 3(3):37-40.Yang L J, Huang J M, Wang F.Evaluation of the phytoestrogenic activity of Polygoni Multifl ori Radix, Drynariae Rhizoma and Epimedii Folium[J].Pharm Clin Chin Mat Med, 2012, 3(3):37-40. |
| [5] | 刘钰瑜, 姚卫民, 艾春媚,许碧连. 大黄素对体外大鼠骨髓基质细胞向成骨细胞方向分化的影响 [J]. 中国临床药理学与治疗学, 2005, 10(2):191-5.Liu Y Y, Yao W M, Ai C M, Xu B L. Effects of emodin on differentiation of bone marrow stroma cell into osteoblast in rats in vitro[J]. Chin J Clin Pharmacol Ther, 2005, 10(2):191-5. |
| [6] | 刘钰瑜, 崔 燎, 吴 铁, 姚卫民. 大黄素对体外培养新生大鼠颅骨成骨细胞的影响 [J].中国药理学通报, 2005, 21(2):235-40. Liu Y Y, Cui L, Wu T, Yao W M. Effects of emodin on the proliferation and differentiation of osteoblast isolated from neonatal rat calvarium in vitro[J]. Chin Pharmacol Bull,2005, 21(2):235-240. |
| [7] | 刘钰瑜, 崔 燎, 吴 铁, 姚卫民. 大黄素对体外大鼠骨髓基质细胞向脂肪细胞方向分化的影响 [J]. 中国药理学通报, 2005, 21(7):842-6. Liu Y Y, Cui L, Wu T, Yao W M.Effects of emodin on adipogenesis of marrow stromal cells in vitro [J]. Chin Pharmacol Bull, 2005, 21(7):842-6. |
| [8] | 刘钰瑜, 姚卫民, 艾春媚, 许碧连. 大黄素对大鼠体外颅骨成骨细胞的影响 [J]. 中国药理学通报, 2005, 21(12):1473-7.Liu Y Y, Yao W M, Ai C M, Xu B L.Effects of emodin on osteoblast in vitro [J]. Chin Pharmacol Bull, 2005, 21(12):1473-7. |
| [9] | 黄连芳,吴 铁,谢 华, 廖进民.何首乌煎剂对去卵巢大鼠骨质丢失的防治作用 [J].中国老年学杂志,2005, 25(6):709-10.Huang L F, Wu T, Xie H, Liao J M. The prevention and treatment on bone loss in ovariectomized rats of Polygonum decoction[J]. Chin J Gerontol,2005, 25(6):709-10. |
| [10] | 郑雅元. 何首乌提取物的分离纯化及其抗骨质疏松作用研究 [D].广东医学院,2014. Zheng Y Y.Seperation and purification of the Polygonum Multiflorum extract and its effect on anti-osteoporosis[D]. Guangdong Medical College,2014. |
| [11] | 吴青云,熊雪婷,许碧莲,陈文双.泼尼松对Ⅱ型胶原诱导性关节炎大鼠股骨微结构及生物力学的影响 [J]. 中国药理学通报, 2014, 30(7):1018-22. Wu Q Y,Xiong X T,Xu B L,Chen W S.Effects of prednisone on trabecular microstructure and biomechanical properties of femur in a rat model of type II collagen-induced arthritis[J]. Chin Pharmacol Bull, 2014,30(7):1018-22 |
| [12] | Canalis E. Mechanisms of glucocorticoid-induced osteoporosis [J]. Curr Opin Rheumatol, 2003,15(4):454-7. |
| [13] | Pereira R M,Delany A M,Canalis E.Cortisol inhibits the differentiation and apoptosis of osteoblasts in culture [J]. Bone,2001,28(5):484-90. |
| [14] | 刘俊霞.骨化三醇治疗社区女性绝经后骨质疏松症的疗效及安全性 [J].山西医药杂志, 2014,44(2):207-9.Liu J X.The efficacy and safety of Calcitriol in osteoporosis of postmenopausal women in the community treatment[J].Shanxi Med J, 2014,44(2):207-9. |
| [15] | 朱飞鹏,王洪复,高林峰. 补肾中药对肾脏 1α 羟化酶作用的探讨 [J]. 上海中医药杂志, 2003,37(12):42.Zhu F P,Wang H F, Gao L F.Effects of kidney-nourishing herbs on renal 1-α-hydroxylase[J]. Shanghai J Tradit Chin Med, 2003,37(12):42. |

