


2. 安徽医科大学人兽共患病安徽省重点实验室, 安徽 合肥 230601
2. Anhui Key Laboratories of Zoonoses, Anhui Medical University, Hefei 230601, China
乙型肝炎病毒(hepatitis B virus,HBV)是一种嗜肝DNA病毒,HBV感染导致的慢性乙型肝炎对人类健康造成严重的危害,据报道[1, 2],HBV具有一定的致癌性,随着病程的进展,慢性乙型肝炎可以发展为肝硬化,甚至肝细胞癌。临床上治疗慢性乙型肝炎首选的药物是IFN-α,IFN-α通过与细胞膜上的受体结合诱导表达抗病毒蛋白:如抗粘液病毒蛋白A(MxA)、蛋白激酶(PKR)、2′,5′-寡腺苷酸合成酶(2′,5′-OAS)等发挥抗病毒作用。然而,IFN-α治疗慢性乙型肝炎的疗效并不理想,仅有约1/3的患者有效,但具体机制尚不明。在本课题组前期研究中发现,HBV及其抗原成分能通过多种途径拮抗IFN-α的抗HBV活性[3, 4],其中能被HBV核心蛋白抑制的IFN-α抗病毒蛋白MxA在体外具有抗HBV活性[5]。PKR蛋白是IFN-α诱导的另一种重要抗病毒蛋白。研究表明[6],在体外肝癌细胞模型中,HBV X蛋白的表达被抑制后,PKR蛋白的表达增加,同时HBV的复制减弱。然而,针对PKR蛋白是否能够抑制HBV活性目前尚不清楚。为此,笔者以能够分泌HBV病毒颗粒子的HepG2.2.15细胞为细胞模型,通过构建表达PKR蛋白融合绿色增强荧光蛋白(pEGFP-PKR)真核表达质粒转染HepG2.2.15细胞,分析转染前后细胞外HBV抗原分泌和病毒复制水平,以探讨PKR蛋白体外抗HBV活性,为研发新型制剂治疗慢性乙型肝炎提供一定实验依据。
1 材料与方法 1.1 材料来源HepG2.2.15细胞由本实验室保存,细胞以含10 %胎牛血清的DMEM培养液常规传代培养。质粒pEGFP-N1购自美国Clon-tech公司;PKR基因序列由上海金斯瑞生物科技有限公司合成;LipofectamineTM2000购自美国Invitrogen公司;荧光定量PCR试剂盒购自上海复星长征医学科学有限公司;电化学发光试剂盒购自罗氏诊断产品上海有限公司。
1.2 pEGFP-PKR质粒构建从Pubmed上查找人源性基因PKR (GenBank: M852 94)的mRNA 基因序列,并分别在5′端加上Xhol酶切位点(CTCGAG)、3′端加上BamHI酶切位点(GGATCC),基因序列由上海金斯瑞生物科技有限公司合成。构建过程如下:基因合成产物8 μL,T载体1 μL,solutionⅠ9 μL,4 ℃连接过夜。将连接产物全量转入感受态大肠埃希菌DH5α中,涂于含氨苄霉素的培养板中,并置于37 ℃温箱中培养过夜。无菌接种环挑取4个单克隆菌落小量扩菌,按照质粒抽提步骤提取质粒。取质粒8 μL、Xhol酶0.5 μL、BamHⅠ0.5 μL,10×HBuffer 1 μL,37 ℃酶切2 h,然后琼脂糖凝胶电泳鉴定,得到目的基因与T载体连接产物。空载体pEGFP-N1行双酶切,纯化回收凝胶产物。pEGFP-N1 3 μL、目的基因与T载体连接产物13 μL、T4DNA连接酶2 μL、buffer 2 μL,共20 μL,于4 ℃连接过夜,将产物全量转入DH5α中,涂于含卡那霉素的培养板中,培养过夜。挑取阳性克隆抽提质粒,行双酶切、PCR鉴定,DNA测序,最终得到pEGFP-PKR真核表达质粒。
1.3 实验分组将HepG2.2.15细胞分3组,空白对照组:细胞不做相关处理,空载体组:转染空载体pEGFP-N1,PKR转染组:转染重组质粒pEGFP-PKR,每组设立3个平行对照。
1.4 质粒转染HepG2.2.15细胞复苏后用10 %胎牛血清,以DMEM为基础培养基,并补充2 mmol·L-1谷胺酰胺、1×105 U·L-1青霉素、1×105 U·L-1链霉素、于5% CO2、37 ℃孵育箱培养。HepG2.2.15细胞用6孔板培养,待细胞生长到70%~80%融合时,以LipofectamineTM2000为脂质体,将不同浓度的重组质粒pEGFP-PKR(0、2、4、6 mg·L-1)瞬时转染于HepG2.2.15细胞,36 h后检测上清液中HBV抗原的表达变化;以4 mg·L-1的重组质粒pEGFP-PKR转染HepG2.2.15细胞,在转染后不同的时间点(24、36、48 h),运用荧光显微镜观察融合蛋白EGFP-PKR在细胞内的表达情况及上清液中HBV抗原的表达变化。
1.5 荧光定量PCR检测细胞上清液中HBV DNA的表达在质粒转染36 h后,收集各HepG 2.2.15细胞上清液,以荧光定量PCR试剂盒检测上清液中 HBV DNA的量。具体步骤如下:取50 μL细胞上清液,加入50 μL核酸提取液A,振荡混匀10 s,12 000×g离心10 min,弃上清;然后加入50 μL核酸提取液B至沉淀中,振荡混匀10 s,100℃保温10 min,12 000×g离心2 min。取处理上清液7 μL、HBV PCR缓冲液30 μL、MgCl2 5 μL、荧光探针 5 μL、Taq酶 3 μL,共50 μL于反应管中,低速离心数秒,取出置于PCR仪器。应用Mx3000P PCR仪器进行荧光定量检测,反应条件为:94 ℃预变性5 min,93 ℃ 30 s,60℃ 90 s,共循环40次,反应结束后由软件分析计算出HBV DNA的拷贝数。
1.6 电化学发光法检测HepG2.2.15细胞分泌的 HBV HBsAg和HBeAg分别收集不同时间点各组细胞上清液,以1 200 r·min-1离心10 min以去除细胞碎片,收集的上清液按照电化学发光试剂说明书检测HBsAg和HBeAg。
1.7 统计学处理用SPSS 13.0统计软件进行分析,数据用 ± s 表示,采用t检验和单因素方差分析。
± s 表示,采用t检验和单因素方差分析。
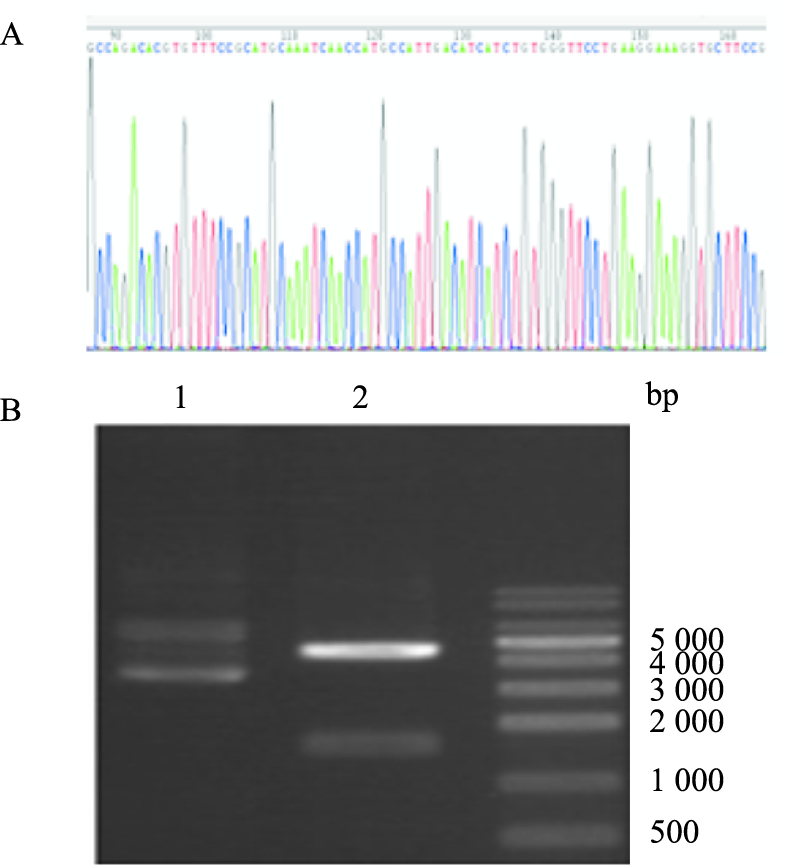
将pEGFP-PKR质粒送至上海生物工程公司测序,证实重组质粒构建正确,插入的目的基因与PKR (GenBank: M85294)比较,核酸同源性为99 %,见Fig1A。重组质粒pEGFP-PKR行Xhol酶、BamHⅠ双酶切后,双酶切分别得到1668 bp大小的目的片段和4651 bp大小载体,所得片段大小与预期相符合,如Fig1B。
|
| Fig 1 Results of pEGFP-PKR sequencing and enzyme digestion A: The map of pEGFP-PKR sequencing; B: The map of pEGFP-PKR enzyme digestion. Lane 1:recombinant plasmid of pEGFP-PKR; Lane 2:The result of pEGFP-PKR digested by two enzymes |
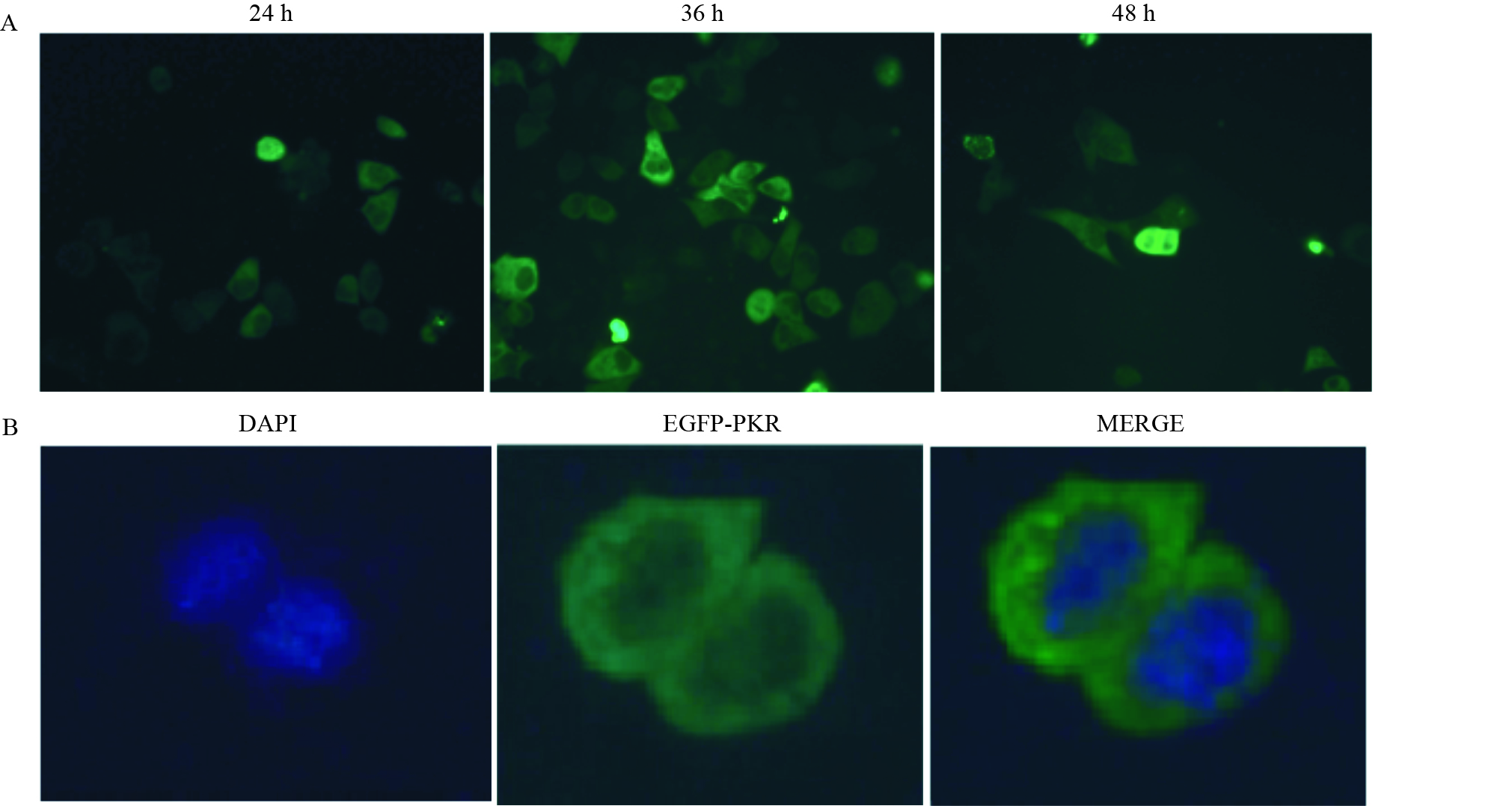
质粒pEGFP-PKR转染HepG2.2.15细胞24 h后,在荧光显微镜下即可观察到绿色荧光,转染36 h绿色荧光强度最强,即抗病毒蛋白PKR在 HepG2.2.15细胞中表达最强(Fig2A)。且以胞质表达为主,细胞核也有微量表达(Fig2B)。
|
| Fig 2 Expression of pEGFP-PKR fusion protein in HepG2.2.15 cells observed by fluorescent microscope A: The different expression of plasmid pEGFP-PKR transfected into HepG2.2.15 cells in different time; B: The subcellular localization of pEGFP-PKR fusion protein in HepG2.2.15 cells |
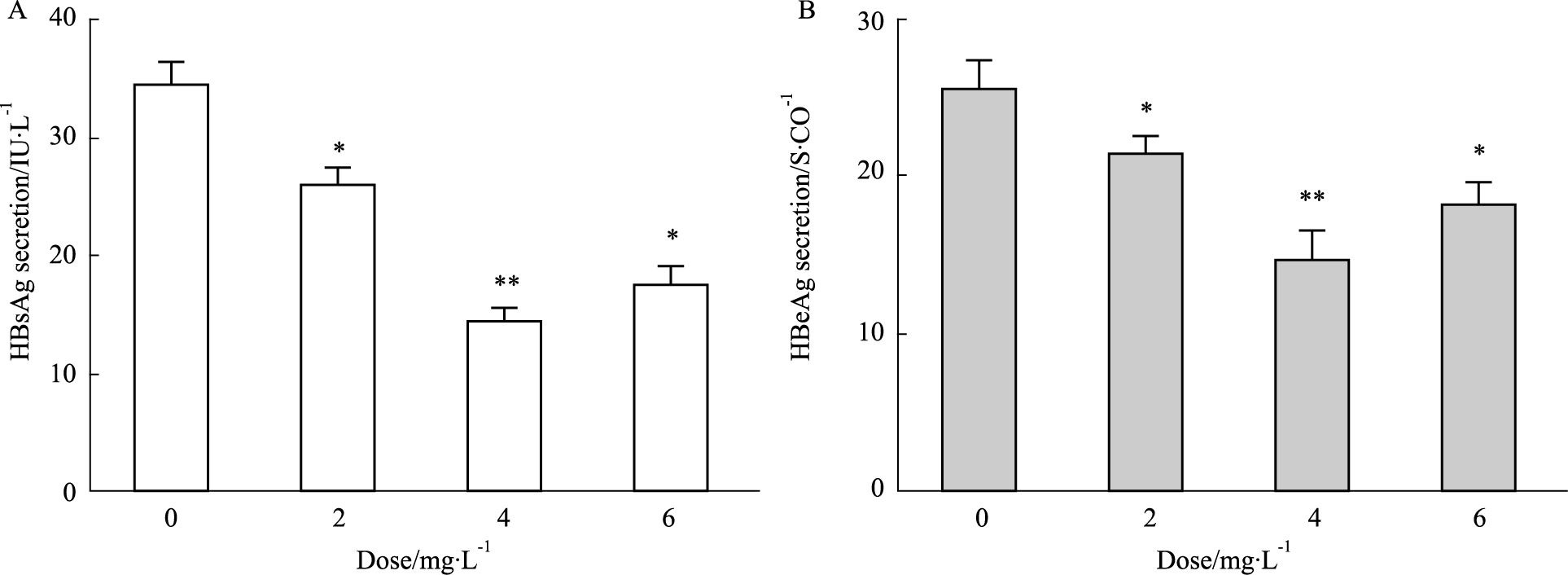
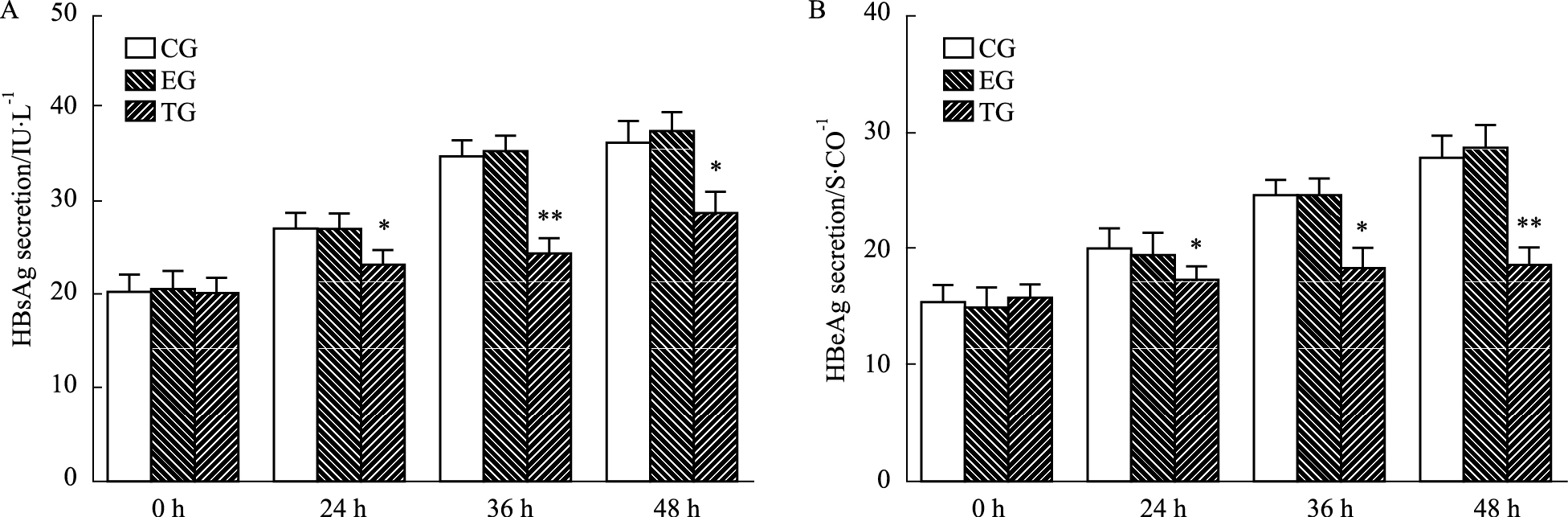
将不同浓度的重组质粒pEGFP-PKR(0、2、4、6 mg·L-1)瞬时转染于HepG2.2.15细胞36 h后,电化学发光分析显示,与0 mg·L-1 pEGFP-PKR转染剂量组相比,其它剂量转染组细胞外HBsAg和HBeAg分泌量均有明显下降(P < 0.05),随着转染质 粒pEGFP-PKR浓度的增加,HepG2.2.15细胞HBV 抗原分泌逐步降低,其中4 mg·L-1抑制效果最为明显,差异具有统计学意义(P < 0.01),如Fig3所示。将4 mg·L-1质粒pEGFP-PKR瞬时转染于HepG2.2.15细胞中,在转染后不同的时间点(0、24、36、48 h)检测细胞上清液HBV抗原的分泌,结果显示:空载体组与空白组相比,HBV抗原分泌无明显变化(P>0.05);与空载体组相比,随着转染时间延长,PKR转染组HBV抗原的分泌量逐渐下降(P < 0.05),其中转染后36 h对HBsAg的抑制作用最强(P < 0.01),对HBeAg的抑制作用在转染后48 h最强(P < 0.01),如Fig4所示。
|
| Fig 3 Effects of different doses of plasmid pEGFP-PKR transfection on HBV antigen secretion A: The influence of different doses of plasmid pEGFP-PKR transfection on the secretion of HBsAg; B: The influence of different doses of plasmid pEGFP-PKR transfection on the secretion of HBeAg. *P<0.05,**P<0.01 vs 0 mg·L-1 plasmid pEGFP-PKR transfection |
|
| Fig 4 Effects of pEGFP-PKR transfection on secretion of HBV antigen in different time A: The influence of pEGFP-PKR transfection on the secretion of HBsAg in different time; B: The influence of pEGFP-PKR transfection on the secretion of HBeAg in different time. CG:Control; EG:Empty vector;TG:Transfection. *P<0.05,**P<0.01 vs control group and empty vector group. |
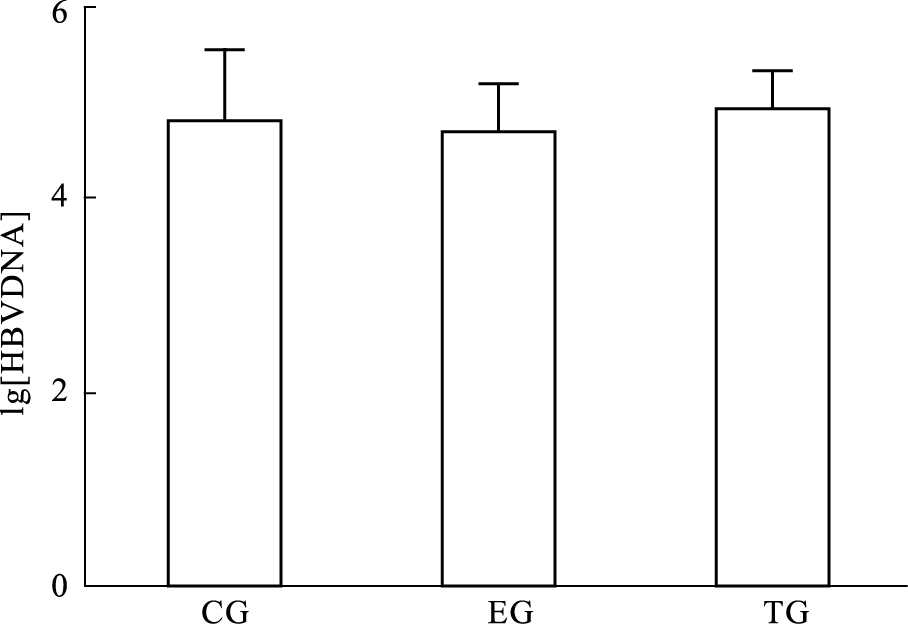
应用实时荧光定量PCR(Real-time PCR)分析发现,与空白对照组比较,各处理组对HepG2.2.15细胞上清液中HBV DNA无明显抑制作用(P>0.05),见Fig5。
|
| CG:Control; EG:Empty vector;TG:Transfection. Fig 5 Expression of HBV DNA in supernatant of HepG2.2.15 cells by real-time fluorescence quantitative PCR |
IFN-α 作为一种重要的细胞因子,具有抗病毒、抗细胞增殖和免疫调节等多种生物学功能,是临床 治疗乙型肝炎的首选药物。然而,临床上运用IFN-α治疗乙型肝炎的疗效不甚理想,因此,寻找和研发新型的治疗HBV感染的药物和蛋白制剂非常必要。
有研究报道[7, 8, 9],PKR作为干扰素可诱导的环腺苷酸非依赖性丝氨酸/苏氨酸激酶,其N端dsRBM与病毒诱导的dsRNA在细胞内相结合后,进而诱发PKR的底物蛋白eIF-2磷酸化修饰,干预病毒基因进入宿主细胞核糖体环节,最终发挥抑制病毒复制的作用。PKR是干扰素诱导的一种重要的抗病毒蛋白,在IFN-α的抗HBV效应中发挥了极其重要的作用[10]。HBV是一种嗜肝病毒,感染肝细胞后本身并不引起肝细胞损伤,而是由于特异和非特异的免疫细胞攻击作用导致肝细胞损伤,若能寻找到在肝细胞内有效抑制HBV复制抗病毒蛋白,这对于慢性乙型肝炎的治疗将具有积极的意义。结合课题组前期研究结果,我们推测PKR作为一种干扰素诱导的重要广谱抗病毒蛋白,很可能对HBV抗原分泌或病毒复制具有一定抑制作用。为此,在本研究中,通过构建表达PKR蛋白的绿色增强荧光蛋白-PKR(pEGFP-PKR)真核表达质粒,将其转染能分泌完整HBV病毒颗粒子的肝胚瘤细胞株HepG2.2.15细胞,分析转染前后不同时间点和转染剂量对肝细胞外HBV抗原分泌和病毒复制水平影响,以研究PKR蛋白体外是否具有抗HBV活性。结果显示,抗病毒融合蛋白PKR主要在HepG2.2.15细胞胞质表达,细胞核有微量表达,随着转染质粒pEGFP-PKR剂量的增多,HepG2.2.15细胞HBV抗原分泌逐步降低,直至4 mg·L-1抑制效果最为明显,而在6 mg·L-1对HBV抗原抑制效果不如4 mg·L-1,很可能是由于高剂量转染浓度增加转染试剂对肝细胞的细胞毒作用。然而,HepG2.2.15细胞上清液中HBV复制水平并未有明显变化,这与我们前期报道IFN抗病毒蛋白脱离宿主体内免疫系统的参与会影响其抗病毒活性的结论是一致的[11]。此外,PKR抗病毒蛋白抗HBV活性也呈现一定时间依赖性,随着转染时间延长,PKR抗病毒蛋白抗HBV活性逐步升高,其中转染后36 h对HBsAg的抑制作用最强,对HBeAg的抑制作用在转染后48 h最强。然而本研究中,PKR转染组 HBV DNA与对照组相比差异无统计学意义,这与体内有关抗病毒蛋白具有较好的抗HBV活性报道不相符,可能是由于抗病毒蛋白对HBV DNA复制的抑制作用需要体内免疫系统的参与,而体外细胞模型缺乏体内复杂的免疫调节系统,因此不能表现出良好的抗HBV复制作用。
本研究表明,在体外,PKR蛋白具有一定独立的抗HBV活性,且主要在肝细胞胞质发挥作用,本研究为PKR蛋白的抗病毒作用及临床运用PKR蛋白制剂治疗慢性乙型肝炎提供实验依据,但是如何让体外实验在人体内得到验证还需要进一步的探讨,下一步的研究拟以感染HBV的小鼠为动物模型,在体内验证PKR蛋白是否能够有效的发挥抗HBV活性。随着进一步的研究,PKR蛋白可望单独或与其它抗病毒药物(如IFN-α)一起运用于乙型肝炎的临床治疗,为乙肝病人提供新的治疗选择。
| [1] | Chisari F V, Klopchin K, Moriyama T, et al.Molecular pathogenesis of hepatocellular carcinoma in hepatitis B virus transgenic mice[J].Cell, 1989, 59 (6):1145-56. |
| [2] | Guidotti L G, Rochford R, Chung J, et al. Viral clearance without destruction of infected cells during acute HBV infection[J]. Science, 1999,284(5415):825-9. |
| [3] | 管世鹤,潘 颖,杨 凯,等. HBx蛋白对α干扰素诱导的MxA蛋白表达的影响[J].中国药理学通报, 2011, 27(6):797-800.Guan S H, Pan Y, Yang K, et al. Effects of hepatitis B virus X protein on the expression of interferon-induced MxA protein[J]. Chin Pharmacol Bull, 2011,27(6):797-800. |
| [4] | 管世鹤,潘 颖,杨 凯,等. 肝胚瘤细胞株HepG2中HBx蛋白对SOCS3表达的影响及其机制[J].中国微生态学杂志,2012, 28(5):385-8.Guan S H, Pan Y, Yang K, et al.The influence of hepatitis B virus X protein on the expression of SOCS3 protein and its mechanisms in HepG2 cells[J]. Chin J Microecol, 2012, 28 (5):385-8. |
| [5] | 潘 颖,管世鹤,陆应玉,等.MxA蛋白对HepG2.2.15细胞HBV复制的影响[J].安徽医科大学学报, 2011,46(3):213-5.Pan Y, Guan S H, Lu Y Y,et al.The inhibition of HBV replication by MxA protein in HepG2.2.15 cells[J].Acta Univ Med Anhui, 2011, 46(3):213-5. |
| [6] | Han Q, Zhang C, Zhang J, et al. Involvement of activation of PKR in HBx-siRNA mediated innate immune effects on HBV inhibition[J].PLos One, 2011, 6(12): e27931. |
| [7] | Hovanessian A G. On the discovery of interferon-inducible, double-stranded RNA activated enzymes: the 2'-5'oligoadenylate synthetases and the protein kinase PKR[J]. Cytokine Growth Factor Rev, 2007, 18(5-6):351-61. |
| [8] | Munir M, Berq M. The multiple faces of protein kinase R in antiviral defense[J]. Virulence, 2013, 4(1):85-9. |
| [9] | 谢 炯,夏 君,张佩芬,等. 蛋白激酶PKR的克隆表达及其相互作用的蛋白质的亲和纯化[J].细胞与分子免疫学杂志,2012, 28(6):592-5.Xie J, Xia J, Zhang P F, et al. Cloning and expression of PKR gene and affinity purification of PKR interacting proteins[J]. Chin J Cell Mol Immunol,2012, 28(6):592-5. |
| [10] | Park I H, Baek K W, Cho E Y, et al. PKR-dependent mechanisms of interferon-α for inhibiting hepatitis B virus replication[J]. Mol Cells, 2011, 32(2):167-72. |
| [11] | Manns M P. Current state of interferon therapy in the treatment of chronic hepatitis B[J]. Semin Liver Dis, 2002, 22 (Suppl l):7-13. |

