


2. 重庆医科大学附属第一医院急诊医学科, 重症医学科, 重庆 400016
2. Dept of Emergency Medicine ICU, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
梓醇属环烯醚萜苷类化合物,是从玄参科植物地黄中分离的单一化学成分,化学结构式如Fig1所示。具有抗脑缺血损伤[1, 2]、抗老年性痴呆[3, 4, 5, 6, 7]、抗炎[8, 9]、抑制毛细血管通透性[10]、止痛、抗肿瘤、缓泻、降血糖[11, 12, 13]、保肝及抗衰 老[14]等多种药理作用[15]。本文就目前梓醇的多效性相关信号通路进行整理和总结,以拓宽对梓醇信号通路分子机制的进一步理解和认识,为梓醇的深入研究提供新的思考方向。
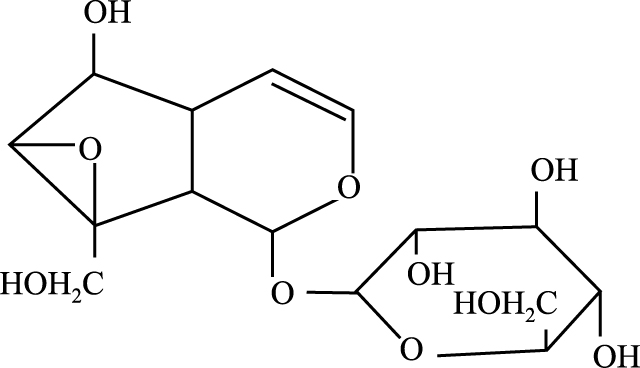
|
| Fig 1 Chemical structure of Catalpol |
PI3K/AKT信号通路 (Fig2) 与细胞生长、增殖、凋亡、存活及轴突再生密切相关,其中PI3K、AKT、mTOR是该通路关键节点,Phosphatase and tensin homologue deleted on chromosome 10 (PTEN)是该通路的负性调节因子。当生长因子与其受体结合后可以激活该通路,磷脂酰肌醇4,5二磷酸(phosphtidyli-nositol(4,5)-bisphosphate,PIP2)变成磷脂酰肌醇3,4,5-三磷酸(phosphatidylinositol 3,4,5-trisphosphate,PIP3),进而活化磷酯酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K),PI3K进一步活化AKT,活化的AKT可以直接磷酸化 mammalian target of rapamycin (mTOR),也可以通过抑制TSC1/TSC2复合物来间接调控mTOR。磷酸化的mTOR激活细胞存活[比如:Bcl-2( B淋巴细胞瘤-2基因,B-cell lymphoma-2)和Bcl-xl(Bcl-2家族蛋白之一,B-cell lymphoma-extra large)]或凋亡[Bad和Bcl-2相关X蛋白(Bcl-2 associated X protein,BAX)]基因转录,从而调控细胞生长存活。磷酸化的AKT蛋白会让Bad蛋白失活,从而抑制细胞凋亡[16]。AKT也可通过抑制半胱氨酸天门冬氨酸特异的蛋白酶9(caspase-9),调节半胱氨酸天门冬氨酸特异的蛋白酶3(caspase-3)的表达,从而调节细胞凋亡。
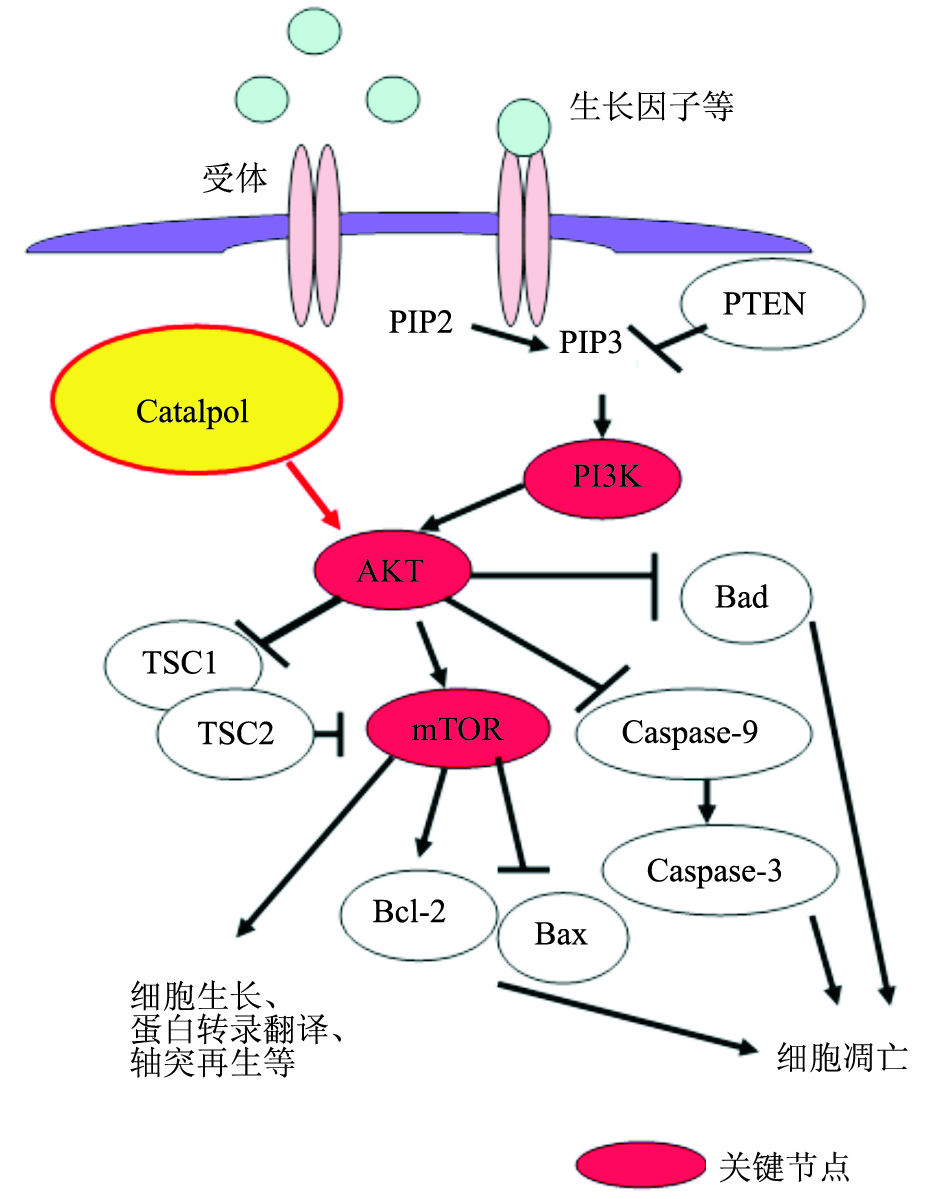
|
| Fig 2 Catalpol and PI3K/AKT signaling pathway (Hu L, et al,2010) |
梓醇具有治疗脑缺血作用[17],这种作用跟梓醇抗神经元[18]、内皮细胞[19]凋亡有关,其机制包括活化PI3K-AKT-Bad信号通路[19],清除活性氧[20, 21],增加Bcl-2的表达,降低Bax[19, 21, 22, 23]的表达。文献[23]中使用大鼠嗜铬细胞瘤(PC12)细胞株,对梓醇对过氧化氢诱导的细胞凋亡的影响进行了研究。结果显示,过氧化氢诱导PC12细胞凋亡的Bcl-2下调,Bax上调,线粒体细胞色素C释放到细胞质,同时,活化caspase-1和caspase-3。而梓醇不仅可以抑制Bcl-2下调,还可以下调Bax,抑制线粒体细胞色素C释放到细胞质中,同时抑制caspase-3的活化,最终对PC12细胞起到保护作用。但是梓醇对该通路的各节点的影响尚无系统研究,值得进一步考察。
2 梓醇与JAK2/STAT3信号通路 2.1 JAK2/STAT3信号通路组成和功能Janus蛋白酪氨酸激酶2(JAK2)/信号转导和转录激活子3(STAT3)信号通路(Fig3),参与细胞增殖、分化、凋亡以及免疫调节等许多重要的生理学过程,同时还与血管新生相关,STAT3是血管新生的调节器[24]。红细胞生成素(EPO)通过与其受体EPOR结合后会激活JAK,进一步激活STAT3,磷酸化后的STAT3转位入核调节血管内皮生长因子 (vascular endothelial growth factor,VEGF)的转录,进而促进血管新生。

|
| Fig 3 Catalpol and JAK2/STAT3 signaling pathway(Zhu HF, et al,2010) |
STAT3是联系EPO与VEGF的分子信号,本课题组研究发现,梓醇可以上调脑缺血区EPO、EPOR、p-STAT3及VEGF的表达,促进缺血脑区血管新生和重塑,运用磷酸化后的STAT3抑制剂AG490后,明显下调了p-STAT3和VEGF的表达(Fig4),但梓醇可逆转这一趋势,提示梓醇调控血管新生与JAK2/STAT3信号通路有关,但具体环节还需要进一步研究和确证。
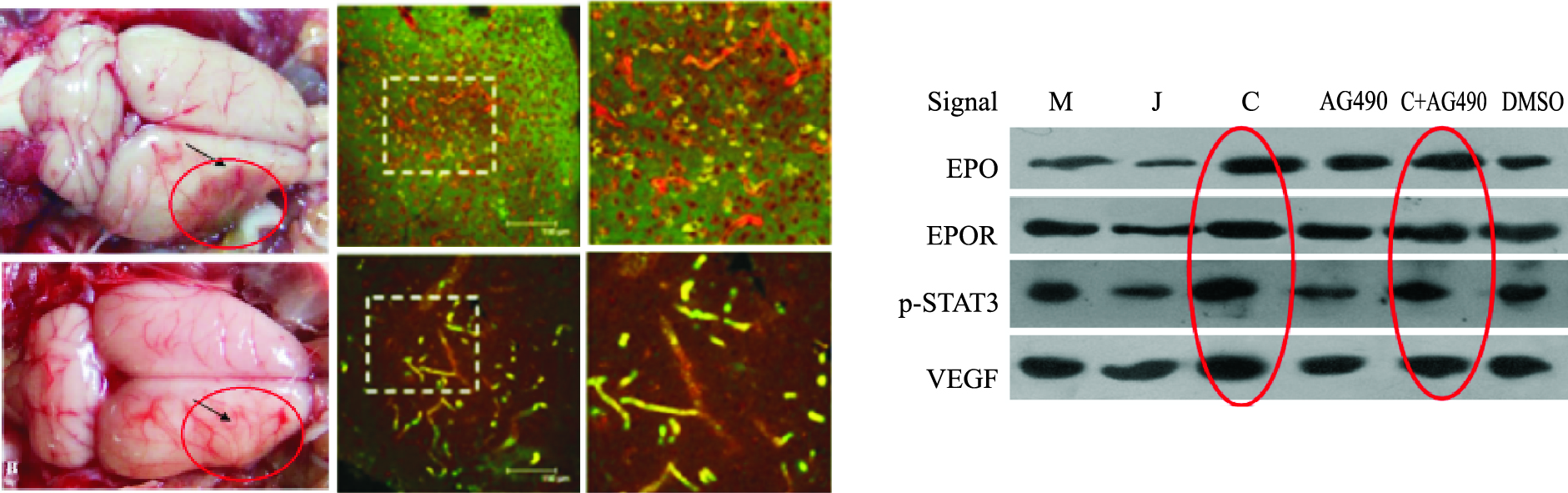
|
| Fig 4 Catalpol and JAK2/STAT3 signaling pathway(Zhu HF, et al,2010) |
脑源性神经营养因子(brain derived neurotrophic factor,BDNF) 是在脑内合成的一种蛋白质,能够增强突触间递质的释放,加强突触联系,刺激成年神经元轴突和树突出芽,参与神经元的可塑性调节,维持成熟神经元的正常功能,对神经元的存活、分化、生长发育起重要作用。同时BDNF拮抗多种因素对神经元的损伤,调节合成代谢,促进受损神经元再生及分化,帮助受损神经元的修复,防止受损神经元死亡[25]。如Fig5所示,神经细胞通过自分泌BDNF,激活细胞质cAMP(环磷酸腺苷)和PKA(cAMP依赖蛋白激酶,简称激酶A——protein kinase A)活性,进一步激发细胞BDNF的自分泌。同时BDNF/TrkB信号会激活PI3k,促进受体TrkB囊泡运输,进一步地增强了局域的BDNF/TrkB信号。此外,BDNF有2个特异性受体:TrkB和p75。BDNF大多数情况下与TrkB受体结合,同时激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) MAPK/ErK信号通路及PI3K/AKT信号通路,发挥其对缺氧神经元的保护作用[26, 27]。而少数情况下,BDNF则与p57受体结合,抑制轴突生长[28]。BDNF通过以上方式促进神经元的轴性生长及连接,介导神经元的存活,并参与对各种神经元应激的反应。同时诱导神经前体细胞的定向分化,加快神经元迁移,促使神经元再生,有利于神经系统的成熟和完善。
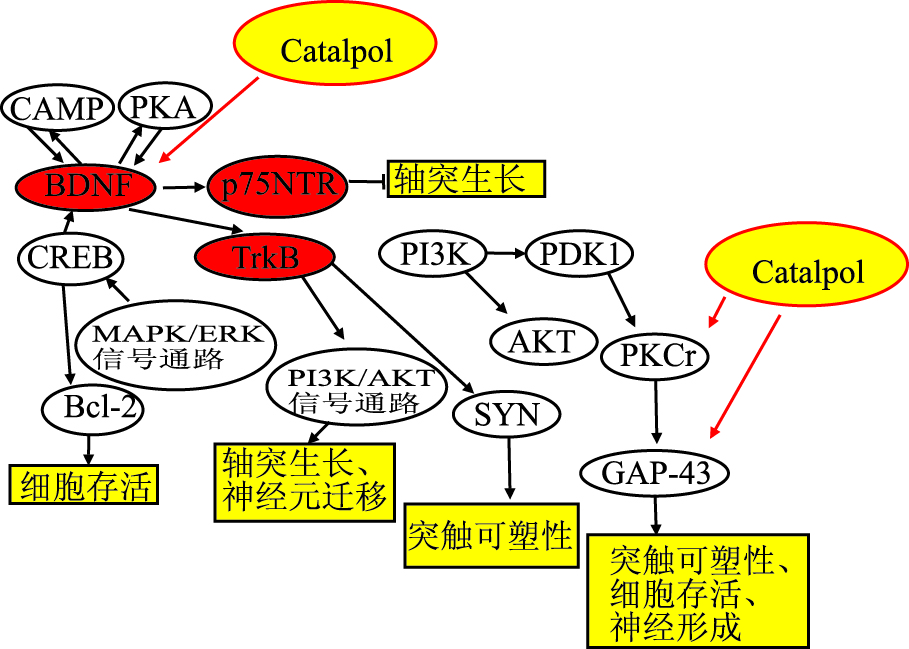
|
| Fig 5 Catalpol and BDNF/TrkB signaling pathway(Liu J, et al,2006) |
梓醇可以改善神经退行性疾病,这种作用跟改善神经可塑性有关,其机制包括活化BDNF/TrkB 信号通路[29],上调突触素蛋白表达。文献[30]中运用在体(青年、老年SD大鼠)模型,研究梓醇对神经可塑性的影响,结果显示,梓醇可以增加突触前蛋白的表达,提高PKC(分裂原激活的蛋白激酶)、BDNF的水平,而这些水平的增加与突触素(synaptophysin,SYN)和生长相关蛋白-43(growth associated protein-43,GAP-43)的增加有很大的相关性。如图5所示。梓醇可以增加PKC、BDNF的水平,而PKC增加后又可以进一步促进GAP-43的增加,BDNF增加可以促进突触素的增加,且这四者(BDNF、PKC、GAP-43、SYN)之间呈正相关性。
那么梓醇对BDNF的作用究竟是促进其旁分泌,还是自分泌,或者两者都有?这还需要进一步的研究。
4 梓醇与乙酰胆碱信号通路 4.1 乙酰胆碱信号通路组成和功能乙酰胆碱,分子式为CH3COOCH2CH2N+(CH3)3,是一种神经递质,能特异性地作用于各类胆碱受体,但其作用广泛,选择性不高。在神经细胞中,乙酰胆碱是由胆碱和乙酰辅酶A在胆碱乙酰移位酶(胆碱乙酰化酶)的催化作用下合成的。
中枢胆碱能系统与学习、记忆密切相关,乙酰胆碱(ACh)是中枢胆碱能系统中重要的神经递质之一,其主要功能是维持意识的清醒,在学习记忆中起重要作用。而脑内细胞外Ach的变化主要反映胆碱能神经元的活动,皮层和海马等脑区的ACh主要来源于基底前脑胆碱能神经元的纤维投射。应用微透析等技术在体检测清醒、自由活动动物认知过程中脑内乙酰胆碱的含量,可以研究ACh与特定行为反应和认知活动之间的关系。研究发现当机体需要对新刺激进行分析时,在学习与记忆、空间工作记忆、注意、自发运动和探究行为等认知活动中,基底前脑胆碱能神经元被激活,脑内ACh的释放也随之改变。结果提示脑内胆碱能递质系统活动与认知过程密切相关[31]。
4.2 梓醇与乙酰胆碱信号通路相关研究梓醇可以改善脑中风后学习与记忆能力,这与梓醇调节乙酰胆碱信号通路(Fig6)有密切关系。本课题组研究发现[32],梓醇可以上调M型受体、ACh、乙酰胆碱转移酶(ChAT),下调乙酰胆碱酯酶(AChE)来调节学习与记忆能力;并且梓醇还可以上调BDNF 的表达,而BDNF与ACh之间存在正相关性。

|
| Fig 6 Catalpol and ACh signaling pathway(wan D, et al,2013) |
是否学习与记忆能力的提高与BDNF诱导的神经重塑有关?BDNF与ACh 又存在怎样的内在联系?还需要进一步的研究。
5 梓醇与NF-κB信号通路 5.1 NF-κB信号通路组成和功能哺乳动物转录因子NF-κB信号通路参与免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种病理生理过程。 NF-κB 是由p50和p65组合而成的二聚体。静止状态时,NF-κB以无活性的潜在状态存在于细胞质中,它与抑制因子IκB 结合组成一个三聚体p50-p65-IκB。当细胞受到各种胞内外刺激后,NF-κB 二聚体得到释放。然后NF-κB 二聚体通过各种翻译后的修饰作用而被进一步激活,并转移到细胞核中,再与目的基因结合,以促进目的基因转录。如Fig7所示。
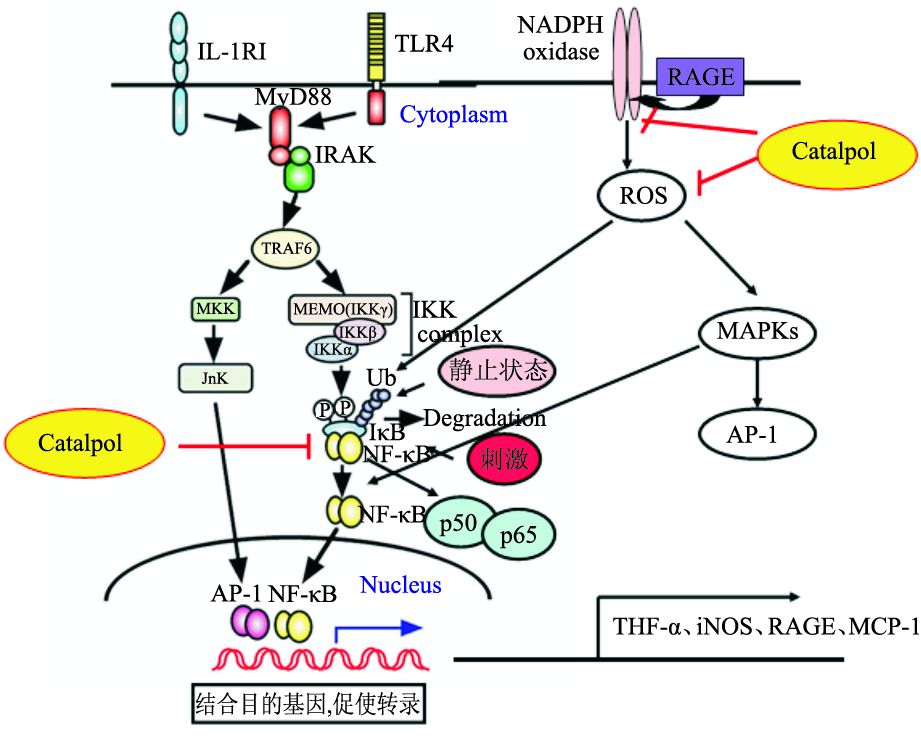
|
| Fig 7 Catalpol and NF-κB signaling pathway(Choi HJ,et al,2013) |
炎症是多种疾病的共同病理表现。梓醇改善神经性疼痛[33],治疗急性胰腺炎[34] 、急性肺炎[35]、糖尿病[8] ,跟抗炎有关,其机制包括抑制NF-κB通路的激活。文献[8]中运用离体实验模型,选用单核THP-1细胞,研究梓醇对糖基化终产物(AGE)诱导的糖尿病并发症的作用,结果如Fig7显示,梓醇可以降低促炎因子(MCP-1、TNF-α、iNOS以及AGE的受体RAGE)的表达,抑制NF-κB转录的活性,抑制NF-κB IκBα迁移的降低,还有抑制MAP激酶的磷酸化。
需要指出的是,弄清NF-κB信号通路在炎症反应中的机制对于治疗一些疾病(如神经损伤、糖尿病等)有着极为广阔的前景。
6 梓醇与MAPK信号通路 6.1 MAPK信号通路组成和功能丝裂原活化蛋白激酶(MAPK)信号通路参与介导细胞生长、发育、分裂和分化等多种生理及病理过程。哺乳动物细胞中MAPK通路中的主要节点包括Ras(小分子鸟苷酸结合蛋白)、Raf(丝/苏酸蛋白激酶)、ERK1/2(extracellular signal-regulated kinase)、JNK(c-Jun氨基末端激酶,c-Jun N-terminal kinase)、p38MAPK。该通路包括3条,如Fig8所示。这几条通路之间存在相互“串话”,从而导致通路间产生相互协同或抑制作用[36]。

|
| Fig 8 Catalpol and MAPK signaling pathway (Jiang GL, et al,2014) |
梓醇可以治疗急性肺炎,改善神经退行性疾病[37],这种作用跟抗炎、抗凋亡[37, 38]有关,其机制包括抑制MAPK通路的激活。文献[37]中选择PC12细胞来研究梓醇对于LPS(脂多糖)诱导的离体神经退行性疾病模型的作用,结果显示,梓醇可以增加细胞存活率,降低LDH和细胞内活性氧(ROS),减少细胞凋亡以及降低细胞内钙离子浓度,下调磷酸化钙依赖性蛋白激酶的水平,增加bcl-2的表达,降低bax的表达,上述作用是通过阻断CaMKII依赖性的ASK-1/JNK/p38信号通路来实现的,如Fig8所示。
7 梓醇与TGFβ/Smad信号通路 7.1 TGFβ/Smad信号通路组成和功能转化生长因子β(transforming growth factor betas,TGFβs)超家族是调节细胞分化成熟过程的极其重要的一类生长因子,参与细胞多种功能调节,涉及胚胎发育、对疾病和伤害的反应、成熟个体稳态的保持等多个方面,参与细胞迁移、生长、分化和细胞凋亡等一系列过程[39]。TGFβ与其受体结合后,Smad 2,3 (drosophila mothers against decapentaplegic 2,3)蛋白磷酸化,与Smad 4(drosophila mothers against decapentaplegic 4)结合入核,进一步调控核内的靶基因转录,参与调节细胞的分化成熟。如Fig9所示。

|
| Fig 9 Catalpol and TGF-β/Smad signaling pathway(Lin YM, et al,2011) |
刘煜敏等[40]研究发现,梓醇作为六味地黄丸中的主要活性成分之一,可明显抑制HK-2细胞Smad2蛋白磷酸化并促进核转录抑制因子Ski相关活性蛋白N(Ski-related novel protein N,SnoN)蛋白的表达,但对Smad7(drosophila mothers against decapentaplegic protein 7)蛋白表达未见明显调控作用。
对于Smad信号通路而言,目前的研究还处在单个蛋白水平上,进一步解析其引导的复杂蛋白网络,意味着可能明显增进大家对这条通路调节功能的认识和理解。
8 展望综上所述,目前,梓醇的研究涵盖了很多方面,所涉及的细胞模型包括PC12细胞、内皮细胞、单核THP-1细胞、小胶质细胞、神经元胶质细胞、星型胶质细胞、皮质神经元细胞等;选择的在体模型有脑缺血线栓模型、脑缺血电凝模型、脑缺血氧糖剥夺模型、脑缺血/再灌注损伤模型、帕金森综合征模型、阿尔茨海默症模型、糖尿病及其并发症模型、哮喘模型、急性胰腺炎模型、急性肺炎模型、卵巢功能衰竭模型、心肌缺血/再灌注损伤模型等。近些年来研究所涉及的信号通路作用机制的文献也逐渐增多,但大多数研究都停留在梓醇对单一信号通路的影响,事实上,信号通路之间是网络联系的,存在相互串话(cross talk)。比如,BDNF可以通过与其受体TrkB结合而去激活PI3K和MAPK信号通路,去调节细胞的存活、轴突生长、蛋白的转录翻译、细胞的增殖、分化、凋亡及应激反应等;而MAPK信号通路中的CREB可以促进BDNF的分泌;同时,MAPK又可以调控NF-κB,进一步调控凋亡和起到抗炎的作用;且BDNF又与ACh正相关,那么BDNF与ACh 又存在怎样的内在联系?是否学习与记忆能力的提高与BDNF诱导的神经重塑有关? 而PI3K和MAPK两条信号通路之间是否存在串话?它们对疾病的调控又是否起到协调作用,亦或是其他作用?BDNF旁分泌与自分泌的调控又是怎样协调的?这些都还需要进一步的研究。总之,梓醇具有多效性,其后续研究应该关注其对疾病相关信号通路串话的影响。
| [1] | Li D Q, Duan Y L, Bao Y M, et al. Neuroprotection of catalpol in transient global ischemia in gerbils[J]. Neurosci Res, 2004, 6(9):169-77. |
| [2] | Li D Q, Bao Y M, Zhao J J, et al. Neuroprotective properties of catalpol in transient global cerebral ischemia in gerbils: dose-response, therapeutic time-window and long-term efficacy[J]. Brain Res, 2004, 9(41):179-185. |
| [3] | 石桂芳,王贺双,毛玉荣,等. 梓醇对鱼藤酮所致小鼠脑线粒体损伤的保护作用[J]. 现代生物医学进展,2012,12(29):5661-4. Shi G F, Wang H S, Mao Y R, et al. Catalpol protects mitochondrial injury of brain in mice induced by Rotenone[J]. Prog Mod Biomed, 2012, 12(29): 5661-4. |
| [4] | 田媛媛. 梓醇对中脑多巴胺能神经元的保护作用[D]. 大连理工大学,2006. Tian Y Y. The protective effects of Catalpol on dopaminergic neurons[D]. Dalian University of Technology, 2006. |
| [5] | 刘 晶. 梓醇对发育和衰老中神经可塑性的影响及机制[D]. 大连理工大学,2006. Liu J. The effect and mechanism of Catalpol on neural plasticity in development and aging[D]. Dalian University of Technology, 2006. |
| [6] | Jiang B, Du J, Liu J H, et al. Catalpol attenuates the neurotoxicity induced by β-amyloid(1-42) in cortical neuron-glia cultures[J]. Brain Res, 2008, 1188:139-47. |
| [7] | Wang Z, Liu Q, Zhang R,et al. Catalpol ameliorates beta amyloid-induced degeneration of cholinergic neurons by elevating brain-derived neurotrophic factors[J]. Neuroscience, 2009, 163(4):1363-72. |
| [8] | Choi H J, Jang H J, Chung T W,et al. Catalpol suppresses advanced glycation end-products-induced inflammatory responses through inhibition of reactive oxygen species in human monocytic THP-1 cells[J]. Fitoterapia, 2013, 1(14):19-28. |
| [9] | Bi J, Jiang B, Andrew Zorn, et al. Catalpol inhibits LPS plus IFN-κ-induced inflammatory response in astrocytes primary cultures[J]. Toxicol Vitro, 2013, 27(2):543-50. |
| [10] | 祝慧凤, 万 东, 张 芬. 地黄梓醇脑保护的药理作用及机制研究进展[J]. 中国中医杂志,2009, 34(23):2983-5. Zhu H F, Wan D, Zhang F. The research progress of Dihuang Catalpol on neuroprotective pharmacological effects and mechanism[J]. Chin J Tradit, 2009, 34(23): 2983-5. |
| [11] | Wang C F, Li D Q, Xue H Y, et al. Oral supplementation of catalpol ameliorates diabetic encephalopathy in rats[J]. Brain Res, 2010, 13(7):158-65. |
| [12] | Huang W J, Niu H S, Lin M H, et al. Antihyperglycemic effect of Catalpol in streptozotocin-induced diabetic rats[J]. J Nat Prod, 2010, 73(6):1170-2. |
| [13] | Li X,Xu Z, Jiang Z, et al. Hypoglycemic effect of catalpol on high-fat diet/streptozotocin-induced diabetic mice by increasing skeletal muscle mitochondrial biogenesis[J]. Acta Biochim Biophys Sin, 2014, 46(9):738-48. |
| [14] | Zhang X,Jin C, Li Y, et al. Catalpol improves cholinergic function and reduces inflammatory cytokines in the senescent mice induced by D-galactose[J]. Food Chem Toxicol, 2013, 8(58):50-5. |
| [15] | 蔡其燕,姚忠祥. 梓醇在神经系统作用的研究进展[J]. 现代生物医学进展,2010, 10(18):3589-91. Cai Q Y, Yao Z X. The research progress of Catalpol in the nervous system[J]. Prog Mod Biomed, 2010, 10(18): 3589-91. |
| [16] | 陈洪菊,李晋辉. mTOR信号通路与调节[J]. 医学分子生物学杂志,2009,6(6):542-6. Chen H J, Li J H. mTOR signaling pathway and regulation[J]. J Med Molecul Biol, 2009, 6(6): 542-6. |
| [17] | 杨洪枫,李爱峰,张永清. 地黄中梓醇的研究进展[J]. 亚太传统医药,2012, 8(5):209-11. Yang H F, Li A F, Zhang Y Q. The research progress of Catalpol in Rehmannia Root[J]. Asia-Pacific Tradit Med, 2012, 8(5): 209-11. Chen W, Li X, Jia L Q, et al. Neuroprotective activities of catalpol against CaMKII-dependent apoptosis induced by LPS in PC12 cells[J]. Br J Pharmacol, 2013, 169(5):1140-52. |
| [19] | Hu L, Sun Y, Hu J. Catalpol inhibits apoptosis in hydrogen peroxide-induced endothelium by activating the PI3K/Akt signaling pathway and modulating expression of Bcl-2 and Bax[J]. Europ J Pharmacol, 2010, 628(1-3):155-63. |
| [20] | Zhang X, Liu W, Niu X, et al. Systemic administration of catalpol prevents D-galactose induced mitochondrial dysfunction in mice[J]. Neurosci Lett, 2010, 473(3):224-8. |
| [21] | Liang J H, Du J, Xu L D, et al. Catalpol protects primary cultured cortical neurons induced by Aβ1-42 through a mitochondrial-dependent caspase pathway[J]. Neurochem Int, 2009, 55(8):741-6. |
| [22] | 宋晓琨. 梓醇预处理对大鼠缺血/再灌注心肌保护作用的研究[D]. 辽宁医学院,2011. Song X K. The research of preconditioning Catalpol on ischemic reperfusion myocardial protection in rat[D]. Liaoning Medical College, 2011. |
| [23] | Bi J, Jiang B, Liu J H, et al. Protective effects of catalpol against H2O2-induced oxidative stress in astrocytes primary cultures[J]. Neurosci Lett, 2008, 442(3):224-7. |
| [24] | Pages G, Pouysequr J. Transcriptional regulation of the vascular endothelial growth factor gene a concert of activating factors[J]. Cardiovascul Res, 2005, 65(3):564-73. |
| [25] | 付美红,李海涛. 脑源性神经营养因子与脑缺血的研究进展[J]. 安徽医药,2012, 16(6):717-20. Fu M H, Li H T. The research progress of brain-derived neurotrophic factor and cerebral ischemia[J]. Anhui Med Pharm, 2012, 16(6): 717-20. |
| [26] | Plang E M,Asan E,Plesnila N,et al. Motoneuron survival after C7 nerve root avulsion and replantation in the adult rabbit: effects of local ciliary neurotrophic factor and brain-derived neurotrophic factor application[J]. Plast Reconstr Surg,2005,115(7):2042-50. |
| [27] | Kim M W,Bang M S,Han T R,et al. Exercise increased BDNF and TrkB in the contralateral hemisphere of the ischemic rat brain[J].Brain Res,2005,1052(1):16-21. |
| [28] | Singh K K,Park K J,Hong E J. Developmental axon pruning mediated by BDNF-p75NTR-dependent axon degeneration[J].Nat Neurosci, 2008, 11(6):649-58. |
| [29] | Wang Z, Liu Q, Zhang R, et al. Catalpol ameliorates beta amyloid-induced degeneration of cholinergic neurons by elevating brain-derived neurotrophic factors[J]. Neuroscience, 2009, 163(4):1363-72. |
| [30] | Liu J, He Q J, Zou W, et al. Catalpol increases hippocampal neuroplasticity and up-regulates PKC and BDNF in the aged rats[J]. Sci Direct, 2006, 9(58):68-79. |
| [31] | 杨宝峰.药理学[M]. 第7版.北京: 人民卫生出版社, 2011:64-80,109-117. Yang B F. Pharmacology[M]. Seventh Edition. Beijing: People's Health Publishing House, 2011:64-80,109-117. |
| [32] | Wan D, Xue L J, Zhu H F, Luo Y. Catalpol induces neuroprotection and prevents memory dysfunction through the cholinergic system and BDNF[J]. Evidence-Based Complement Alternat Med, 2013,2013:134852. |
| [33] | Wang Y, Zhang R, Xie J, et al. Analgesic activity of catalpol in rodent models of neuropathic pain, and Its spinal mechanism[J]. Cell Biochem Biophys, 2014, 70(3):1565-71. |
| [34] | Xiao W Q, Yin G J, Fan Y T, et al. Catalpol ameliorates sodium taurocholate-induced acute pancreatitis in rats via inhibiting activation of nuclear factor kappa B[J]. Int J Mol Sci, 2014, 15(7):11957-72. |
| [35] | Fu K,Piao T, Wang M, et al. Protective effect of Catalpol on lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol, 2014, 23(2):400-6. |
| [36] | 陈建勇,王 聪,王 娟,等. MAPK信号通路研究进展[J]. 综述,2011, 1(8):32-4. Chen J Y, Wang C, Wang J, et al. The research progress of MAPK signaling pathway[J]. Review, 2011, 1(8): 32-4. |
| [37] | Jiang G L, Wu H Y, Hu Y Q,et al. Gastrodin inhibits glutamate-induced apoptosis of PC12 cells via inhibition of CaMKII/ASK-1/p38 MAPK/p53 signaling cascade[J]. Cell Mol Neurob, 2014, 4(34):591-602. |
| [38] | Bi J,Jiang B, Hao S, et al. Catalpol attenuates nitric oxide increase via ERK signaling pathways induced by rotenone in mesencephalic neurons[J]. Neurochem Int, 2009, 54(3-4):264-70. |
| [39] | Wan M, Li C, Zhen G, et al. Injury-activated transforming growth factor beta controls mobilization of mesenchymal stem cells for tissue remodeling[J]. Stem Cells,2012,30(11):2498-511. |
| [40] | 刘煜敏,张 悦,郝艳鹏,等. 六味地黄丸含药血清及梓醇对肾小管上皮细胞HK-2转化生长因子β1/Smad通路的影响[J]. 中西医结合学报,2011, 9(7):783-8. Liu Y M,Zhang Y, Hao Y P, et al. The effect of Liu Wei Di Huang Wan containing serum and Catalpol on transforming growth factor-β1/Smad pathway of HK-2 cell[J]. Chin Integrat Med, 2011, 9(7): 783-8. |

