


糖尿病是一种以高血糖为特征的内分泌代谢性疾病。Ⅰ型糖尿病病人胰岛素分泌下降,致使体内葡萄糖大量堆积无法利用。心脏作为一个高耗能的器官,需要大量ATP维持其正常的运作,主要由线粒体提供。过氧化体增殖物激活型受体γ共激活因子1α(PGC-1α)是线粒体生成的关键调控因子[1, 2, 3],可增强核受体及相关转录蛋白的转录活性,刺激线粒体合成和呼吸的发生[4]。近年来研究显示,在多种糖尿病并发症中发现了PGC-1α表达的下调[5],同时影响下游的核呼吸因子NRF-1的表达,致使线粒体生物合成受损,线粒体功能障碍,这可能是糖尿病并发症发病的重要机制之一。黄芪甲苷(ASIV)具有广泛的药理作用,对心肌细胞具有保护作用[6]。本实验主要研究ASIV能否通过PGC-1α来提高糖尿病大鼠心肌细胞能量代谢,从而为糖尿病心肌病提供新的治疗方案
1 材料与仪器 1.1 药物与试剂黄芪甲苷(纯度0.98,南京景竹生物科技有限公司),羧甲基纤维素钠CMC、链脲佐菌素STZ(美国Sigma公司),ATP、ADP、AMP ELISA试剂盒 (R&D公司),PGC-1α、NRF-1抗体(Abcam公司),TRIzol试剂、RT-PCR试剂盒(北京鼎国),其他试剂均为国产分析纯。
1.2 动物♂ Sprague-Dawley (SD)大鼠,6周龄,体质量(200±20)g,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽) 2009-0004。实验室温度(22±2)℃,湿度45%~65%,适宜通风,每天12 h光照,正常饮水、进食。
1.3 仪器BL-420四道生理记录仪,成都泰盟科技有限公司;DNM-9602G酶标分析仪,北京普朗新技术有限公司; Onetouch II血糖仪,美国强生公司;RM2235型石蜡切片机;Leica DM 1000光学显微镜,德国Leica公司;凝胶成像仪、电泳仪、电泳槽、PCR仪,美国Bio-Rad公司;核酸蛋白分析仪,德国Eppendorf公司。
2 方法 2.1 糖尿病模型制备用0.1 mol·L-1的枸橼酸缓冲液(pH=4.2)在冰浴中配制为10 g·L-1的STZ溶液,现配现用,禁食8 h后的大鼠尾静脉注射STZ(35 mg·kg-1)。注射完7 d后空腹测血糖,若血糖大于16.7 mmol·L-1,且有多饮、多食、多尿现象者,确定为糖尿病大鼠。本实验均造模成功。
2.2 实验动物分组与处理随机选择10只健康♂ SD大鼠作为空白组,40只造模成功的糖尿病大鼠随机分为4组,分别为模型组、黄芪甲苷高、中、低剂量治疗组。黄芪甲苷用1%的羧甲基纤维素钠助溶。各治疗组分别以每日40、20、10 mg·kg-1的ASIV剂量灌胃1次。空白组和模型组,每日以等体积1%羧甲基纤维素钠灌胃1次。于给药16周末,空腹8h后麻醉,右颈动脉插管测血流动力学指标,腹主动脉取血,开胸取心脏,一部分用4%多聚甲醛固定,用于HE染色;另一部分冻存-80℃冰箱,用于RT-PCR和Western blot检测。
2.3 血流动力学测定大鼠腹腔注射水合氯醛(45 mg·kg-1)麻醉后仰位固定,分离右侧颈总动脉,由颈总动脉插管至左心室,采用BL-420四道生理记录仪对左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张期末压(left ventricular end diastolic pressure,LVEDP)、左心室最大上升/下降速率(±dp/dtmax)进行记录。
2.4 心肌组织结构观察4%多聚甲醛固定心肌组织24 h后,梯度酒精脱水,二甲苯透明,石蜡包埋,制备4 μm石蜡切片,常规HE染色,中性树脂封片,光镜显微镜(×400)下观察分析心肌组织病理变化。
2.5 ELISA试剂盒检测心肌组织ATP、AMP、ADP的含量剪取体积约2 mm3的心肌组织,加入1 mL RIPA裂解液,匀浆器匀浆后,4 ℃12 000 r·min-1离心10 min,取上清,按ELISA试剂盒说明书操作,450 nm波长下检测OD值,绘制标准曲线,计算各组心肌组织ATP、ADP、AMP含量,计算ATP/ADP、 ATP/AMP的值。
2.6 Western blot检测PGC-1α和NRF-1蛋白表达从-80 ℃冰箱取100 mg冻存的心肌组织,加入1 mL RIPA裂解液 (含1 mmol·L-1的PMSF),快速匀浆后用超声波粉碎仪粉碎30 s,冰上静置30 min后,4 ℃16 000 r·min-1离心15 min,取上清。用BCA法进行蛋白含量测定,调整蛋白浓度至1 g·L-1。根据所需样品体积,加5×SDS上样缓冲液,98 ℃加热10 min,使蛋白变性。灌胶上样进行SDS-PAGE电泳。取出凝胶转移至PVDF膜,封闭,加入一抗4 ℃孵育,过夜。加入二抗,室温孵育1 h,冲洗后,ECL显色,定影。凝胶图像处理系统分析目标条带的分子量和净光密度值。
2.7 RT-PCR检测PGC-1α和NRF-1 mRNA的表达取冻存的心肌组织约100 mg,加1 mL TRIzol,按试剂盒操作,提取总RNA。用酶标仪鉴定RNA纯度和浓度。每个样品的上样量为500 ng,按试剂盒说明书进行操作。引物序列如Tab1所示。反转录,45 ℃,30 min;预变性,95 ℃,5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行35个循环;终延伸,72 ℃,5 min。取产物9 μL,加1 μL 10×上样缓冲液,在2%的琼脂糖凝胶中电泳40 min,在凝胶成像仪上照相观察,对实验结果进行分析处理。
| Gene | Primer sequence | Product length/bp |
| PGC-1α | sense primer 5′-TCAGTCCTCACTGGTGGACA-3′ | 186 |
| antisense primer 5′-TGCTTCGTCAAAAACAG-3′ | ||
| NRF-1 | sense primer 5′-CCACATTACAGGGCGGTGAA-3′ | 120 |
| antisense primer 5′-AGTGGCTCCGTGTTGCATCT-3′ | ||
| β-actin | sense primer 5′-CCTAGCACCATGAAGATCAA-3′ | 242 |
| antisense primer 5′-AGCCATGCCAAATGTCTCAT-3′ |
采用SPSS 16.0统计软件进行分析,数据以 表示,多组间的比较采用单因素方差分析(one-way ANOVA),组内两两比较采用LSD法。
表示,多组间的比较采用单因素方差分析(one-way ANOVA),组内两两比较采用LSD法。
由Tab2可见,与空白组相比,模型组LVEDP明显升高,而LVSP、±dp/dtmax明显降低(P < 0.01),表示模型组大鼠心脏舒缩功能不全;与模型组相比,ASIV中、高剂量组对左心功能的改善效果明显,LVSP、±dp/dtmax上升,LVEDP下降 (P < 0.01),并存在剂量依赖性。而ASIV低剂量组改善心功能症状不明显。
 ,n=10)
,n=10)
| Group | LVEDP/kPa | LVSP/kPa | +dp/dtmax/kPa·s-1 | -dp/dtmax/kPa·s-1 |
| Control | 0.78±0.10 | 15.43±1.21 | 353.61±21.65 | 292.08±15.89 |
| Model | 2.17±0.37** | 8.86±1.13** | 202.61±18.40** | 158.32±14.71** |
| ASIV 10 mg·kg-1 | 2.12±0.29 | 10.28±1.80# | 231.25±14.50# | 201.68±14.70## |
| ASIV 20 mg·kg-1 | 1.68±0.29## | 12.92±1.29## | 276.28±16.84## | 223.70±10.05## |
| ASIV 40 mg·kg-1 | 1.25±0.22## | 13.84±1.42## | 280.39±26.12## | 262.15±16.78## |
| **P < 0.01 vs control group;#P < 0.05,##P < 0.01 vs model group | ||||
在显微镜下观察心肌组织HE染色切片,空白组心肌细胞排列整齐,形态清晰;模型组心肌细胞形态紊乱,结构模糊,有大量炎细胞浸润;与模型组相比,治疗组随药物剂量增大,细胞间隙逐渐减小,间质依次减少,排列较整齐,形态逐渐均匀(Fig1)。

|
| Fig 1 Groups of rats myocardial morphology observation(HE×400) A: Control group;B: Model group;C: ASIV 10 mg·kg-1 group; D: ASIV 20 mg·kg-1 group; E: ASIV 40 mg·kg-1 group |
用ELISA法检测心肌组织中ATP、 ADP和AMP的含量,并求ATP/ADP、ATP/AMP比值。由Tab3可见,与空白组相比,模型组ATP/ADP、ATP/AMP比值明显下降(P < 0.01);与模型组相比,治疗组的ATP/ADP、ATP/AMP比值均上升,其中中、高剂量组的比值上升明显(P < 0.01),且呈剂量依赖。说明黄芪甲苷能够改善心肌能量代谢。
 ,n=10)
,n=10)
| Group | ATP/ADP | ATP/AMP |
| Control | 2.30±0.40 | 8.88±2.00 |
| Model | 0.43±0.25** | 2.65±0.78** |
| ASIV 10 mg·kg-1 | 0.76±0.24# | 3.95±1.42# |
| ASIV 20 mg·kg-1 | 1.03±0.25## | 4.22±0.99## |
| ASIV 40 mg·kg-1 | 1.55±0.23## | 5.54±1.36## |
| **P < 0.01 vs control group;#P < 0.05,##P < 0.01 vs model group | ||
与空白组相比,模型组PGC-1α和NRF-1蛋白的表达明显降低;与模型组相比,ASIV低、中、高剂量组干预后,PGC-1α和NRF-1蛋白表达明显升高,且呈剂量依赖性。说明黄芪甲苷可能通过PGC-1α这一路径干预糖尿病心肌病的能量代谢,保护受损的心肌细胞(Fig2)。
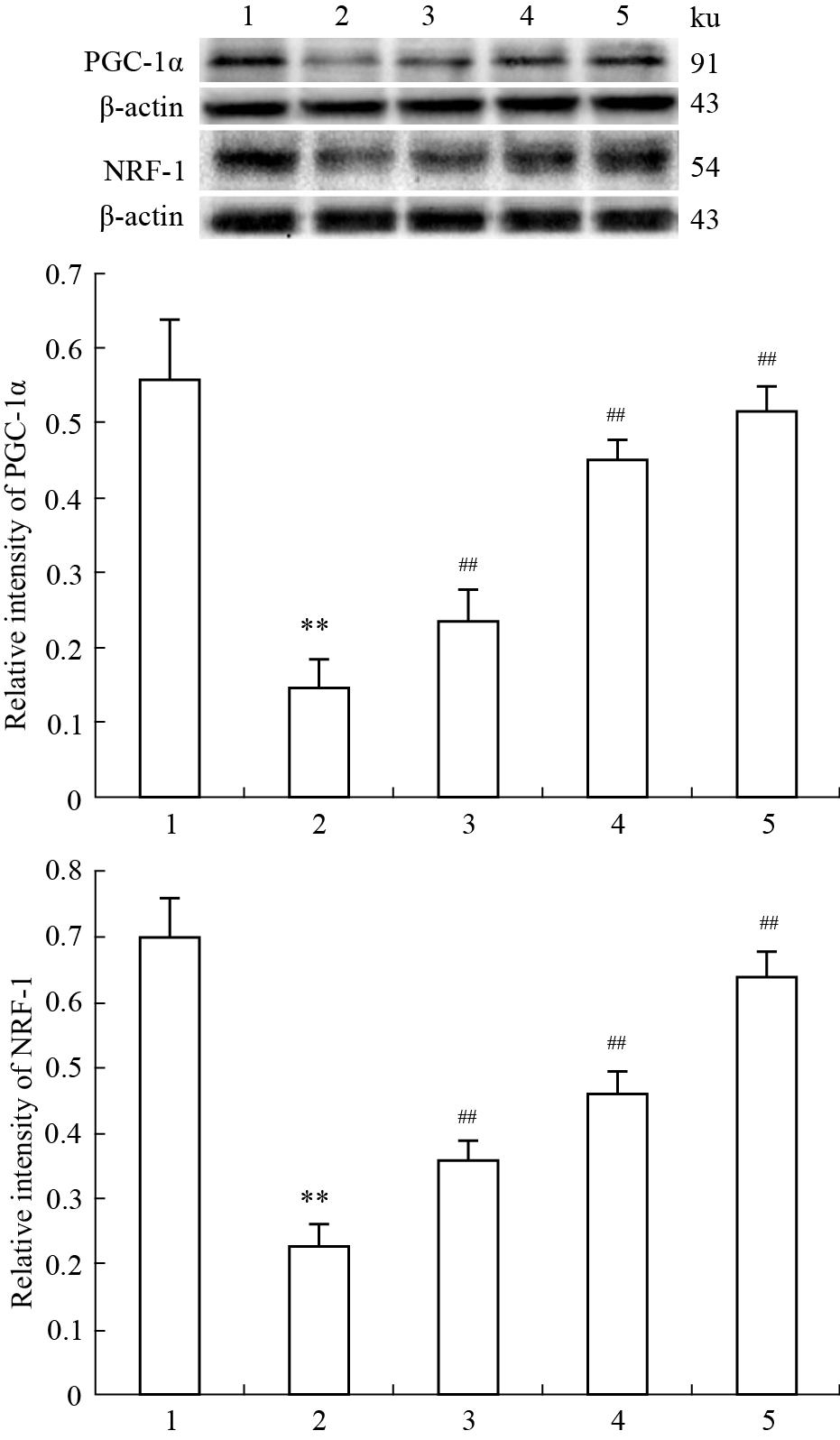
|
Fig 2
Effects of ASIV on PGC-1α and NRF-1 protein expressions in myocardial tissue of rats( ,n=10)
1: Control group;2: Model group;3: ASIV 10 mg·kg-1 group;4: ASIV 20 mg·kg-1 group;5: ASIV 40 mg·kg-1 group. **P < 0.01 vs control group;##P < 0.01 vs model group. ,n=10)
1: Control group;2: Model group;3: ASIV 10 mg·kg-1 group;4: ASIV 20 mg·kg-1 group;5: ASIV 40 mg·kg-1 group. **P < 0.01 vs control group;##P < 0.01 vs model group.
|
如Fig3 所示,与空白组相比,模型组的PGC-1α和NRF-1 mRNA表达下降;与模型组比较,低、中、高治疗组随药物剂量的提高,PGC-1α和NRF-1 mRNA表达逐渐增多,进一步说明黄芪甲苷可能通过PGC-1α途径改善糖尿病大鼠的心肌组织,提高能量代谢,促进心肌细胞线粒体的生物合成。
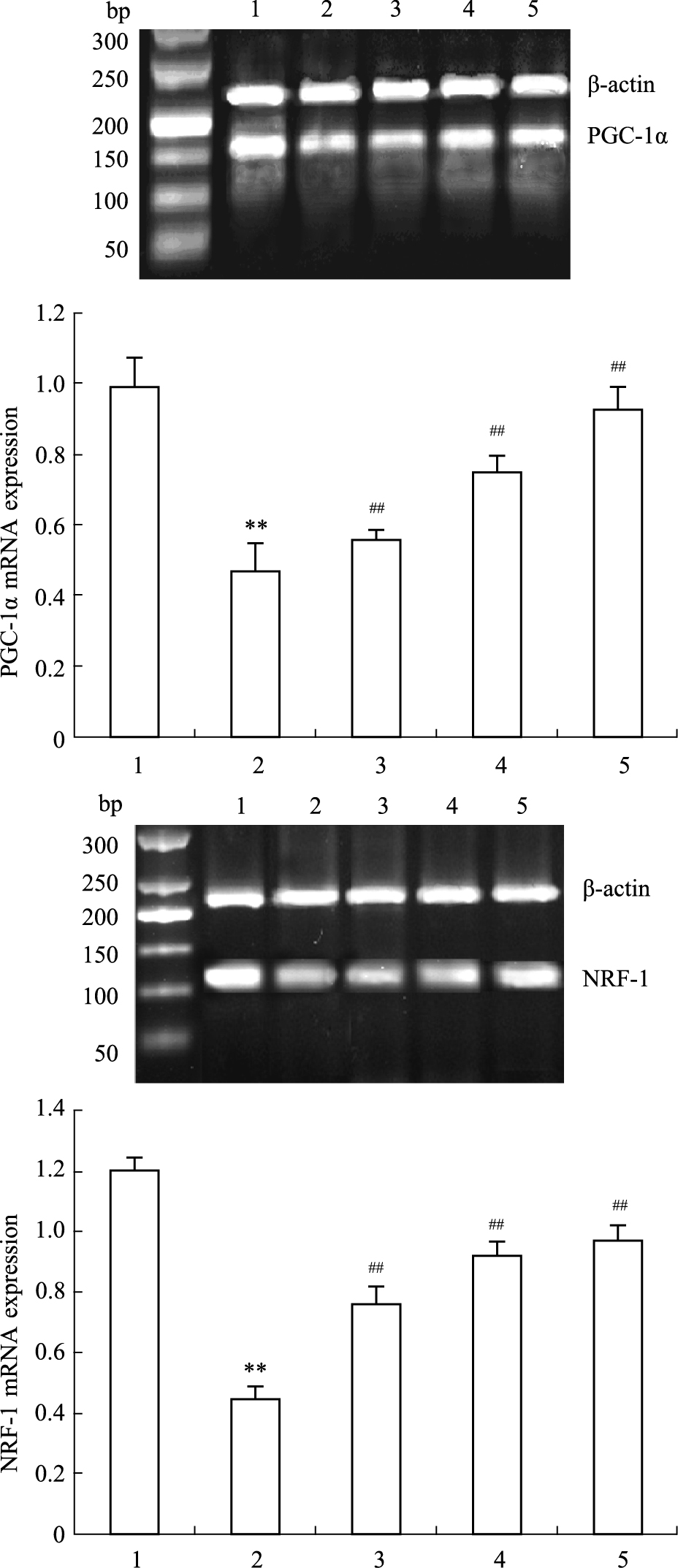
|
Fig 3
Effects of ASIV on PGC-1α and NRF-1 mRNA expressions
in myocardial tissue of rats( ,n=10)
1: Control group; 2: Model group;3: ASIV 10 mg·kg-1 group; 4: ASIV 20 mg·kg-1 group; 5: ASIV 40 mg·kg-1 group.**P < 0.01 vs control group;##P < 0.01 vs model group. ,n=10)
1: Control group; 2: Model group;3: ASIV 10 mg·kg-1 group; 4: ASIV 20 mg·kg-1 group; 5: ASIV 40 mg·kg-1 group.**P < 0.01 vs control group;##P < 0.01 vs model group.
|
线粒体在细胞中至关重要,它是为细胞供能的主要场所,它参与细胞从生长到凋亡的整个能量代谢过程。当线粒体生成障碍时,会直接影响线粒体的功能状态,而线粒体功能状态又与心血管疾病的发生发展关系密切。线粒体的生物合成是由线粒体基因和细胞核基因共同作用的,由于线粒体自身合成相关蛋白的能力有限,故线粒体的生物合成主要依赖于核基因[7]。PGC-1α作为主要的辅激活因子,在线粒体生物合成的调控中起到中心作用[8]。在心肌组织中,含量丰富的PGC-1α 能够强烈刺激下游核转录因子如线粒体转录因子A(TFAM)、过氧化物酶体增殖物激活受体(PPAR)和核呼吸因子(NRFs)等[9],影响线粒体的生成,参与能量代谢的调控[10]。其中NRFs是调控线粒体生物合成最主要的转录因子。NRFs家族包括NRF-1和NRF-2,其中NRF-1的作用更为重要[11]。PGC-1α可强烈诱导下游NRF-1的表达,促进NRF-1的基因转录[12]。核转录因子NRF-1可促进线粒体氧化磷酸化,转录调控呼吸酶相关的细胞核基因,影响线粒体基因组的复制、转录、相关蛋白的表达等[13]。
本实验结果显示,连续喂养16周的糖尿病大鼠,与空白组相比,LVEDP上升,LVSP下降,±dp/dtmax也下降,HE心肌病理切片显示炎症细胞浸润聚集,心肌细胞结构紊乱,说明糖尿病大鼠存在明显的心肌病变,糖尿病心肌病大鼠造模成功。ELISA法检测ATP、AMP、ADP的含量,模型组大鼠ATP/AMP、ATP/ADP比值明显下降,证明心肌细胞供能减少,推测糖尿病心肌病可能与线粒体合成受损有关。Western blot和RT-PCR结果显示,与空白组相比,模型组大鼠心肌细胞PGC-1α和NRF-1的蛋白表达和mRNA表达均减少。进一步验证,在I型糖尿病中,PGC-1α、NRF-1与糖尿病大鼠心肌细胞中线粒体合成的内在联系。在大鼠心肌组织中,PGC-1α、NRF-1的表达减弱,线粒体生物合成受阻,功能受损,ATP合成减少,能量供应不足,出现代谢障碍。
黄芪甲苷是黄芪的主要活性成分之一,可增强心肌收缩力,改善心肌能量代谢,抑制心室肥厚、心肌纤维化及心肌凋亡,保护血管内皮细胞,减轻血管张力,降血压,对心血管的保护作用十分明显[6]。本实验室先前研究表明,黄芪甲苷可通过PGC-1α途径提高能量代谢来改善异丙肾上腺素诱导的大鼠的心肌肥厚症状[14]。糖尿病心肌病作为糖尿病的主要致死原因之一,其治疗药物一直是人们的研究热点。近年来,大量实验证明黄芪甲苷可降低血糖、血脂,抗炎症,抗氧化[15],刺激胰岛素的产生[16],对糖尿病及其并发症具有保护作用。而黄芪甲苷究竟是通过何种机制作用于糖尿病,目前尚不明确。本实验结果显示,与模型组相比,黄芪甲苷干预治疗后,LVEDP、LVSP、±dp/dtmax等血流动力学指标,HE病理染色均有所改善,大鼠ATP/AMP、ATP/ADP比值上升,PGC-1α和NRF-1的蛋白表达和mRNA表达均增加。由实验结果推测,黄芪甲苷可能通过PGC-1α路径激活下游的重要作用靶点核呼吸因子NFR-1,而NRF-1又进一步活化TFAM等线粒体相关因子,从而促进线粒体的生物合成和能量代谢,保护心肌,改善心脏功能障碍。
本实验表明,黄芪甲苷可通过PGC-1α路径来调控线粒体的代谢与合成,改善糖尿病心肌病的症状,但黄芪甲苷对NRF-1下游的具体作用机制还需进一步探索。综上所述,Ⅰ型糖尿病心肌病大鼠心脏功能障碍,能量代谢调节能力下降,线粒体合成受阻,黄芪甲苷作为一种改善心肌症状的有效药物,为临床上治疗糖尿病心肌病提供了新的思路。
(致谢:本实验于辽宁医学院心脑血管药物研究重点实验室完成,感谢该实验室诸位老师的悉心指导和同学们的大力帮助。)
| [1] | Rowe G C,Jiang A,Arany Z. PGC-1 coactivators in cardiac development and disease [J]. Circ Res,2010,107(7):825-38. |
| [2] | Aranv Z,He H,Lin J,et al. Transcriptional coactivator PGC-1 alpha controls the energy state and contracrile function of cardiac muscle [J]. Cell Metab,2005,1(4):259-71. |
| [3] | Sebastiani M,Giordano C,Nediani C,et al. Induction of mitochondrial biogenesis is a maladaptive mechanism in mitochondrial cardiomyopathies [J]. J Am Coll Cardiol,2007,50(14):1362-9. |
| [4] | Scarpulla R C. Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network [J].Biochim Biophys Acta,2011,1813(7):1269-78. |
| [5] | 郭 茜,郭家彬,李 梨,彭双清. PGC-1α与线粒体O生成调控在心血管疾病中的作用[J].中国药理学通报,2013,29 (1):1-5. Guo Q,Guo J B,Li L,Peng S Q. Role of PGC-1α and mitochondrial biogenesis in cardiovascular diseases [J]. Chin Pharmacol Bull,2013,29 (1):1-5. |
| [6] | 李香华,王洪新.黄芪甲苷在心血管疾病中的作用[J]. 心血管病学进展,2011,32(1):132-6.Li X H,Wang H X. Effect of astragaloside IV in cardiovascular disease [J]. Adv Cardiovasc Dis,2011,32(1):132-6. |
| [7] | Diaz F,Moraes C T. Mitochondrial biogenesis and turnover[J],Cell Calcium,2008, 44(1):24-35. |
| [8] | Pagel-Langenickel I,Bao J,Joseph J J,et al. PGC-lalpha integrates insulin signaling, mitochondrial regulation and bioenergetic function in skeletal muscle[J]. J Biol Chem,2008,283(33):22464-72. |
| [9] | Wu Z,Puigserver P,Andersson U,et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J]. Cell,1999,98(1):115-24. |
| [10] | Lin J,Handschin C,Spiegelman B M. Metabolic control through the PGC-1 family of transcription coactivators [J]. Cell Met,2005,1(6):361-70. |
| [11] | Virbasius J V,Scarpulla R C. Activation of the human mitochondrial transcription factor A gene by nuclear respiratory factors: a potential regulatory link between nuclear and mitochondrial gene expression in organelle biogenesis [J]. Proc Natl Acad Sci USA,1994,91(4): 1309-13. |
| [12] | Garnier A,Fortin D,Delomenie C,et al. Depressed mitochondrial transcription factors and oxidative capacity in rat failing cardiac and skeletal muscles [J]. J Physiol,2003,551(Pt 2):491-501. |
| [13] | Scarpulla R C. Transcriptional paradigms in mammalian mitochondrial biogenesis and function[J]. Physiol Rev,2008,88(2):611-38. |
| [14] | 张素萍,王洪新,栾爱娜,等.黄芪甲苷对异丙肾上腺素诱导大鼠心肌肥厚及过氧化物酶体增殖活化受体γ 辅助活化因子1α的影响[J].中药药理与临床,2014,30(3):65-8. Zhang S P,Wang H X,Luan A N,et al. Effect of astragaloside IV on myocardial hypertrophy and PGC-1α induced by isoproterenol in rats[J]. Pharmacol Clin Chin Mat Med,2014,30(3):65-8. |
| [15] | Jiang B,Yang Y,Jin H,et al. Astragaloside IV attenuates lipolysis and improves insulin resistance induced by TNF-α in 3T3-L1 adipocytes[J]. Phytother Res,2008,22(11): 1434-9. |
| [16] | 吕 琳. 黄芪甲苷对高脂加链脉佐菌素诱导的糖尿病小鼠的降血糖作用及其作用机制[D]. 广州:南方医科大学,2010. Lü L. Hypoglycemic effect and mechanisms of astragaloside IV in diabetic mice induced by high fat diet and streptozotocin[D]. Guangzhou:Southern Medical University,2010. |

