


痛风(gout)是由于体内尿酸结晶沉积到软组织,引发急、慢性炎症和组织损伤,出现临床症状和体征的一组临床综合征。通常认为高尿酸血症是痛风最重要的生化基础,据统计有5%~12%的高尿酸血症最终可发展为痛风[1]。任何原因引起尿酸生成增多和(或)排泄减少均可导致高尿酸血症,其中尿酸排泄减少约占原发性高尿酸血症患者的90%[2]。肾脏在尿酸的排泄中占有重要地位,体内2/3的尿酸由肾脏排泄,经过肾小球滤过、肾小管重吸收、再分泌和再吸收而排出体外,其中肾小管对尿酸的重吸收是影响血尿酸水平的主要环节。近年的研究认为肾脏的尿酸转运体URAT1/SLC22A12、GLUT9/SLC2A9参与了尿酸的重吸收。
3,5,2′,4′-四羟基查尔酮(C15H12O5,P40)(Fig1)是中国科学院昆明植物所朱华结研究员课题组以3,5-二羟基苯甲酸为原料合成的查尔酮类化合物[3]。该类化合物存在于甘草、啤酒花、镰形棘豆等药用植物中,由于其分子结构有较大柔性,能与不同的受体结合,具有广泛的生物活性[4]。本课题组前期研究发现P40具有较强的降尿酸作用,其机制与抑制黄嘌呤氧化酶/黄嘌呤脱氢酶(XOD/XDH)的活性有关[5, 6]。然而,P40的化学结构不同于上市的黄嘌呤氧化酶抑制剂别嘌醇和非布索坦,很可能存在新的作用机制和靶点。鉴于肾脏在尿酸排泄中的重要作用,本研究拟从肾脏尿酸排泄角度探讨P40的降尿酸作用及其分子机制,为阐明P40的作用机制提供科学依据。
|
| Fig 1 Structure of 3,5,2’,4’-tetrahydroxychalcone |
昆明种小鼠,♂,体质量18~22 g,由四川成都达硕生物科技有限公司提供,实验动物生产许可证号:[SCXK (川)2011-24],自由饮食。
1.2 主要材料与试剂3,5,2’,4’-四羟基查尔酮:由中国科学院昆明植物所朱华结研究员课题组合成并提供,分子质量为272.25;苯溴马隆:德国赫曼大药厂生产,由昆山龙灯瑞迪制药有限公司分装;尿酸:购于Sigma公司;尿酸测定试剂盒:南京建成生物技术有限公司生产; URAT1抗体:购于Protein公司;GLUT9抗体:购于Sigma公司;β-actin、山羊抗兔IgG/辣根酶标记:Abmart公司。
1.3 仪器全波长酶标仪:Molecular Devices公司,型号:SPECTRA MAX190;电热恒温水浴箱:北京长风公司,型号:HH·W21;高速冷冻离心机:HERMLE公司,型号:Z300K;酶标板:美国Costar公司。
2 方法 2.1 动物分组及给药选取标准体质量(18~22 g)♂昆明小鼠60只,随机分为正常组、高尿酸血症模型组、P40 (2.0、4.0、8.0 mg·kg-1)剂量组、苯溴马隆12.5 mg·kg-1组,各给药组共灌胃给药5次,每天两次;腹腔注射尿酸150 mg·kg-1 3次诱导形成高尿酸血症小鼠[7],正常对照组则注射等体积溶媒。末次腹腔注射尿酸前40 min灌胃给予各受试药物,给药后1 h眶静脉取血,3 000 r·min-1离心10 min,取血清;断颈处死小鼠,迅速分离肝脏和肾脏,液氮冻存后于-80 ℃保存备测。磷钨酸法测定小鼠血尿酸水平和肝尿酸含量[8]。
2.2 RT-PCR检测肾脏URAT1、GLUT9基因表达水平小鼠URAT1、GLUT9引物采用DNAMAN 6.0设计(Tab1),经PubMed BLAST验证后,由上海生工生物工程有限公司合成。每组随机选取4例冻存的小鼠肾脏,提取总RNA后,ND-1000定量,并进行逆转录,随后进行扩增。URAT1的扩增条件为:94℃ 2 min、94℃ 30 s、58℃ 35 s、72℃ 45 s、72℃ 10 min、4℃ 30 cycles,GLUT9的扩增条件为:94℃ 2 min、94℃ 30 s、57.7℃35 s、72℃ 45 s、72℃ 10 min、4℃ 30 cycles。电泳后的琼脂糖凝胶用BIO-RAD凝胶成像系统进行凝胶成像,并对条带进行灰度比值分析
。| Target gene | Primer sequence | Product length |
| mURAT1 | For5′-GCTACCAGAATCGGCACGCT-3′ | 342bp |
| Rev5′-CACCGGGAAGTCCACAATCC-3′ | ||
| mGLUT9 | For5′-GAGATGCTCATTGTGGGACG-3′ | 316 bp |
| Rev5′-GTGCTACTTCGTCCTCGG-3′ | ||
| GAPDH | For5′-CAAGGTCATCCATGACAACTTTG-3′ | 496 bp |
| For5′-GTCCACCACCCTGTTGCTGTAG-3′ |
取冻存的小鼠肾脏,每组4例,组织裂解液提取小鼠肾脏组织总蛋白,BCA法进行蛋白定量。蛋白与上样缓冲液的比例为1 ∶4,混匀后95℃ 10 min煮沸变性,进行SDS-PAGE电泳;湿法转至PVDF膜;脱脂奶粉37℃摇床封闭膜2 h;4℃过夜孵育URAT1、GLUT9一抗(1 ∶1 000)、β-actin(1 ∶1 000);TBST洗膜,室温摇床孵育辣根过氧化物酶标记的二抗(1 ∶2 000)1 h;TBST洗膜,ECL化学发光。BIO-RAD系统成像,URAT1、GLUT9蛋白的相对表达量用URAT1、GLUT9与β-actin的光密度比值进行计算。
2.4 统计学分析数据用 表示,采用单因素方差分析,用SPSS 17.0软件进行统计学处理。
表示,采用单因素方差分析,用SPSS 17.0软件进行统计学处理。
与正常组比较,模型组小鼠血尿酸水平明显增加,差异有统计学意义(P < 0.01),提示模型复制成功;灌胃给予P40后,P40(4.0、8.0 mg·kg-1)组及苯溴马隆组血尿酸水平明显下降,与模型组比较,差异有统计学意义(P < 0.05),并呈现剂量-效应关系;与正常组比较,模型组及各给药组肝尿酸水平降低,差异有统计学意义(P < 0.01);各给药组的肝尿酸水平与模型组比较,差异无统计学意义(P>0.05)(Tab2)。
 ,n=10)
,n=10)
| Group | Dose/mg·kg-1 | Uric acid | |
| Serum/μmol·L-1 | Liver/μmol·g-1 tissue | ||
| Normal(CMC-Na) | - | 186.77±20.52 | 4.97±0.37 |
| Model(CMC-Na) | - | 382.66±68.85## | 3.85±0.59## |
| P40 | 2.0 | 346.31±46.88 | 4.10±0.46## |
| 4.0 | 319.49±40.04* | 4.09±0.82## | |
| 8.0 | 261.05±41.92** | 3.76±0.26## | |
| Benzbromarone | 12.5 | 222.61±16.45** | 4.03±0.34## |
| ##P<0.01 vs normal; *P<0.05, **P<0.01 vs model. | |||
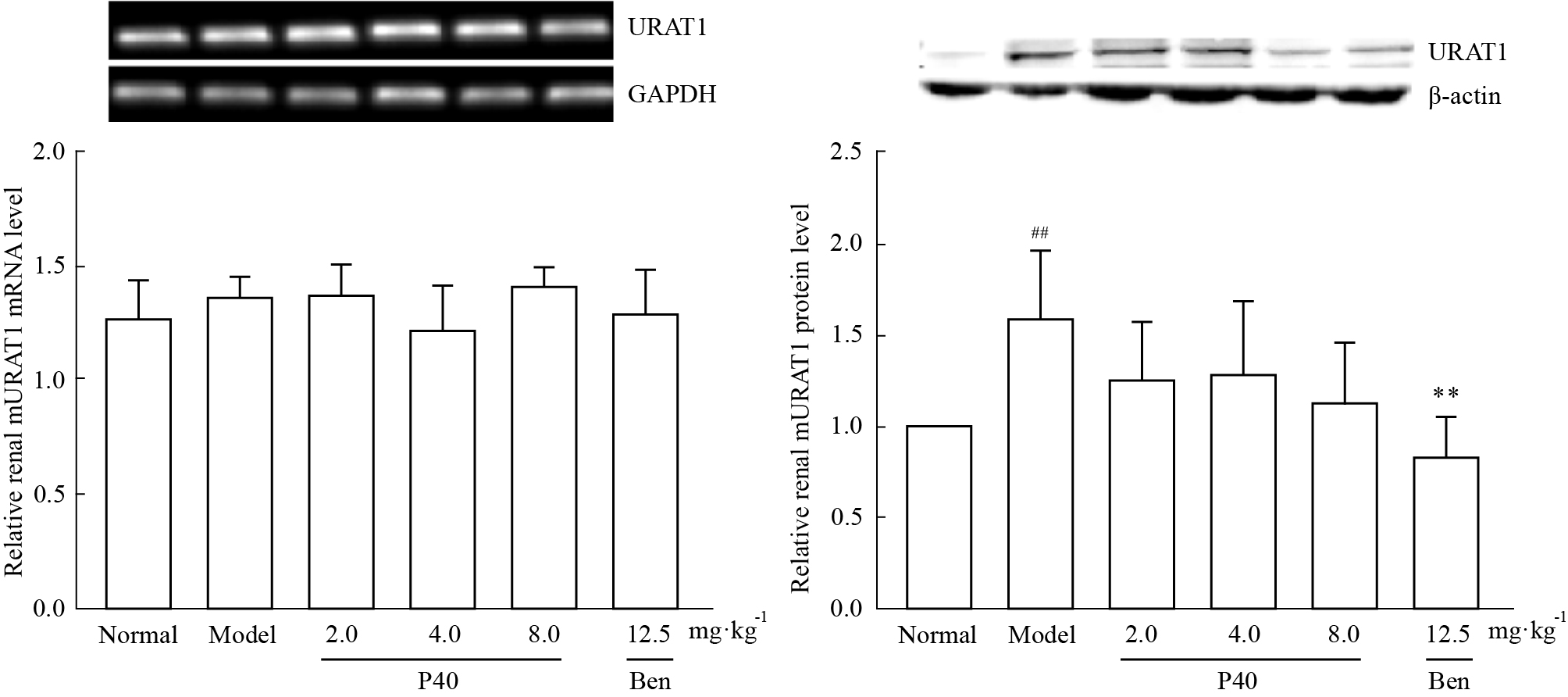
由Fig2可看出小鼠肾脏URAT1基因表达水平无变化。模型组URAT1蛋白表达上调,与正常组相比,差异具有统计学意义;P40各系列给药组UART1蛋白表达均有下调趋势,但与模型组相比,差异无统计学意义;苯溴马隆组下调URAT1蛋白表达,与模型组相比,差异具有统计学意义。
|
Fig 2
Effects of P40 on renal mURAT1 mRNA and protein levels
in hyperuricemic mice( , n=4)
Ben: Benzbromarone. ##P<0.01 vs normal group; **P < 0.01 vs model group. , n=4)
Ben: Benzbromarone. ##P<0.01 vs normal group; **P < 0.01 vs model group.
|
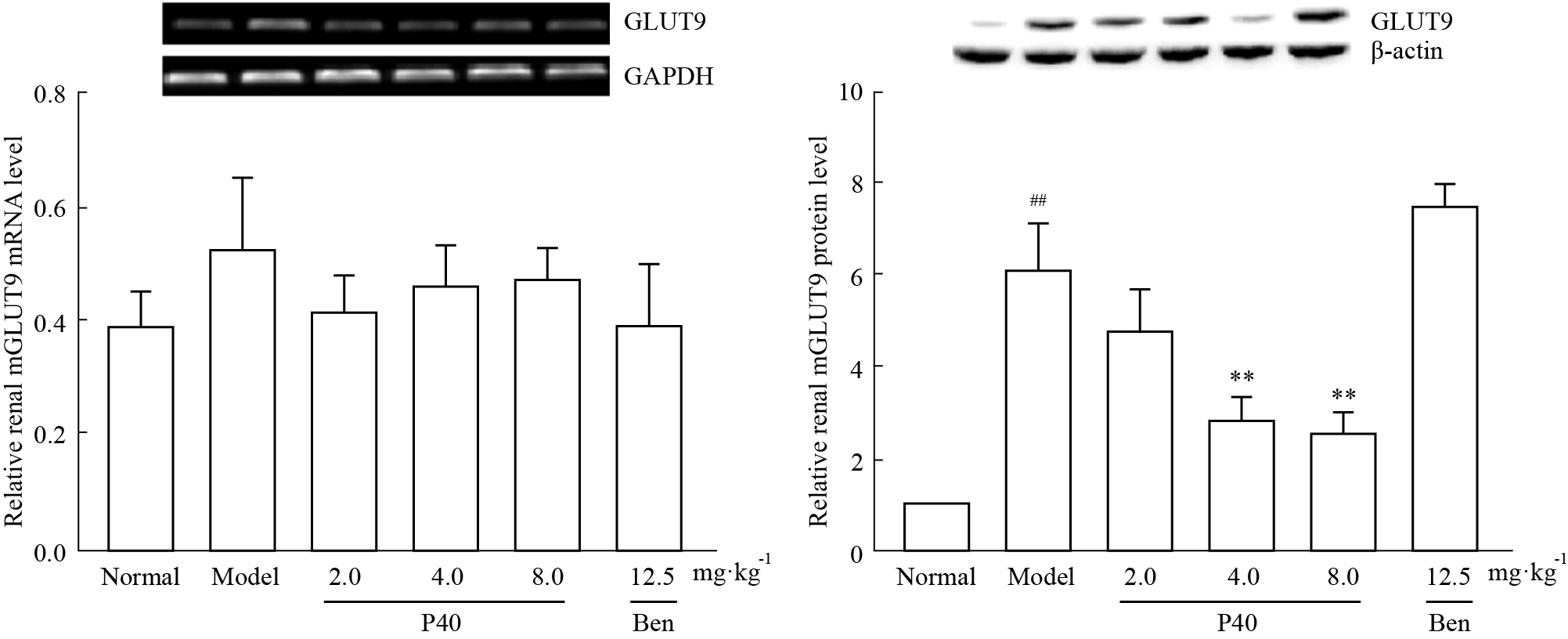
由Fig3可见,模型组GLUT9基因表达有上调趋势,但与正常组相比,无统计学意义;P40各给药组以及苯溴马隆组其基因表达有下调趋势,但与模型组相比,差异无统计学意义。模型组GLUT9的蛋白表达上调,与正常组相比,差异具有统计学意义;P40 4.0、8.0 mg·kg-1给药组GLUT9蛋白表达下调,并呈现一定的剂量-效应关系,与模型组相比,差异具有统计学意义;而P40 2.0 mg·kg-1给药组有下调GLUT9蛋白表达的趋势,但与模型组相比,差异无统计学意义;苯溴马隆组对其蛋白表达没有影响。
|
Fig 3
Effects of P40 on renal mGLUT9 mRNA and protein levels in hyperuricemic mice( ,n=4)
Ben: Benzbromarone. ##P<0.01 vs normal group; **P<0.01 vs model group. ,n=4)
Ben: Benzbromarone. ##P<0.01 vs normal group; **P<0.01 vs model group.
|
尿酸是人类嘌呤代谢的终末产物,由次黄嘌呤在黄嘌呤氧化酶的作用下生成黄嘌呤,再在该酶的作用下进一步生成尿酸,而肝脏作为黄嘌呤氧化酶的高表达器官,是尿酸生成的主要场所,对机体尿酸的稳态起着重要的调节作用。体内生成70%的尿酸经由肾脏排泄。因此,增加体内尿酸、尿酸前体(次黄嘌呤、黄嘌呤) 的量或抑制肾脏尿酸的排泄均可引起血尿酸水平的增高导致高尿酸血症。本研究采用直接补充大剂量的外源性尿酸诱导形成高尿酸血症小鼠[7, 9],在不影响小鼠自身尿酸生成的前提下,观察P40对尿酸排泄的影响。结果表明P40剂量依赖性地降低了高尿酸血症小鼠的血尿酸水平,与促尿酸排泄药苯溴马隆相似,提示P40具有促进尿酸排泄的作用。此外,在本实验条件下,模型组及各用药组的肝脏尿酸含量均低于正常组,提示大剂量的外源性尿酸进入机体后,有可能抑制了肝尿酸的生成。
研究发现,肾小管上皮细胞顶端膜和基底膜上的多个转运蛋白与尿酸的重吸收和分泌有关[10],其中尿酸转运体URAT1/SLC22A12[11]和GLUT9/SLC2A9[12]参与了尿酸的重吸收。URAT1和GLUT9分别表达于肾近端小管上皮细胞的顶端膜与基底膜,URAT1将尿酸从小管液中摄入小管细胞内,再经GLUT9泵出小管细胞基底膜,进入细胞间质和外周血管。URAT1 基因突变将导致转运体功能减退或丧失而表现出肾性低尿酸血症,提示URAT1是影响血尿酸水平的一个重要的转运蛋白[11]。苯溴马隆即是以URAT1为靶点的促尿酸排泄药,本实验条件下也观察到苯溴马隆干预了该转运体的蛋白表达,然而,P40则对高尿酸血症小鼠肾脏URAT1的基因、蛋白表达均无太大影响,初步提示P40促尿酸排泄作用的靶点并非URAT1。
GLUT9主要表达于肾脏和肝脏,虽然是葡萄糖转运体家族成员之一,与GLUTs有相似的氨基酸序列,然而,其转运葡萄糖和果糖的能力较低[13]。新近研究显示GLUT9与尿酸的转运密切相关,是一种高能尿酸转运体。该转运体以电压依赖的方式将尿酸从小管细胞内转运至细胞间质和外周血管中,它的转运功能并不依赖于Na+,而当细胞外K+浓度升高时,其转运功能增强,故又称为电势驱动尿酸转运蛋白1(voltage driven urate transporter 1,URATv1) [14, 15]。本实验结果显示P40明显降低高尿酸血症小鼠肾脏GLUT9蛋白的表达,而对GLUT9 的mRNA水平仅有下调趋势,并未达到显著统计学意义,说明P40主要干预了GLUT9蛋白的合成,而对基因的转录过程影响不明显。此外,本研究显示苯溴马隆对GLUT9的mRNA和蛋白表达均无明显影响,提示P40促进尿酸排泄的机制与苯溴马隆不同,可能是通过下调GLUT9蛋白的表达,减少尿酸的重吸收而起到降尿酸的作用。
综上所述,P40具有促进高尿酸血症小鼠尿酸排泄的作用,其机制与下调GLUT9蛋白的表达有关。 (致谢:本实验均在昆明医科大学生物医学工程研究中心完成。感谢该实验室提供优良的实验室环境以及先进的实验设备,感谢云南省“孔祥复院士工作站”团队给予的指导和帮助,让该实验得以顺利完成。谢谢!)
| [1] | Rott K T, Agudelo C A. Gout[J]. J Am Med Assoc, 2003, 289(21): 2857-60. |
| [2] | Pande I. An update on gout[J]. J Rheumatol, 2006, 1(2): 60-5. |
| [3] | 廖头根,汪秋安,安伟琴,等. 新型查尔酮类化合物的合成及其生物活性研究[J]. 有机化学,2006, 26(5): 685-9.Liao T G, Wang Q A, An W Q, et al. Studies on the synthesis of novel chalcone and biological activity[J]. J Org Chem, 2006, 26(5): 685-9. |
| [4] | Issaenko O A, Amerrik A Y. Chalcone-based small-molecule inhibitors attenuate malignant phenotype via targeting deubiquitinating enzymes[J]. Cell Cycle, 2012, 11(9): 1804-17. |
| [5] | Niu Y F, Zhu H J, Liu J, et al. 3,5,2’,4’-tetrahydroxychalcone, a new non-purine xanthine oxidase inhibitor[J]. Chem Biol Interact, 2011, 189(3): 161-6. |
| [6] | 牛艳芬,刘 恺,高丽辉,等. P40对氧嗪酸钾诱导的高尿酸血症小鼠尿酸水平及肝脏黄嘌呤氧化还原酶的影响[J]. 中国药学杂志, 2015, 50(1): 34-8.Niu Y F, Liu K, Gao L H, et al. Effects of 3,5,2′,4′-tetrahydroxychalcone on serum uric acid levels and the content of hepatic XOD/XDH in mice[J]. Chin Pharm J, 2015, 50(1): 34-8. |
| [7] | 陈光亮,孙秀霞,王钦茂,等. 小鼠高尿酸血症模型的研究[J]. 中国药理学通报,2001, 17(3): 350-2. Chen G L, Sun X X, Wang Q M, et al. Studies on mouse hyperuricemia model[J]. Chin Pharmacol Bull, 2001, 17(3): 350-2. |
| [8] | 牛艳芬,高丽辉,李 玲,等. 芒果苷对氧嗪酸钾所致慢性高尿酸血症大鼠尿酸及肝肾功能的影响[J]. 中国药理学通报,2012, 28(11): 1578-81. Niu Y F, Gao L H, Li L, et al. Effects of mangiferin on uric acid levels and the function of the liver/renal in oxonate-induced hyperuricemic rats[J]. Chin Pharmacol Bull, 2012, 28(11): 1578-81. |
| [9] | 刘淑芬,曾学军. 高尿酸血症动物模型研究进展[J]. 基础医学与临床,2011, 31(3): 344-7. Liu S F, Zeng X J. Advance in the research of animal models of hyperuricemia[J]. B&C Med, 2011,31(3): 344-7. |
| [10] | Bobulescu I A, Moe O W. Renal transport of uric acid: evolving concepts and uncertainties[J]. Adv Chronic Kidney Dis, 2012, 19(6): 358-71. |
| [11] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels[J]. Nature, 2002, 417(6887): 447-52. |
| [12] | Matsuo H, Chiba T, Nagamori S, et al. Mutations in glucose transporter 9 gene SLC2A9 cause renal hypouricemia[J]. Am J Hum Genet, 2008, 83(6): 744-51. |
| [13] | Bibert S, Hess S K, Firsov D, et al. Mouse GLUT9: evidences for a urate uniporter[J]. Am J Physiol-Renal, 2009, 297(3): F612-9. |
| [14] | Caulfield M J, Munroe P B, O’Neill D, et al. SLC2A9 is a high-capacity urate transporter in humans[J]. PLoS Med, 2008, 5(10):e197. |
| [15] | Anzain N, Ichida K, Jutabha P, et al. Plasma urate level is directly regulated by a voltage-driven urate efflux transporter URATv1 (SLC2A9) in humans[J]. J Biol Chem, 2008, 283(40): 26834-8. |

