


2. 南通大学药学院, 江苏 南通 226001
2. Dept of Pharmacology, School of Pharmacy, Nantong University, Nantong Jiangsu 226001, China
心室重构引起的心肌结构和功能改变是慢性心力衰竭(chronic heart failure,CHF)发生发展的重要机制之一[1]。心肌纤维化是指心肌正常组织中胶原纤维过量聚积或胶原成分发生改变,最终导致心肌僵硬及心功能紊乱,是心肌重塑过程中心功能由代偿变为失代偿的重要环节[2]。p-38信号通路作为促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的一个重要分支,可以激活心肌纤维化相关转录因子和基因的表达,参与细胞的增殖、分化、生长和凋亡等生理或病理过程[3]。本研究旨在探讨苯那普利与厄贝沙坦联合用药对压力负荷性心力衰竭大鼠心肌胶原的影响,并探讨可能作用机制。
1 材料与方法 1.1 材料 1.1.1 动物SD大鼠80只,♀♂各半,220~240 g,购自南通大学实验动物中心。
1.1.2 药品与试剂盐酸苯那普利片(北京诺华制药有限公司),厄贝沙坦(修正药业集团柳河制药有限公司),羟脯氨酸测试盒(南京建成生物工程研究所),胃蛋白酶(加拿大Bio Basic Inc公司),兔抗大鼠Ⅰ型胶原、Ⅲ型胶原、p-38MAPK多克隆抗体(武汉博士德生物工程有限公司),抗GAPDH(上海康成生物工程有限公司),抗p-p38MAPK(Cell Signaling Technology),辣根过氧化物酶标记的羊抗兔IgG(1 ∶ 7 000,上海康成生物工程有限公司),预染蛋白Marker(6.5~175 ku,New England Biolabs)。
1.1.3 仪器RBP-1B型大鼠尾动脉血压心率测定仪(中日友好临床医学研究所),JEM-1230型透射电镜(日本JEOL电子公司),蛋白电泳仪(美国Bio-Rad公司),SONOS 5500型超声诊断仪(美国Agilent公司)。
1.2 方法 1.2.1 模型制作采用腹主动脉缩窄法[4]造成压力负荷性心肌肥厚致心力衰竭大鼠模型。正常喂养8周后通过超声心动图检测心功能,以心脏射血分数(ejection fraction,EF)≤45%作为心衰模型成功标准[5],假手术组除不缩窄腹主动脉以外,其他操作与手术组完全相同。
1.2.2 分组与给药将成模大鼠分为心衰模型组(Mod)、苯那普利组(Ben,给予苯那普利10 mg·kg-1·d-1)、厄贝沙坦组(Irb,给予厄贝沙坦50 mg·kg-1·d-1)、联合组(Com,给予苯那普利5 mg·kg-1·d-1和厄贝沙坦25 mg·kg-1·d-1),假手术组(Con)作为对照,和Mod组同时给予等量生理盐水,连续灌胃治疗8周。
1.3 检测指标 1.3.1 大鼠尾动脉收缩压测定每隔2周,采用RBP-1B型大鼠尾动脉压测量仪监测大鼠尾动脉收缩压(systolic blood pressure,SBP),重复3次,每次间隔1 min,计算均值作为收缩压。
1.3.2 超声心动图检测运用SONOS 5500型超声诊断仪,取胸骨旁左室长轴切面,探头频率3~11Hz,测量心脏EF。
1.3.3 心肌细胞超微结构开胸后迅速取心尖部位心肌组织,用预冷的生理盐水洗去血污,切成体积约1 mm3的心肌数块,置于体积分数为0.04的戊二醛前固定;再用体积分数为0.01的锇酸后固定,经系列丙酮脱水,Epon812包埋,1 μm半薄切片,甲苯胺蓝染色后,以光镜定位,超薄切片机切片70 nm,醋酸铀-柠檬酸铅双重染色,利用透射电镜观察并摄像。
1.3.4 心肌组织羟脯氨酸测定采用样本碱水解法,按试剂盒说明操作,依次进行样本处理、调节pH、样本稀释和样本检测。
1.3.5 心肌胶原交联程度检测用胃蛋白酶限制性降解法。100 mg心肌组织在预冷的1 mol·L-1醋酸中剪碎,加入胃蛋白酶,封口,4℃匀速搅拌消化,冷冻离心。上清液中含胃蛋白酶可溶性胶原(pepsin-soluble collagen,PSC),沉淀物中含胃蛋白酶不溶性胶原(pepsin-insoluble collagen,PIC)。取上清液1 mL,与沉淀分别进行羟脯氨酸含量测定,计算胶原限制性胃蛋白酶降解程度,即PSC占胶原总量(PSC和PIC之和)的百分比,反映心肌胶原交联程度。
1.3.6 免疫组织化学检测取左心室心肌组织,应用体积分子为0.1的福尔马林固定,石蜡包埋,切片。依次加入兔抗大鼠Ⅰ型胶原、Ⅲ型胶原,生物素化山羊抗兔二抗,封片,显微镜观察。PBS代替一抗作为空白对照。每个样本在200倍视野范围内寻找100个细胞测定其积分光密度,取平均值作统计学分析。
1.3.7 Western blot取约100 mg左室心肌,BCA法蛋白定量。取各样本50 μg蛋白质进行SDS-PAGE电泳,转膜,分别加入p-38MAPK、 p-p38MAPK及GAPDH一抗孵育,TBS洗3次,滴加含有二抗的封闭液,ECL法显影。四星图像处理系统测定各组蛋白表达量与内参表达量(GAPDH)的比值。
1.4 统计学分析利用Stata 13.0统计软件进分析处理数据,各组资料用 ± s表示,组间采用方差分析,两两比较采用SNK检验。
± s表示,组间采用方差分析,两两比较采用SNK检验。
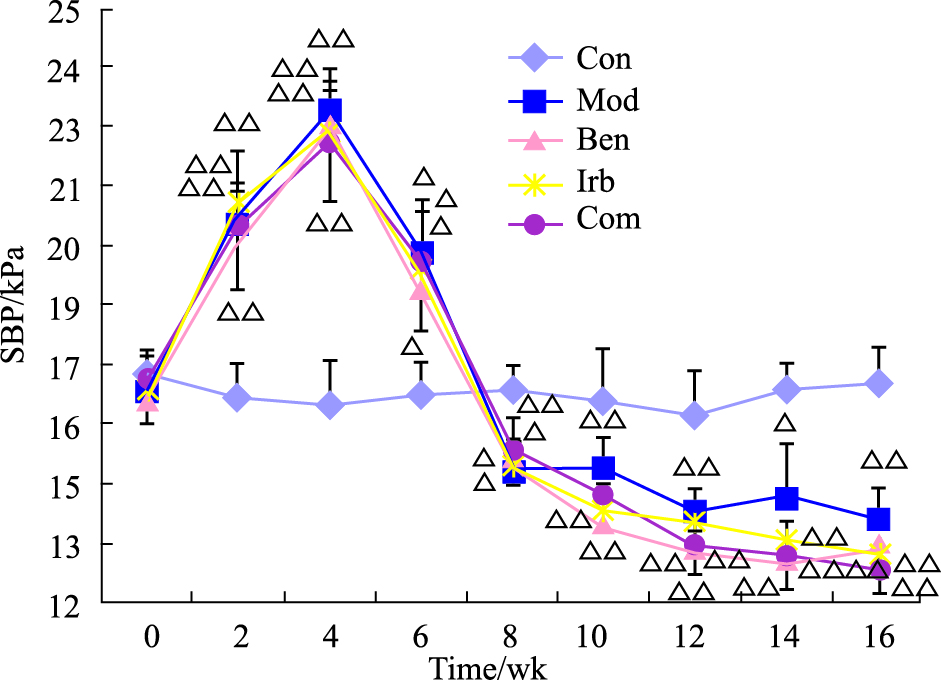
实验前,各组大鼠血压无差异(P>0.05),整个实验过程中Con组血压维持不变。腹主动脉缩窄术后4周,各组血压与Con组相比明显升高(P<0.01)。治疗8周后,各治疗组血压与Mod组相比无统计学意义(P>0.05,Fig1)。
|
Fig.1
Systolic blood pressure rat tail artey( ± s,n=9 rats in each group)
ΔP<0.05,ΔΔP<0.01 vs Con ± s,n=9 rats in each group)
ΔP<0.05,ΔΔP<0.01 vs Con
|
超声心动图统计数据显示,Con组EF为(81.67±4.65)%,Mod组EF值为(42.11±4.47)%,提示出现心力衰竭;Ben组、Irb组和Com组分别为(64.67±6.90)%、(64.22±8.89)%、(70.00±6.35)%,各用药组与Mod组相比均有不同程度的升高(P<0.01),但各治疗组间差异无统计学意义。
2.3 心肌细胞超微结构Con组心肌细胞内肌原纤维清晰,排列整齐,横纹清楚,线粒体串珠样整齐排列于肌原纤维之间,大小形态正常,可见清晰的闰盘;间质纤维无增生。Mod组心肌细胞内肌原纤维模糊,排列紊乱、断裂严重,横纹不清,线粒体大量增生,分布紊乱,肿胀变形,可见闰盘;间质内大量胶原纤维增生。各治疗组大部分肌原纤维排列紧密,线粒体增生、水肿较模型组明显好转,排列相对整齐,可见闰盘,存在轻度扭曲、断裂;间质内胶原纤维增生明显减少(Fig2)。

|
| Fig.2 UItrastructure of myocardium under transmission electron microscope(scare bar:2μm) 1:Myocardial cell,,mitochondria,intercalated disc;2:interstitial collagen |
羟脯氨酸只参与胶原的合成,其含量占胶原的13.4%,故测定心肌组织中羟脯氨酸的含量就可估算心肌胶原蛋白的含量。与Con组相比,Mod组羟脯氨酸含量较高(P<0.01),提示模型组心肌胶原总量升高;与Mod组相比,各治疗组羟脯氨酸含量均明显下降(P<0.01),且Com组较Ben组或Irb组低(P<0.05)。提示苯那普利与厄贝沙坦联用在降低心力衰竭心肌胶原纤维总量方面优于单用(Tab1)。
 ± s,n=9)
± s,n=9)
| Group | Hydroxyproline/ μg·g-1 | Limited pepsin degradation/% |
| ΔP<0.05, ΔΔP<0.01 vs Con; *P<0.05,**P<0.01 vs Mod; #P<0.05 vs Ben or Irb | ||
| Con | 193.24±11.01 | 95.69±5.99 |
| Mod | 563.41±98.99ΔΔ | 66.02±8.42ΔΔ |
| Ben | 337.88±46.89Δ** | 80.08±4.44ΔΔ* |
| Irb | 349.27±62.85Δ** | 79.74±5.83ΔΔ* |
| Com | 244.44±19.76Δ**# | 85.64±5.30Δ** |
实验结果(Tab1)发现,Mod组心肌胶原在胃蛋白酶溶液中的降解程度较Con组下降(P<0.01),提示Mod组心肌胶原的交联程度增加;各治疗组心肌胶原在胃蛋白酶溶液中的降解程度均明显提高(P<0.05或P<0.01),表明心肌胶原的交联程度下降,但各组之间差异无统计学意义。
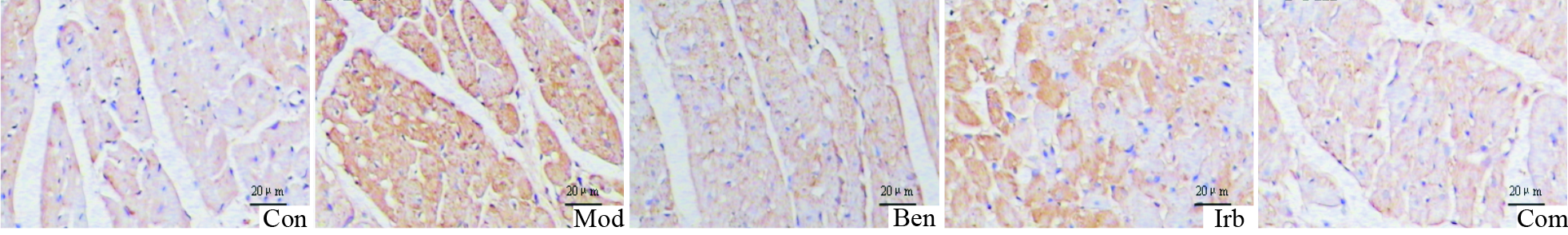
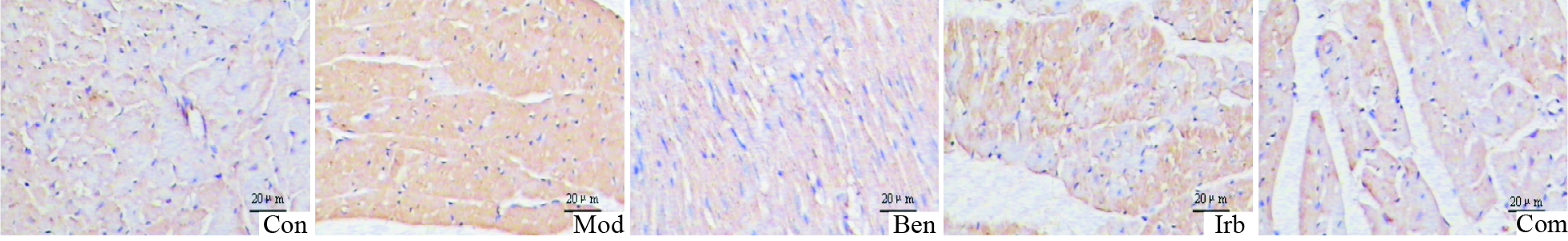
2.6 免疫组化检测大鼠心肌Ⅰ、Ⅲ型胶原蛋白表达Con组大鼠左室心肌间质Ⅰ型、Ⅲ型胶原低表达,阳性颗粒散在,染色较浅;Mod组高表达,棕黄色信号强,融合成片;各治疗组心肌Ⅰ型、Ⅲ型胶原表达明显降低,Com组最为明显(Fig3-4,Tab2)。
|
| Fig.3 Type Ⅰ collagen expression in myocardium of rats by immunohistochemistry |
|
| Fig.4 Type Ⅲ collagen expression in myocardium of rats by immunohistochemistry |
 ± s,n=9)
± s,n=9)
| Group | Type Ⅰ | Type Ⅲ |
| ΔΔP<0.01 vs Con; **P<0.01 vs Mod; ##P<0.01 vs Ben or Irb | ||
| Con | 0.14±0.01 | 0.15 ± 0.01 |
| Mod | 0.80±0.11ΔΔ | 0.49±0.06ΔΔ |
| Ben | 0.62±0.08ΔΔ** | 0.36±0.03ΔΔ** |
| Irb | 0.59±0.10ΔΔ** | 0.35±0.03ΔΔ** |
| Com | 0.39±0.06ΔΔ**## | 0.26±0.06ΔΔ**## |
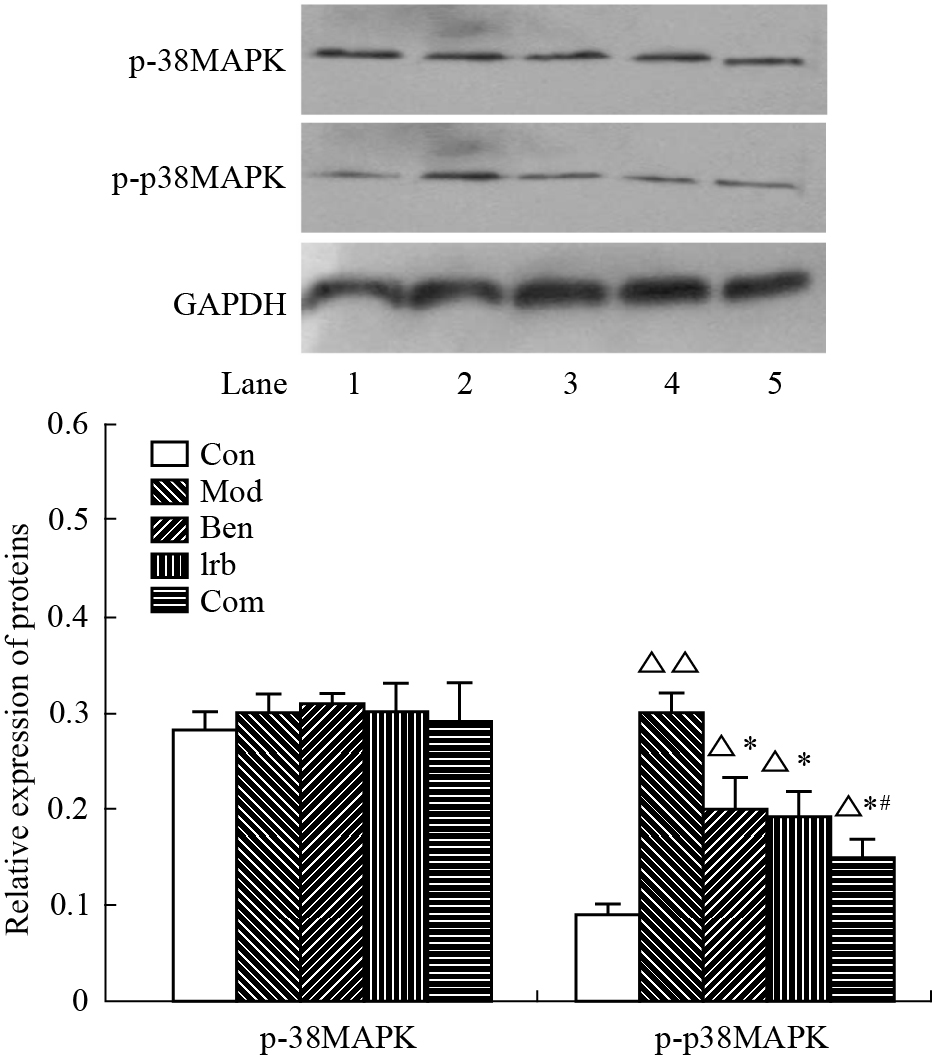
Mod组p-p38MAPK的表达明显高于Con组(P<0.01),各治疗组有不同程度的降低(P<0.05)(Fig5)。
|
| Fig.5 Expression of p38MAPK and p-p38MAPK in left ventricular myocardium in rats (n=4) 1: Con; 2: Mod; 3: Ben; 4: Irb; 5: Com;△P<0.05,△△P<0.01 vs Con; *P<0.05 vs Mod; #P<0.05 vs Ben or Irb |
心室重构引起的心肌结构和功能的改变是CHF发生发展的核心机制[1],其中心肌纤维化是心肌重塑过程中心功能由代偿转变为失代偿的重要环节[2]。生理情况下,Ⅰ、Ⅲ型胶原纤维构成心肌胶原网络支架,在保护心肌细胞、维持心脏几何构型和僵硬度等方面起着十分重要的作用[6]。心肌僵硬度是指心肌发生应变的程度,是心脏舒张功能的主要决定因素。Yamamoto等[7]研究发现,心肌僵硬度主要取决于心室纤维化而非心室肥厚[7];Matsubara等[8]发现心肌胶原堆积可增加心肌僵硬度,而左心室肥厚却未观察到此类现象的发生。本研究发现,Mod组大鼠心肌组织羟脯氨酸总量明显增高,免疫组织化学结果显示,Ⅰ、Ⅲ型胶原表达明显增加,超微结构亦可见间质纤维增生明显,提示实验中模型大鼠已出现心肌胶原含量增加和心肌纤维化。
除胶原总量外,Ⅰ、Ⅲ型胶原的比值亦可影响心肌僵硬度,两者的比例与不良心血管事件关系密切,是决定胶原性质与判断心肌僵硬程度的重要依据[9]。心肌纤维化时,除胶原总量增多这一特征外,常伴随 Ⅰ型胶原增多,而Ⅲ型胶原相对减少,且这两型胶原的比例与心肌僵硬程度呈正比[10]。另外,胶原交联亦可影响心脏的僵硬度。研究显示,心衰大鼠伴随左心室重量、左心室舒张末期压力及肺重量/体重的增加同时,其心脏羟脯氨酸含量、Ⅰ/Ⅲ型胶原比例及左心室心肌僵硬度均增高,而可溶性胶原的含量下降,说明除了胶原含量、Ⅰ/Ⅲ型胶原比值等因素之外,心肌胶原交联程度亦可影响心肌僵硬度[6]。因此,若要改善心功能,减轻心肌僵硬度,除了降低心室胶原总量外,尚需考虑Ⅰ和Ⅲ型胶原的比值及胶原交联度的影响。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem,RAAS)抑制剂除了影响胶原总量,尚可通过调节胶原的比例及网路支架重构来改善心肌纤维化。贾志梅等[11]通过对心肌梗死大鼠非梗死区心室重构的研究发现,雷米普利可抑制Ⅰ型胶原下调心肌僵硬度。邢晓倩等[12]研究发现,氯沙坦可减少心室胶原沉积、降低Ⅰ/Ⅲ比值,进而改善胶原类型比例、增加心室顺应性、抑制心衰大鼠心肌纤维化。苯那普利是临床最常用的的血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)之一,厄贝沙坦是中等强度的血管紧张素受体阻断剂(angiotensin receptor blocker,ARB),其强度介于缬沙坦与厄贝沙坦之间,两者合用可在不同水平阻断RAAS。我们的前期研究发现联合应用苯那普利和厄贝沙坦可下调AngⅡ、血管紧张素I型受体,上调血管紧张素Ⅱ型受体、ACE2[13]。本研究也发现,苯那普利及厄贝沙坦治疗后能降低心肌纤维化程度,减少交联胶原的比例,提高心衰大鼠射血分数,改善心功能。
p-38信号通路是MAPK通路的一个重要分支,是介导各种细胞因子、应激刺激,导致细胞凋亡、 分化及炎症反应的重要细胞内信号转导途径[14, 15] 。各种刺激下,p-38被激活并进入细胞核或转移到其它部位,参与应激条件下免疫调节、炎症反应和细胞凋亡过程[16]。ARB可完全阻断 p-38MAPK 的活性,从而逆转自发性高血压心衰大鼠左心室肥厚现象,提示心脏重构与p-38MAPK 信号通路密切相关[17]。本研究中 Western blot结果显示:心力衰竭时,p-38激酶磷酸化水平明显增高;治疗后,各组大鼠心肌组织p-38激酶蛋白总量无明显变化,但磷酸化水平明显下降,提示两药可抑制心力衰竭发生发展过程中p-38MAPK磷酸化修饰。在压力容量负荷过重、心肌缺血缺氧情况下,p-38MAPK被激活,诱导心肌胚胎基因表达和细胞骨架重组,促使心肌代偿性重构,同时也可诱导心肌细胞凋亡反应,加重心力衰竭的进程[18]。苯那普利和(或)厄贝沙坦可降低心肌组织p-38MAPK磷酸化水平,对心脏起保护作用,可能与抑制促凋亡信号相关,但对该家族成员信号转导途径中的上/下游蛋白和各种激酶的激活机制还有待于进一步探讨明确。
本研究提示,苯那普利及厄贝沙坦均可改善心衰大鼠心肌胶原纤维的总量与性质,减轻心室纤维化,并使心衰大鼠p-38MAPK的磷酸化水平下降。
| [1] | Paulus W J, Tschöpe C. A novel paradigm for heart failure with preserved ejection fraction:comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation [J]. J Am Coll Cardiol, 2013, 62(4):263-71. |
| [2] | Cavalera M, Wang J, Frangogiannis N G. Obesity, metabolic dysfunction, and cardiac fibrosis:pathophysiological pathways, molecular mechanisms, and therapeutic opportunities [J]. Transl Res, 2014, 164(4):323-35. |
| [3] | Young P R.Perspective on the discovery and scientific impact of p38 MAP kinase[J].J Biomol Screen, 2013, 18(10):1156-63. |
| [4] | Tagashira H, Matsumoto T, Taguchi K, et al. Vascular endothelial σ1-receptor stimulation with SA4503 rescues aortic relaxation via Akt/eNOS signaling in ovariectomized rats with aortic banding [J]. Circ J, 2013, 77(11):2831-40. |
| [5] | Zaha V, Grohmann J, Göbel H, et al. Experimental model for heart failure in rats-induction and diagnosis [J]. Thorac Cardiovasc Surg, 2003, 51(4):211-5. |
| [6] | Zouein F A, Kurdi M, Booz G W, et al. Applying fractal dimension and image analysis to quantify fibrotic collagen deposition and organization in the normal and hypertensive heart [J]. Microsc Microanal, 2014, 20(4):1134-44. |
| [7] | Yamamoto K, Masuyama T, Sakata Y, et al. Myocardial stiffness is determined by ventricular fibrosis, but not by compensatory or excessive hypertrophy in hypertensive heart [J]. Cardiovasc Res, 2002, 55(1):76-82. |
| [8] | Matsubara L S, Matsubara B B, Okoshi M P, et al. Alterations in myocardial collagen content affect rat papillary muscle function [J]. Am J physiol Heart Circ Physiol, 2000, 279(4):H1534-9. |
| [9] | Depalle B, Qin Z, Shefelbine S J, et al. Influence of cross-link structure, density and mechanical properties in the mesoscale deformation mechanisms of collagen fibrils [J]. J Mech Behav Biomed Mater, 2014 Jul 29. pii:S1751-6161(14)00201-X. |
| [10] | Alves J P, Nunes R B, Stefani G P, et al. Resistance training improves hemodynamic function, collagen deposition and inflammatory profiles:experimental model of heart failure [J]. PLoS One, 2014, 9(10):e110317. |
| [11] | 贾志梅, 高 远, 周 瀛, 等. 雷米普利抑制心肌梗死大鼠非梗死区心室重构机制探讨 [J].中国药理学通报, 2007, 23 (12):1676-7. Jia Z M, Gao Y, Zhou Y, et al. Mechenism study of ramipril inhibited ventricular remodeling in non-infarct zone in rats after acute myocardial infarction [J]. Chin Pharmacol Bull, 2007, 23 (12):1676-7. |
| [12] | 邢晓倩, 徐 健, 吕雄文, 等. 氯沙坦和辛伐他汀对逆转压力负荷心力衰竭大鼠心室心肌纤维化的作用[J].中国药理学通报, 2009, 25(10):1376-9 Xing X Q, Xu J, Lyu X W, et al. Combination of simvastatin and losartan attenuates left ventricular myocardial fibrosis after pressure over load state in rats [J]. Chin Pharmacol Bull, 2009, 25(10):1376-9. |
| [13] | 任亚丽, 徐济良, 虞 珏, 等. 苯那普利与厄贝沙坦对心衰大鼠心室重构过程中Ang Ⅱ受体及ACE2的影响 [J]. 中国药理学通报, 2008, 24(12):1582-5. Ren Y L, Xu J L, Yu J, et al. Effects of benazepril with irbesartan on expression of angiotensin Ⅱ receptor and ACE2 in chronic heart failure rats during cardiac remodeling [J]. Chin Pharmacol Bull, 2008, 24(12):1582-5. |
| [14] | Javadov S, Jang S, Agostini B. Crosstalk between mitogen-activated protein kinases and mitochondria in cardiac diseases:therapeutic perspectives [J]. Pharmacol Ther, 2014, 144(2):202-25. |
| [15] | 吴莉芳, 刘莹莹, 房绍红, 等. 重组人谷氧还蛋白1对小鼠脑缺血/再灌注损伤的保护作用 [J].中国药理学通报, 2007, 23(5):641-4. Wu L F, Liu Y Y, Fang S H, et al. Protective effect of recombinant human glutare doxin-1 against the cerebral ischemia-reperfusion injury in mice [J]. Chin Pharmacol Bull, 2007, 23(5):641-4. |
| [16] | Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents [J]. Cancer Lett, 2014, 344(2):174-9. |
| [17] | Liang Q,Elson A C,Gerdes A M. p38MAP kinase activity is correlated with angiotensinⅡ type1 receptor blocker-induced left ventricular reverse remodeling in spontaneously hypertensive heart failure rats [J]. J Card Fail, 2006, 12(6):479-86. |
| [18] | Martin E D,Bassi R,Marber M S.p38 MAPK in cardioprotection-are we there yet [J]? Br J Pharmacol,2015,172(8):2101-13. |

