2. 重庆医科大学公共卫生与管理学院营养与卫生学教研室, 重庆 400016;
3. 重庆医科大学附属儿童医院 儿童发育疾病研究省部共建教育部重点实验室, 重庆 400014
2. Dept of Nutrition and Food Hygiene, School of Public Health and Management, Chongqing Medical University, Chongqing 400016, China;
3. Ministry of Education Key Laboratory of Child Development and Disorders, Children's Hospital, Chongqing Medical University, Chongqing 400014, China
大量研究已证实,糖尿病和AD的发病机制有着密切的关系[1],糖代谢紊乱可能是诱发AD的始动因子,甚至有学者称AD就是3型糖尿病[2]。糖尿病导致认知功能障碍的机制目前尚未完全阐明。近来有研究发现,胰岛素代谢紊乱不仅发生在糖尿病患者的外周组织器官,而且在AD患者大脑中也出现高胰岛素,胰岛素分泌减少和胰岛素抵抗都会加大患AD的风险[3]。有研究认为胰岛素在大脑中不是糖代谢的主要调控因子,但可促进神经细胞的增殖[4],以及调节大脑皮质和海马组织中的突出可塑性[5],从而影响学习记忆能力。海马是学习记忆的重要神经中枢,与认知功能关系密切。有研究已经表明,在1型糖尿病大鼠模型中,大鼠的学习记忆能力明显受损,海马神经细胞凋亡逐渐增多,并与认知功能障碍密切相关[6]。
罗格列酮(rosiglitazone,RSG)是一种PPARγ受体激动剂,通过改善外周组织胰岛素受体敏感性而广泛应用于2型糖尿病的治疗。然而有研究发现,罗格列酮可以通过激活ERK等信号通路来改善AD动物模型的认知功能[7, 8, 9]。那么,本研究旨在观察PPARγ受体激动剂罗格列酮能否改善因代谢紊乱而导致的认知功能障碍以及对罗格列酮改善这一现象的机制进行探讨。
1 材料与方法 1.1 动物模型的建立及分组选取♂ ob/ob小鼠36只,正常C57BL/6J(Wild type,WT)♂小鼠18只。ob/ob小鼠随机分为两组,每组18只,一组腹腔注射10 mg·kg-1·d-1罗格列酮,即罗格列酮组(ob/ob-RSG),另一组以及WT小鼠分别注射同等体积的生理盐水,即生理盐水组(ob/ob-Saline)和正常对照组(WT)。小鼠均于重庆医科大学附属儿童医院SPF级动物房饲养,遵循国际标准饲养条件,12 h正常光照,室温(22±1)℃,常年湿度60% RH,压差40 kPa,定期消毒并更换笼子,给予标准饲料喂养,自由饮水。连续每周检测3组小鼠的体重,至7个月后注射药物并连续检测随机血糖10 d。腹腔注射10%的水合氯醛处死后分离小鼠大脑海马组织。
1.2 新事物探索实验(novel object recognition)装置为内外黑色开口方形木盒,正上方置摄像头,测试分3 d:d 1,将小鼠放于空置的盒子内自由活动适应环境5 min,之后放回饲养笼;d 2,即24 h后,将盒子固定的4个角落分别放置不同的物体A、B、C、D,小鼠放入盒子的正中央,进行5 min的自由探索后放回饲养笼;d 3,即为测试阶段,交换其中任意两个物体即C、D的位置,再次将小鼠从正中央放入,自由探索5 min,放回饲养笼。每只小鼠测试完成后,用酒精擦拭干净后放入下一只。测试期间,小鼠的鼻子在1cm内探向物体或者接触到物体则为有效探索,分别记录测试阶段小鼠探索A、B物体和C、D物体的时间,以小鼠探索C、D物体的时间与A、B物体的时间的比值来反映小鼠对新事物的探索能力。
1.3 实时荧光定量PCR (RT-PCR)采用TRIzol法提取大脑海马组织总RNA,RNA逆转录采用ABI公司逆转录试剂盒的方法,在Bio-Rad荧光定量PCR仪上检测目的基因mRNA表达水平,以β-actin作为内参。引物通过primer5.0软件设计,APP PCR引物正义链:5′-CGGAATTCCCTTGGTGTTCTTTGCA GAAG-3′,反义链:5′-CGGAATTCCGTTCTGCATCTG CTCAAAG-3′。内参β-actin引物正义链:5′-TGCTG TCCCTGTATGCCTCTG-3′,反义链:5′-GTTCATGC GCTCGTAGATCA-3′。
1.4 蛋白免疫印迹法 (Western blot)采用罗氏(Roche)蛋白裂解液提取海马组织总蛋白,碧云天BCA试剂盒检测蛋白浓度,SDS-PAGE方法分离目的蛋白,其中分离胶浓度10%,浓缩胶为5%,PVDF转膜。BACE1为兔抗鼠单克隆一抗(Cell signaling Technology),p-Akt及Total-Akt为兔抗鼠多克隆一抗(Cell Signaling Technology),p-IRS1及Total-IRS1也为兔抗鼠多克隆一抗(Abcam公司),均为山羊抗兔二抗(Abcam公司)。ECL试剂盒(Bio-Rad公司)进行化学发光。所得数据用Quantity One软件进行定量分析,以目的基因与β-actin条带灰度值的比值表示目的蛋白相对表达量。
1.5 酶联免疫吸附法 (ELISA)称量完整大鼠海马组织,按照5 mL·g-1海马质量加入相当体积0.01 mol·L-1预冷的PBS,在冰上用玻璃匀浆器匀浆;4℃,5 000×g·min-1离心5 min,取上清。BCA试剂盒(Thermo公司)检测总蛋白浓度。严格按照淀粉样蛋白Aβ1-40检测试剂盒(武汉尤尔生)说明书步骤进行。用酶标仪在450 nm波长下测定吸光度值(optical density,OD值),计算样品浓度。以样本Aβ1-40浓度与总蛋白浓度的比值表示Aβ1-40的表达水平。
1.6 统计学分析 所有数据用GraphPad Prism 5.0进行统计学分析,以 表示,两组之间同一时相点采用t检验。
表示,两组之间同一时相点采用t检验。
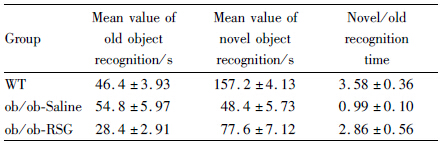
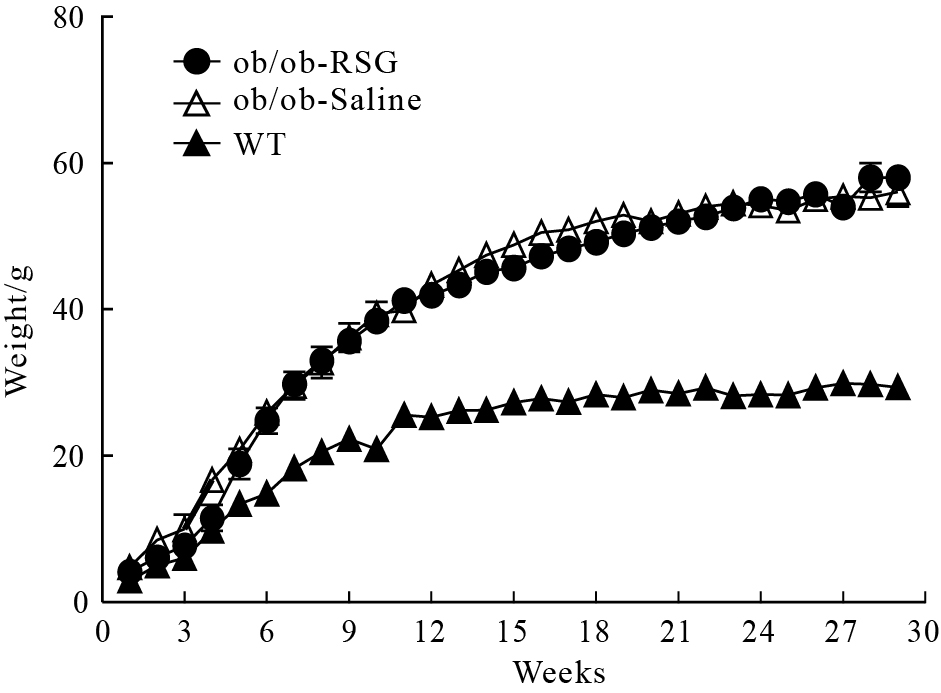
与生理盐水组相比较,RSG处理后ob/ob小鼠的血糖水平从(22.78±1.62)mmol·L-1降低至(6.43±1.17)mmol·L-1,表明ob/ob小鼠在RSG处理后糖代谢得到明显的改善,结果见Fig2;ob/ob小鼠体重明显高于正常组,但是短时间RSG处理并没有改变ob/ob小鼠的体重,见Fig1。
|
| Fig 1 Body weight of three groups |
|
| Fig 2 Random blood glucose of three groups |
通过新事物探索实验对小鼠的空间记忆及探索能力进行检测,发现代谢受损的ob/ob小鼠对C、D两个新事物的探索时间明显低于正常小鼠对新事物的探索时间,ob/ob小鼠的空间记忆能力明显下降,而RSG处理后ob/ob小鼠的这一现象得到改善,见Tab1。
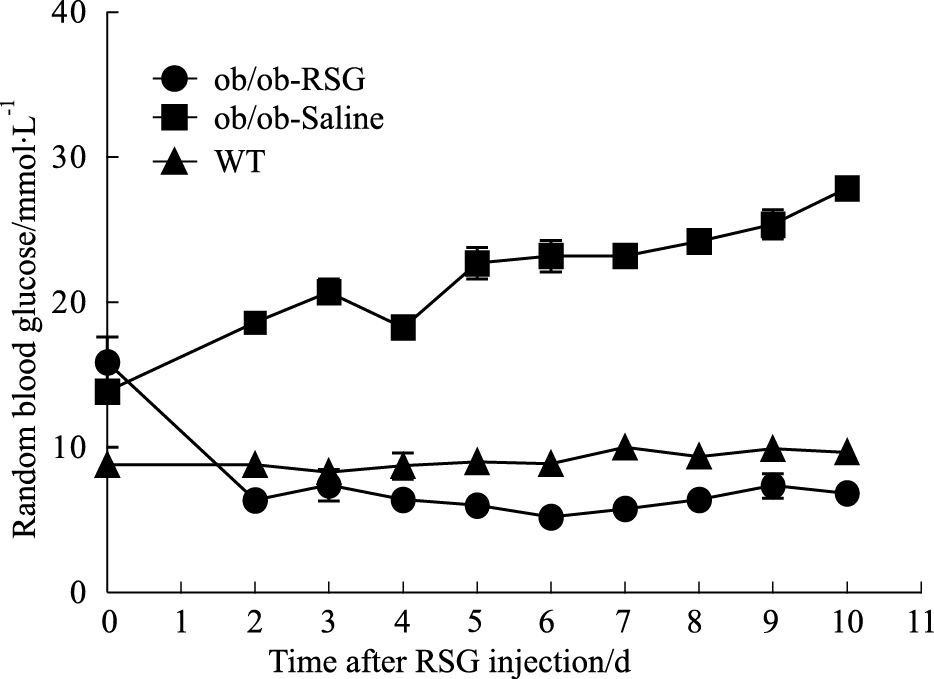
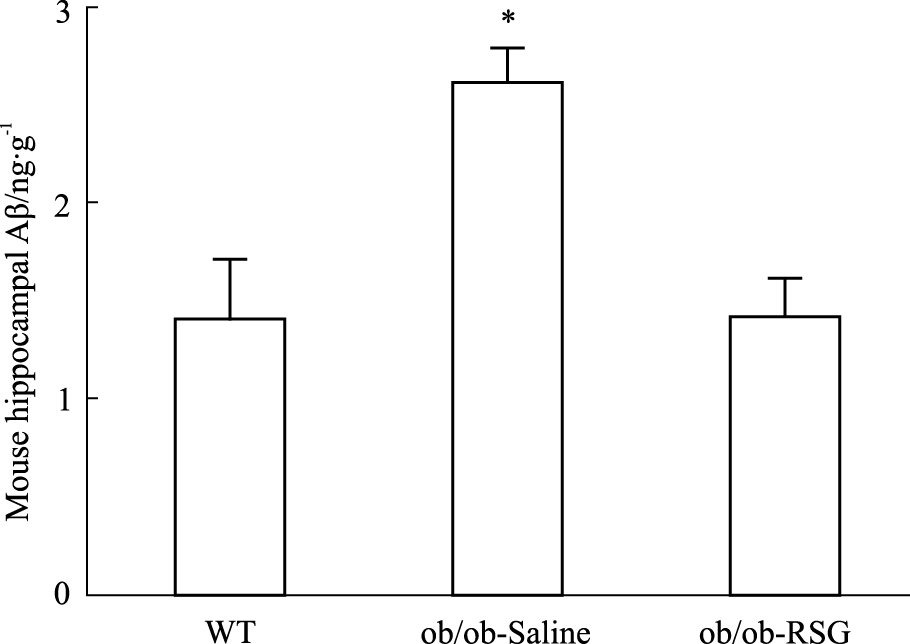
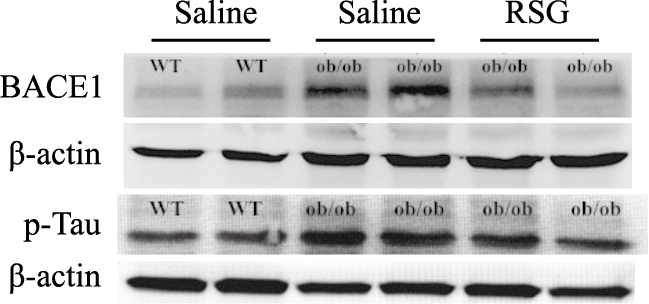
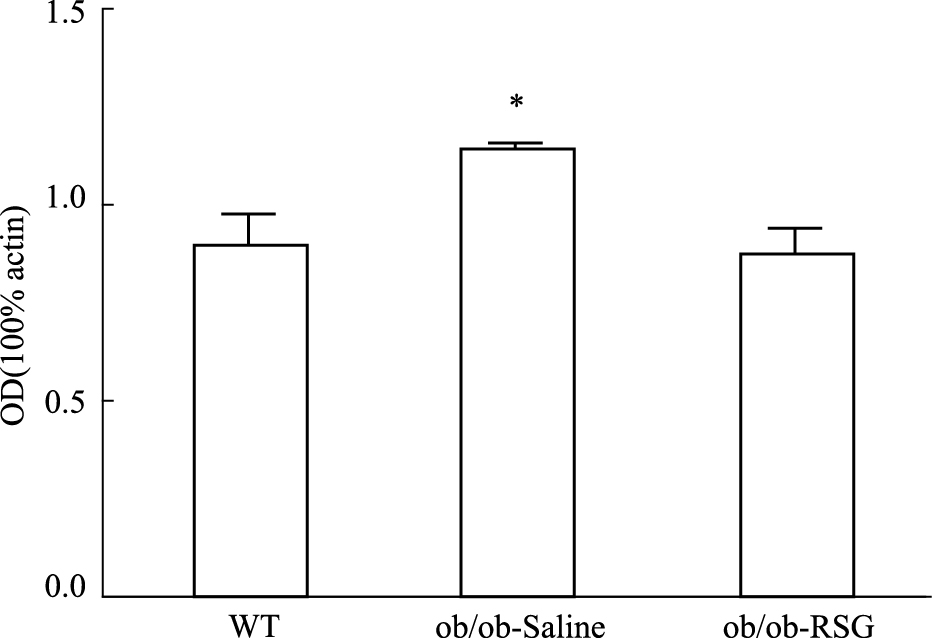
为观察肥胖对认知功能的影响以及罗格列酮对肥胖ob/ob小鼠认知功能的改善作用,分别采用RT-PCR及Western blot的方法检测大脑海马组织中APP和BACE1表达水平变化。结果显示,与正常组相比较ob/ob小鼠海马组织中APP表达水平增高(P<0.01),然而在罗格列酮处理后ob/ob小鼠海马组织中APP表达水平降低(P<0.05),并且趋近于正常组,见Fig3;同时ob/ob小鼠BACE1的蛋白表达水平也升高(P<0.05),罗格列酮处理后得到逆转,见Fig5、6;另外,ob/ob小鼠大脑海马组织中神经纤维缠结组份tau蛋白的磷酸化水平异常增加,罗格列酮处理后这一现象得到改善。采用ELISA方法对BACE1剪切APP后的终产物β淀粉样蛋白(Aβ)水平测定结果显示ob/ob小鼠海马组织中Aβ水平明显增高(P<0.05),罗格列酮处理后ob/ob小鼠海马组织中Aβ水平降低(P<0.05),见Fig4。
|
| Fig 3 Expression levels of APP in hippocampus of three groups **P<0.01 vs WT; #P<0.05 vs ob/ob-Saline |
|
| Fig 4 Expression levels of Aβ in hippocampus of three groups by ELISA *P<0.05 vs WT and ob/ob-RSG |
|
| Fig 5 BACE1 and p-Tau protein levels in hippocampus of three groups by Western blot |
|
| Fig 6 BACE1 quantitative expression in hippocampus of three groups *P<0.05 vs WT and ob/ob-RSG |
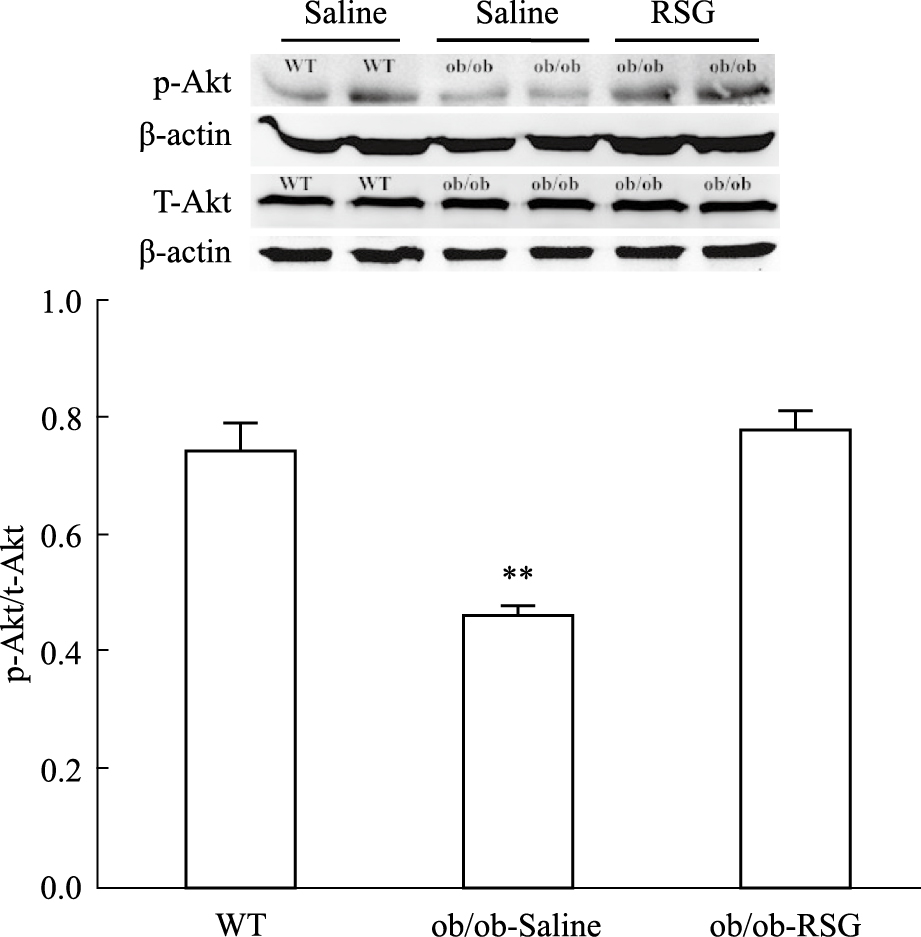
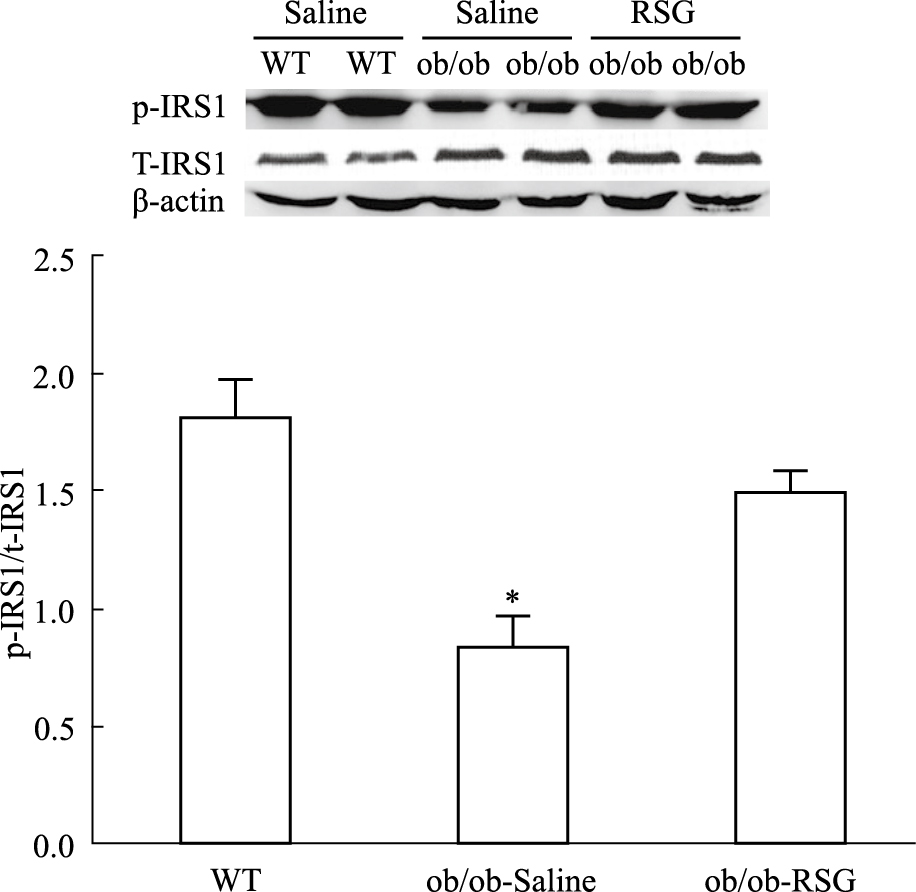
对3组小鼠大脑海马组织胰岛素信号通路中IRS1及Akt磷酸化水平检测,结果显示与正常组相比较,生理盐水处理组IRS1与Akt磷酸化水平减少(P<0.05,P<0.01),罗格列酮处理后这一现象得到改善(P<0.05,P<0.01),但3组动物海马组织中总IRS1以及Akt表达水平差异无显著性,见Fig7、8。
|
| Fig 7 p-Akt and total Akt protein levels in hippocampus of three groups by Western blot **P<0.01 vs WT and ob/ob-RSG |
|
| Fig 8 p-IRS1 and total IRS1 protein levels in hippocampus of three groups by Western blot *P<0.05 vs WT and ob/ob-RSG |
近年来,糖尿病与AD的关系越来越受到关注,糖尿病患者到老年期患AD的风险是正常人的2~3倍[10],而AD患者中有80%都出现糖代谢异常[11]。但是糖尿病导致AD的分子机制目前尚未完全阐明。有研究发现胰岛素通过PI3K-Akt信号通路可以预防神经细胞的凋亡[12],临床研究显示糖尿病患者与正常人相比大脑神经细胞凋亡更加严重[13],这 种现象可能是由于胰岛素信号通路对神经细胞的保护作用丢失而导致,可见胰岛素信号通路在糖尿病和AD中发挥着重要的作用。在本研究中,新事物探索实验表明代谢紊乱的ob/ob小鼠出现严重的认知功能障碍。导致AD发生的最主要病理机制就是Aβ沉积,那么我们的研究结果显示ob/ob小鼠大脑海马组织中Aβ水平升高,且导致其生成的关键酶BACE1表达增强,BACE1的底物APP表达量也增加,tau蛋白异常磷酸化增强。脑内大量的Aβ产生并聚积形成老年斑,导致大脑神经纤维缠绕,轴突受损及突触丢失,从而认知功能下降。本研究表明代谢紊乱导致Aβ、APP及BACE1表达增强,可能参与了AD发生。
Akt是P-IRS1/PI3K信号通路下游的一种丝氨酸/苏氨酸激酶。当胰岛素作用于胰岛素受体后,胰岛素受体底物1和2(IRS1/2)发生磷酸化,进而激活下游的多种蛋白[14],其中脂质激酶磷脂酰肌醇3激酶(PI3K)在胰岛素代谢方面发挥重要的作用,PI3K被激活后可以使细胞膜上的磷脂酰肌醇4,5二磷酸(PIP2)转化为磷脂酰肌醇3,4,5三磷酸 (PIP3),PIP3使下游Akt发生磷酸化[15]。Akt一方面可调节细胞生长、分化及凋亡过程,另一方面可使糖原合成酶激酶3β(GSK3β)磷酸化。非磷酸化的GSK3β对神经细胞具有毒性作用,使突触可塑性减弱,当GSK3β磷酸化以后可降低这一毒性反应。在本研究中,我们发现ob/ob小鼠海马组织中总IRS1及Akt表达量虽未发生变化,但IRS1与Akt磷酸化水平却明显降低,说明ob/ob小鼠大脑海马组织中胰岛素信号通路受损;且p-IRS1/p-Akt水平降低的同时,BACE1表达增强,表明胰岛素信号通路受损可能参与调节了Aβ 生成这一病理学过程。当大量的Aβ产生并聚集后形成淀粉样沉淀从而将导致AD发生。
PPARγ受体激动剂罗格列酮可以增强外周组织对胰岛素的敏感性,因此成为治疗糖尿病患者胰岛素抵抗的有效药物之一。然而在对AD模型的研究中,有学者发现罗格列酮可逆转海马组织齿状回区ERK MAPK信号通路,并且可以改善AD小鼠的突出可塑性,增强神经递质的释放与传导,进而改善AD小鼠的认知功能[8, 9]。本研究结合了糖尿病作为AD的一个诱因,胰岛素信号通路作为两者共同的病理机制,从而利用罗格列酮增强胰岛素敏感性这一作用机制,对糖尿病样ob/ob小鼠进行药物干预,发现罗格列酮不仅可以改善ob/ob小鼠的糖代谢异常而且改善了因代谢异常导致的认知功能障碍,这一研究为糖尿病导致AD的预防及治疗提供一定的理论基础。
(本课题在重庆医科大学附属儿童医院认知与学习记忆障碍转化医学实验室完成。感谢重庆医科大学附属儿童医院为我的课题研究提供技术支持和仪器设备。感谢致力于认知与学习记忆障碍转化医学方向的宋伟宏院士,在阿尔茨海默症病理性机制方面给予了专业的指导)。
| [1] | Sims-Robinson C, Kim B, Rosko A,Feldman E L. How does diabetes accelerate Alzheimer disease pathology[J]? Nat Rev Neurol, 2010,6:551-9. |
| [2] | Dela Monte S M. Type 3 diabetes is sporadic Alzheimer's disease:Mini-review[J].Eur Neuropsychopharmacol, 2014,10:10-6. |
| [3] | R nnemaa E, Zethelius B, Sundel f J,et al. Impaired insulin secretion increases the risk of Alzheimer disease[J]. Neurology,2008,71(14):1065-71. |
| [4] | Beattie E C,Carroll R C,Yu X,et al. Regulation of AMPA receptor endocytosis by a signaling mechanism shared with LTD[J]. Nat Neurosci, 2000,3(12):1291-300. |
| [5] | Jafari Anarkooli I, Sankian M, Ahmadpour S, et al. Evaluation of Bcl-2 family gene expression and Caspase-3 activity in hippocampus STZ-induced diabetic rats[J]. Exp Diabetes Res,2008,2008:638467. |
| [6] | Ott A, Stolk R P, van Harskamp F, et al. Diabetes mellitus and the risk of dementia:the Rotterdam Study[J]. Neurology,1999,53(9):1937-42. |
| [7] | Pedersen W A, McMillan P J, Kulstad J J, et al. Rosiglitazone attenuates learning and memory deficits in Tg2576 Alzheimer mice[J]. Exp Neurol,2006,199(2):265-73. |
| [8] | Denner L A, Rodriguez-Rivera J, Haidacher S J,et al. Cognitive enhancement with rosiglitazone links the hippocampal PPARγ and ERK MAPK signaling pathways[J]. J Neurosci,2012,32(47):16725-35. |
| [9] | Nenov M N, Laezza F, Haidacher S J,et al. Cognitive enhancing treatment with a PPARγ agonist normalizes dentate granule cell presynaptic function in Tg2576 APP mice[J]. J Neurosci,2014,34(3):1028-36. |
| [10] | Petot G J, Traore F, Debanne S M, et al. Interactions of apolipoprotein E genotype and dietary fat intake of healthy older persons during mid-adult life[J]. Metabolism,2003,52(3):279-81. |
| [11] | Janson J, Laedtke T, Parisi J E,et al. Increased risk of type 2 diabetes in Alzheimer disease[J]. Diabetes,2004, 53(2):474-81. |
| [12] | Díaz B, Serna J, De Pablo F, de la Rosa E J. In vivo regulation of cell death by embryonic (pro)insulin and the insulin receptor during early retinal neurogenesis[J]. Development,2000,127(8):1641-9. |
| [13] | Barber A J, Lieth E, Khin S A, et al. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin[J]. J Clin Investigat,1998,102(4):783-91. |
| [14] | Withers D J, White M. Perspective:the insulin signaling system-a common link in the pathogenesis of type 2 diabetes[J]. Endocrinology, 2000,141(6):1917-21. |
| [15] | Lizcano J M, Alessi D R. The insulin signalling pathway[J]. Curr Biol, 2002,12(7):236-8. |