


2. 中国药科大学中药学院 生药学研究室, 江苏 南京 211198
2. Dept of Pharmacognosy Research, China Pharmaceutical University, Nanjing 211198, China
在所有脑卒中病例中,缺血性脑卒中占87%。尽管多年来人们不断努力寻求脑卒中的防治方法,但其发病率高、死亡率高、致残率高、复发率高的特点仍未能根本改变[1, 2, 3, 4]。对急性缺血性脑卒中的治疗,特别强调超早期(发病1~6 h内)、急性期(发病48 h内)的溶栓,降纤(降解纤维蛋白原),脑血管搭桥及介入疗法治疗[5]。但是,血流再通后造成的脑缺血/再灌注损伤(ischemia-reperfusion injury,IRI)又给缺血性脑卒中的治疗带来新的问题。
高血糖是影响发病的重要因素,研究表明,高血糖患者患缺血性脑卒中的危险程度是血糖正常者的2.40倍,且患病危险性男性高于女性[6]。此外,在高血糖状态下,脑梗死区域血流再通后造成的IRI会更严重[7, 8, 9]。
肢体后适应(limb remote ischemic postconditioning,LRIP)是在机体重要器官(如心、脑)缺血后的再灌注时段,对远端肢体做短时间的缺血/再通血的操作,以减轻重要器官IRI的一种疗法。大量研究表明,LRIP能有效减轻脑IRI[10, 11, 12, 13, 14]。但LRIP能否减轻高血糖状态下的脑IRI尚未知,我们的本项研究运用大鼠急性高血糖模型,验证LRIP对高血糖状态下脑IRI的作用,并初步探讨其机制。
1 材料与方法 1.1 材料① 药品与试剂:葡萄糖测定试剂盒、SOD测定试剂盒、一氧化氮(NO)测定试剂盒,均由南京建成生物工程研究所提供;氯化三苯基四氮唑(2,3,5-triphenyhetrazolium chloride,TTC),美国Sigma公司产品;50%葡萄糖注射液,购自湖南科伦制药有限公司。② 动物:SD大鼠,♂,体质量(260±20) g,清洁级,购于江苏大学,许可证号:SCXK(苏)2013-0011。③ 主要仪器设备:酶标仪(荧光酶标仪Varioskan Flash,Thermo Electron Corporation)。
1.2 方法 1.2.1 分组将30只SD大鼠随机分为3组(n=10):高血糖假手术组(Sham组)、高血糖+缺血/再灌注损伤模型组(IRI组)、高血糖+缺血/再灌注损伤+肢体后适应组(LRIP组)。所有大鼠腹腔注射50%葡萄糖(6 mL·kg-1),造成急性高血糖[15, 16]。将各组大鼠于注射葡萄糖30 min后麻醉,除Sham组外,分离其他两组大鼠右侧颈总动脉,从颈外动脉向颈内动脉插栓线,栓塞大脑远端中动脉(MCAO)。对于Sham组大鼠,仅分离右侧颈总动脉、颈外动脉及颈内动脉而不插线。待大脑远端中动脉栓塞1.5 h后,拔出栓线至颈外、颈内动脉的分叉处,使再灌注。其中,LRIP组于再灌注的同时立刻做LRIP操作,即夹闭大鼠左后肢股动脉5 min/再通5 min(此为1个循环),连续3个循环。各组大鼠于再灌注2 h后(Sham组大鼠同时刻处理)作行为学测定。
1.2.2 本位反射测定将大鼠放置于桌面上,操作者一手提大鼠尾巴,另一只手轻推大鼠的肩部,将其横向移动20 cm,之后向相反的方向重复该测试。正常大鼠反应为左上肢支撑或抓桌面,IRI组大鼠表现为左上肢力度减弱或无反应。评分0~2分,得分越多,功能损害越严重。0分,大鼠抵抗力较大,并且在推动过程中不断用上肢支撑或抓桌面;1分,左上肢对抗力度减小;2分,左上肢无对抗,既不支撑也不抓桌面[17]。
1.2.3 前肢放置测定该测定用大鼠触须诱导的前肢放置情况来评价。操作者手持大鼠躯体,使大鼠的前肢能自由运动,轻轻的上下晃动大鼠,使大鼠肌肉充分放松。操作者将大鼠放置在桌边,使大鼠的胡须触到桌面的边缘,正常的大鼠会将两侧的前肢迅速放到桌面上。单侧大脑损伤的大鼠,损伤大脑同侧的前肢仍保持较好的反应能力。每只大鼠测定10次,记录前肢放置失败的次数[18]。
1.2.4 尾部悬空测定操作者提大鼠尾部,使大鼠头部距桌面5~10 cm,一侧大脑损伤的大鼠会将身体迅速转向另一侧。记录大鼠扭转身体角度超过90°的次数,重复20次,记录有效抬头的百分率[17]。
1.2.5 血清中NO浓度测定将测定过本位反射后的各组大鼠摘眼球取血,离心分离血清,用试剂盒测定血清中NO浓度。
1.2.6 血清中SOD活力测定将测定过本位反射后的各组大鼠摘眼球取血,离心分离血清,用试剂盒测定血清中SOD活力。
1.2.7 脑梗死面积测定将各组大鼠取全脑,-20 ℃冷冻15 min后连续切出5片冠状切片,每片厚度约为 2 mm,置于1% TTC 溶液中,37 ℃避光孵育 20 min,每5 min翻动一次,之后用PBS溶液清洗3次,4% 甲醛溶液固定24 h后拍照,用图像分析软件计算梗死面积。脑梗死面积/%=(非缺血半球的面积-缺血半球未梗死部分的面积)/ 非缺血半球的面积×100%。以梗死面积百分比反映缺血后脑损伤的严重程度,统计结果进行组间比较[14, 19]。
1.2.8 统计学处理 实验结果以 表示,均数间比较采用单因素方差分析(One-way ANOVA)。
表示,均数间比较采用单因素方差分析(One-way ANOVA)。
高血糖组大鼠在手术前30 min腹腔注射50%葡萄糖6 mL·kg-1,造成急性高血糖。在注射葡萄糖前(0 h),以及注射葡萄糖后0.5、1.5、3、4 h尾尖取血,离心分离血清。测定血糖值,结果表明,急性高血糖模型造模成功(Fig1)。

|
Fig 1
Blood glucose values of acute hyperglycemia rat ( ,n=6~8)
The glucose value in serum was detected by blood glucose kits, the blood sugar levels at 0, 0.5, 3 and 4 h after intraperitoneal injections of glucose were shown. ,n=6~8)
The glucose value in serum was detected by blood glucose kits, the blood sugar levels at 0, 0.5, 3 and 4 h after intraperitoneal injections of glucose were shown.
|
实验结果显示,与Sham组大鼠相比,Control组(IRI组)大鼠前肢抵抗能力减弱,前肢支撑及抓桌面力度均降低甚至消失。LRIP对急性高血糖状态下脑IRI大鼠本位反射无改善作用(Fig2)。

|
Fig 2
Postural reflex test ( ,n=6~8)
Scores significantly increased after brain IRI. LRIP could not significantly improve those functions. ##P<0.01 vs control group. ,n=6~8)
Scores significantly increased after brain IRI. LRIP could not significantly improve those functions. ##P<0.01 vs control group.
|
与Sham组相比,Control组大鼠胡须触碰到桌面后,左前肢抓桌面的次数明显减少。LRIP操作对脑IRI大鼠的前肢放置无改善作用(Fig3)。

|
Fig 3
Vibrissa test ( ,n=6~8)
All animals of sham group showed normal forelimb placing. Unsuccessful placing was found of the control group after brain IRI. LRIP could not significantly improve forelimb placing of those rats endured brain IRI. ##P<0.01 vs control group. ,n=6~8)
All animals of sham group showed normal forelimb placing. Unsuccessful placing was found of the control group after brain IRI. LRIP could not significantly improve forelimb placing of those rats endured brain IRI. ##P<0.01 vs control group.
|
Control组与Sham组相比,大鼠向左侧弯曲身体的次数明显增多(P<0.01)。LRIP操作能明显减少脑IRI大鼠左侧弯曲身体的次数(P<0.05,见Fig4)。
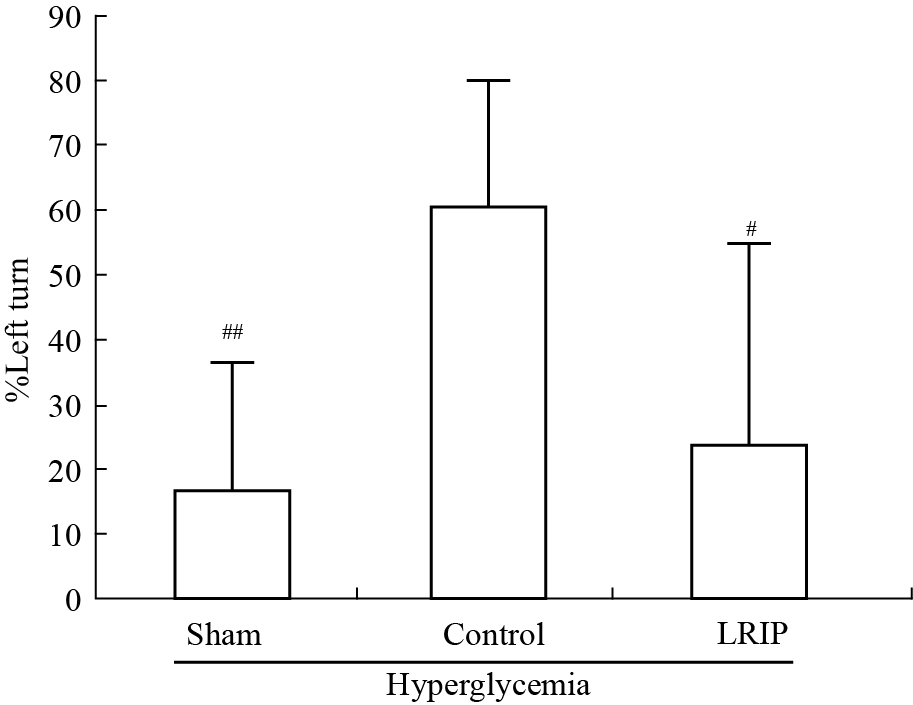
|
Fig 4
Tail hang test ( ,n=6~8)
The number of large left turns increased in brain IRI group. LRIP could ameliorate this behavior.#P<0.05, ##P<0.01 vs control group. ,n=6~8)
The number of large left turns increased in brain IRI group. LRIP could ameliorate this behavior.#P<0.05, ##P<0.01 vs control group.
|
与Sham组相比,Control组大鼠的脑梗死面积增大,差异具有显著性(P<0.01)。LRIP能减小脑IRI大鼠的脑梗死面积(见 Fig5)。
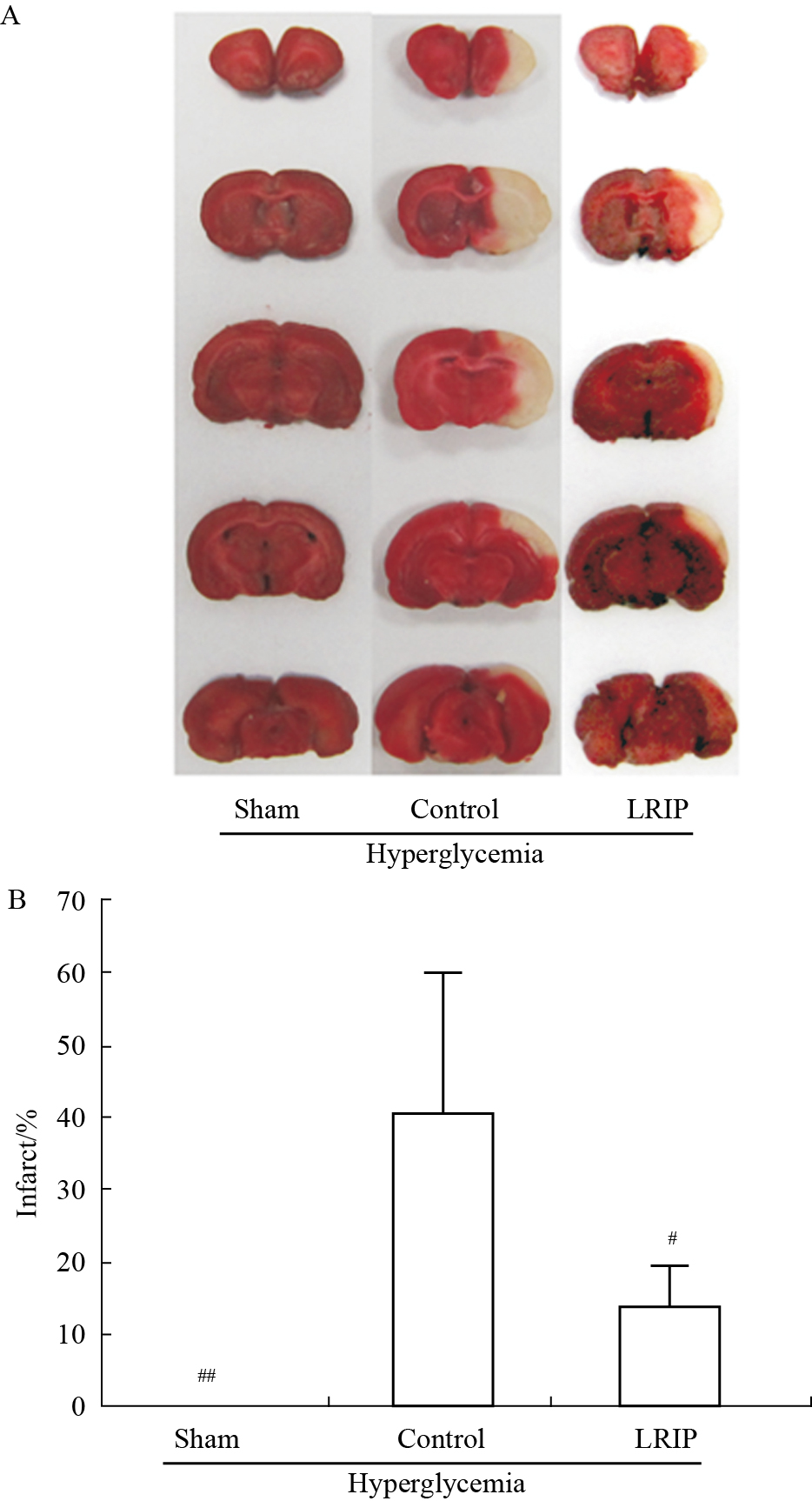
|
Fig 5
Representative infarcts stained by TTC from each group ( )
A:Rat brains were cut into five slices and stained by TTC; B: Bar graphs show the average infarct size of the five slices. #P<0.05, ##P<0.01 vs control group (n=6~8). )
A:Rat brains were cut into five slices and stained by TTC; B: Bar graphs show the average infarct size of the five slices. #P<0.05, ##P<0.01 vs control group (n=6~8).
|
LRIP能升高脑IRI模型大鼠血清中的SOD活力,与Control组相比差异具有显著性(P<0.05)。见Fig6。

|
Fig 6
SOD activity in rat serum ( ,n=6~8)
*P<0.05 vs control group. ,n=6~8)
*P<0.05 vs control group.
|
Control组大鼠血清中NO浓度增高,与Sham组相比差异具有显著性(P<0.01)。经过LRIP操作后,大鼠血清中NO浓度升高,与Control组相比差异具有显著性(P<0.01)。见Fig7。
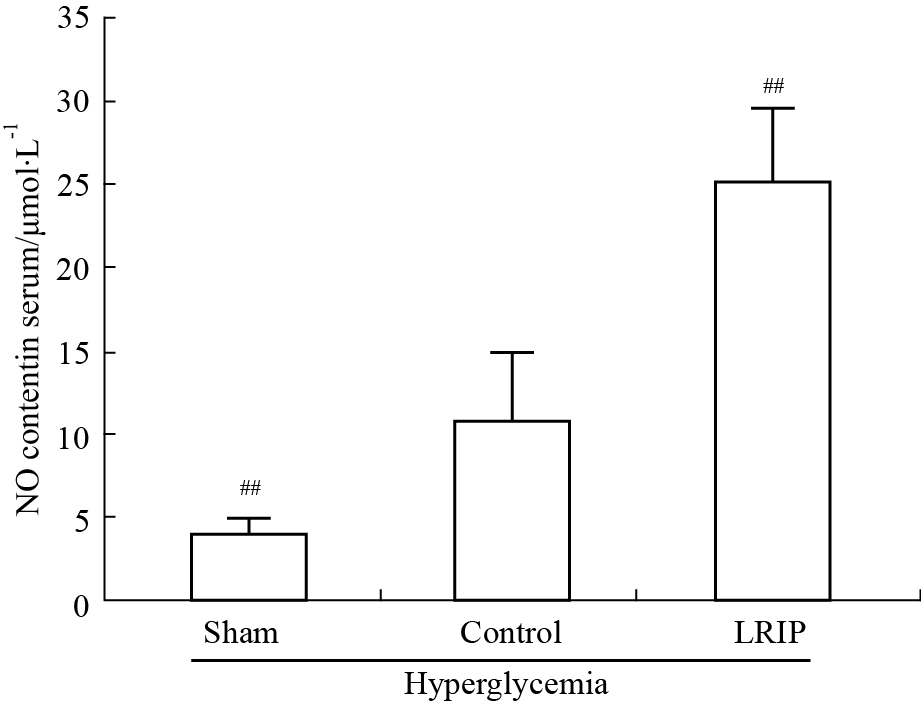
|
Fig 7
NO concentration in rat serum ( ,n=6~8)
##P<0.01 vs control group. ,n=6~8)
##P<0.01 vs control group.
|
高血糖是影响缺血性脑卒中发病的重要因素,在高血糖状态下,机体患缺血性脑卒中危险程度增加,且后继的IRI亦会加重[7]。高血糖加重脑IRI可能与兴奋性氨基酸中毒、自由基生成、钙超载、血脑屏障破坏、炎性因子的损害以及细胞凋亡等因素相关[20, 21, 22]。 我们之前的研究表明,LRIP能有效减轻脑IRI[14],但LRIP是否能减轻高糖状态下的脑IRI尚属未知。本研究结果表明,LRIP能改善急性高血糖状态下脑IRI大鼠的尾部悬空测定评分,减小模型大鼠的脑梗死面积,升高IRI模型大鼠血清中的NO浓度及SOD活力。 在高血糖状态下,LRIP升高血清中SOD活力可增加自由基清除,减少后者造成的损伤[23, 24]。NO浓度升高可以扩张血管,改善IRI造成的“无复流现象”[25, 26]。但过高浓度的NO也可能会导致渗出增多,水肿加重,具体有待进一步研究证实。 综上,本研究结果表明,LRIP能减轻高血糖状态下大鼠的脑IRI损伤,该作用部分通过升高血清SOD活力,增加自由基清除,以及提升血清中NO浓度以增加侧枝循环实现。我们进一步的研究将关注LRIP减轻高血糖状态下脑IRI的具体机制。 (致谢:该实验在中国药科大学中药药理教研室完成。)
| [1] | Jia Q, Liu LP, Wang YJ. Stroke in china[J]. Clin Exp Pharmacol Physiol, 2010, 37:259-64. |
| [2] | Zhao D, Liu J, Wang W, et al. Epidemiological transition of stroke in China:twenty-one-year observational study from the Sino-MONICA-Beijing Project[J]. Stroke, 2008, 39(6):1668-74. |
| [3] | Donnan G A, Fisher M, Macleod M, Davis S M. Stroke[J]. Lancet, 2008, 371(9624):1612-23. |
| [4] | Sidney S, Rosamond W D, Howard V J, Luepker R V. The "heart disease and stroke statistics-2013 update" and the need for a national cardiovascular surveillance system[J]. Circulation, 2013, 127(1):21-3. |
| [5] | 罗建宁. 急性脑梗死治疗新进展[J]. 实用心脑肺血管病杂志, 2010(10):1546-7. Luo J N. New progress in the treatment of acute cerebral infarction[J]. Pract J Card Cerebral Pulm Vascul Dis, 2010(10):1546-7. |
| [6] | 姚立岩, 杨 勇, 孟丽莉, 等. 脑梗塞病因探讨[J]. 牡丹江医学院学报, 2009(5):11-4. Yao L Y, Yang Y, Meng L L, et al. The research of related factors of cerebral infarction[J]. J Mudanjiang Med Univ, 2009(5):11-4. |
| [7] | Capes S E, Hunt D, Malmberg K, et al.Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients:a systematic overview[J]. Stroke, 2001, 32(10):2426-32. |
| [8] | 韩江全,胡泳涛,林冬融,等. 内质网应激结合线粒体在高血糖加重脑缺血/再灌注损伤中的作用[J]. 中风与神经疾病杂志, 2012, 29(7):593-6. Han J Q, Hu Y T, Lin D R, et al. Unification of endoplasmic reticulum and mitochondrium in cerebral ischemia-reperfusion injury increased by hyperglycemia[J]. J Apopl Nerv Dis, 2012, 29(7):593-6. |
| [9] | Asano G, Takashi E, Ishiwata T, et al. Pathogenesis and protection of ischemia and reperfusion injury in myocardium[J]. J Nippon Med Sch, 2003, 70(5):384-92. |
| [10] | Ren C, Yan Z, Wei D, et al. Limb remote ischemic postconditioning protects against focal ischemia in rats[J]. Brain Res, 2009, 1288:88-94. |
| [11] | Zhou Y, Fathali N, Lekic T, et al. Remote limb ischemic postconditioning protects against neonatal hypoxic-ischemic brain injury in rat pups by the opioid receptor/Akt pathway[J]. Stroke, 2011, 42(2):439-44. |
| [12] | Qi Z F, Luo Y M, Liu X R, et al. AKT/GSK3beta-dependent autophagy contributes to the neuroprotection of limb remote ischemic postconditioning in the transient cerebral ischemic rat model[J]. CNS Neurosci Ther, 2012:965-73. |
| [13] | Sun J, Tong L, Luan Q, et al. Protective effect of delayed remote limb ischemic postconditioning:role of mitochondrial K(ATP) channels in a rat model of focal cerebral ischemic reperfusion injury[J]. J Cereb Blood Flow Metab, 2012, 32(5):851-9. |
| [14] | Chen G L, Yang J, Lu G X, et al. Limb remote ischemic post-conditioning reduces brain reperfusion injury by reversing eNOS uncoupling[J]. Indian J Exp Biol, 2014, 52(6):597-605. |
| [15] | 陈宁红, 王书礼, 王 钰. 大鼠高血糖-局灶性脑缺血/再灌注损伤模型建立的初步研究[J]. 药学与临床研究, 2010(5):420-4. Chen N H, Wang S L, Wang Y. Evaluation of focal cerebral ischemia reperfusion injury model under hyperglycemia in rats[J]. Pharm Clin Res, 2010(5):420-4. |
| [16] | Behrends M, Martinez-Palli G, Niemann C U, et al. Acute hyperglycemia worsens hepatic ischemia/reperfusion injury in rats[J]. J Gastrointest Surg,2010, 14(3):528-35. |
| [17] | Zhao H,Shimohata T,Wang J Q,et al. Akt contributes to neuroprotection by hypothermia against cerebral ischemia in rats[J]. J Neurosci,2005, 25(42):9794-806 |
| [18] | Schallert T, Fleming S M, Leasure J L, et al. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury[J]. Neuropharmacology, 2000, 39(5):777-87. |
| [19] | Ren C,Yan Z,Wei D,et al. Limb remote ischemic postconditioning protects against focal ischemia in rats[J]. Brain Res,2009, 1288:88-94 |
| [20] | Harada S, Fujita W H, Shichi K, Tokuyama S. The development of glucose intolerance after focal cerebral ischemia participates in subsequent neuronal damage[J]. Brain Res, 2009, 1279:174-81. |
| [21] | Serra-Perez A, Verdaguer E, Planas A M, Santalucia T. Glucose promotes caspase-dependent delayed cell death after a transient episode of oxygen and glucose deprivation in SH-SY5Y cells[J]. J Neurochem, 2008, 106(3):1237-47. |
| [22] | Gadau S, Lepore G, Zedda M, et al. D-glucose induces microtubular changes in C1300 neuroblastoma cell line through the incorporation of 3-nitro-L-tyrosine into tubulin[J]. Arch Ital Biol, 2008, 146(2):107-17. |
| [23] | 陈刚领, 郑建普, 李亚娟, 卞 卡. H2O2氧化损伤血管内皮模型的构建及超氧化物歧化酶对损伤的逆转作用[J]. 中国药理学通报, 2009, 25(7):884-7. Chen G L, Zheng J P, Li Y J, Bian K. The construction of H2O2 induced vascular endothelial Damage model and reversal effect of SOD to the endothelial function[J]. Chin Pharmacol Bull, 2009, 25(7):884-7. |
| [24] | 陈刚领, 刘 俊, 卞 卡. 蛋白质特殊氧化与疾病关系的研究进展[J].中国药理学通报, 2009, 25(5):561-5. Chen G L, Liu J, Bian K. Research progress on the relationship between protein specific oxidation and diseases[J]. Chin Pharmacol Bull, 2009, 25 (5):561-5. |
| [25] | Bai J, Lyden P D. Revisiting cerebral postischemic reperfusion injury:new insights in understanding reperfusion failure, hemorrhage, and edema[J]. Int J Stroke, 2015, 10(2):143-52. |
| [26] | Zwagerman N, Sprague S, Davis M D, et al. Pre-ischemic exercise preserves cerebral blood flow during reperfusion in stroke[J]. Neurol Res, 2010, 32(5):523-9. |
