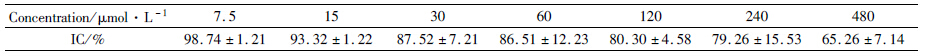李俊(1960-),男,博士,教授,博士生导师,研究方向:临床药理学、抗炎免疫药理学、药代动力学,E-mail:lj@ahmu.edu.cn
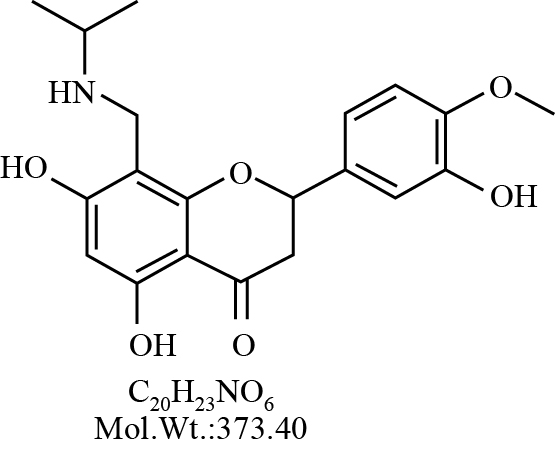
橙皮素(hesperetin)为芸香科植物柑橘属植物果实提取物,是广泛存在于柚子和橙子中二氢黄酮类化合物,具有广泛的药理学特性,包括抗炎、抗氧化、抗肿瘤形成与生长等活性[1, 2, 3]。橙皮素口服以后生物利用度较好,但是半衰期较短,口服给药以后体内消除较快,为了维持有效血药浓度,需要频繁给药,这一缺点限制了其在临床上的应用[4]。为了克服这一缺点,本课题组通过化学合成的方法,合成了一系列的橙皮素衍生物并对其药理活性进行了筛选。本课题组前期研究发现,7,3′-二甲氧基橙皮素(7,3′ -dimethoxy hesperetin,DMHP)具有较强抗炎活性,对AA大鼠继发性炎症具有良好的治疗作用[5, 6, 7]。前期研究还发现8-异丙胺亚甲基橙皮素(IPHP,见Fig1),在体外具有良好的抗炎活性,对于由LPS刺激RAW264.7细胞产生的TNF-α和IL-6具有明显的抑制作用。该实验利用Caco-2细胞模型来模拟小肠上皮细胞对IPHP的吸收情况,通过对Caco-2细胞膜上转运蛋白,如P糖蛋白(P-gp)、多药耐药蛋白(MRP2)的研究来探讨其吸收及外排机制,为之后的药理学研究提供依据,为新型药物单体的合成提供信息指导,为将来的临床前研究提供资料。
|
| Fig 1 Structure of IPHP 3′,5,7-trihydroxy-8-isopropylaminomethyl-4′-methoxyflavanone (IPHP) |
Caco-2细胞株购于武汉博士德公司,传代数为30代;IMDM(博士德公司,批号:04D24C59),胰蛋白酶(博士德公司,批号:03C28C15);DMSO,美国Gibco公司; Hanks液(碧云天);IPHP(本实验室合成,纯度>95%);橙皮素对照品(西安小草植物科技有限责任公司,纯度>98%,批号: XC1009018);橙皮苷标准品(中国药品生物制品检定所,纯度>98%,批号:110721-200613);MK-571和丙磺舒(美国Sigma公司);维拉帕米(NICPBP,批号:100223200102);甲醇为色谱纯;水为双蒸水,其余所有试剂为分析纯。
1.2 仪器LC-20A四元低压梯度液相色谱仪(日本岛津公司); XW-80A微型旋涡混合仪(上海沪西分析仪器厂有限公司);Neofuge23R台式高速冷冻离心机(力康发展有限公司);DZE-6050型真空干燥箱(上海新苗医疗器械制造有限公司);SHA-C水浴恒温振荡箱器(江苏金坛亿通电子有限公司);酶标仪,荷兰雷勃公司产品;悬挂式培养皿(Millicell-CPI);DDs-12A数字电导仪(Millicell-ERS)(美国Millipore公司);SW-CJ-IF型超净台,江苏苏净集团苏州安泰空气技术有限公司产品;NAPCO-6100型细胞培养箱,美国SHELLAB公司产品;高速离心机(珠海黑马公司)。
1.3 Caco-2细胞培养及其单层的制备Caco-2细胞接种在12孔Millicell-CPI 培养板上(底面积: 1.13 cm2,微孔: 3 μm),种植密度为 1×105 cells·cm-2,在A侧和 B 侧分别加0.6 mL及1.2 mL 的培养基放入37 ℃孵箱中孵育。每隔1天换1次液,培养约 3 周达到汇合、分化形成单细胞层。Caco-2细胞生长、汇合、分化在Millicell CPI膜上,细胞单层的紧密性与完整性是药物转运实验的基础。用显微镜下观察细胞的生长形态,同时每次换液时需要用DDs-12A数字电导仪测量跨膜电阻值(transepithelial electrical resistance,TEER),当TEER>350 Ω·cm2时细胞可用于实验。
1.4 MTT实验Caco-2细胞按照一定的密度接种于96孔板中,放入37℃孵箱中培养24 h后,弃去培养基,分别加入IPHP浓度为7.5、15、30、60、120、240、480 μmol·L-1 的200 μL的培养液,37 ℃孵育24 h后,每孔再加入20 μL MTT溶液(5 g·L-1,即0.5% MTT),继续培养4 h,终止培养,小心吸去孔内培养液。每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值(A),计算细胞存活率(IC): IC/%=(试验组A均值-调零空A均值)/(对照组A均值-调零空A均值)×100%。选取细胞存活率在80%以上的药物浓度作为实验所需的安全浓度。
1.5 转运实验Caco-2细胞在Millicell-CPI培养板上形成紧密完整的单细胞层后,各孔贴侧壁加入37 ℃的 Hanks液,荡洗细胞 3 次。吸干各孔内Hanks液,在不破坏单细胞的基础上祛除细胞表面的杂质,之后用Hanks液于37 ℃孵育30 min。将IPHP溶于DMSO制备成 240 mmol·L-1的溶液,用 Hanks 液稀释至7.5、15、30、60、120 μmol·L-1的IPHP溶液。其中DMSO 的浓度小于0.1%将不会影响单细胞层的完整性。孵育结束以后,在单层细胞膜内的一侧加入含药Hanks溶液,另一侧加入空白Hanks 液,空白对照孔在两侧均加 Hanks 液。当研究药物分子从 A侧向 B侧方向转运时,A侧加0.6 mL含IPHP 的Hanks转运液,B 侧加入1.2 mL Hanks 液,当研究药物分子从 B 侧向 A侧方向转运时,A侧加0.6 mL Hanks 液,B侧加1.2 mL含IPHP的Hanks液,分别于0、30、60 、90和 120 min 时从 A侧及 B 侧取转运液置于1.5 mL离心管中,放入-20 ℃冰箱中保存待测。为了探究pH对于IPHP转运吸收的影响,将含IPHP(120 μmol·L-1)的Hanks液分别在pH 5.5或 pH 9.0 条件下进行吸收转运实验。实验过程同上所述。探究温度是否对IPHP的吸收有影响,将含IPHP(120 μmol·L-1)的Hanks分别在4℃和37℃情况下按上述实验方法进行。
IPHP在Caco-2细胞的吸收转运是否涉及到某些转运蛋白的介导,需要我们进一步研究。将P-gp抑制剂维拉帕米(50 μmol·L-1),MRP2抑制剂MK-571(50 μmol·L-1)和丙磺舒(1 mmol·L-1)分别溶于Hanks液中。转运实验之前,将Caco-2细胞单层模型用含有抑制剂的Hanks液于37 ℃孵育30 min,之后按照上述实验方法进行转运实验。
1.6 样品分析本实验采用高效液相色谱法分析样品,色谱柱:Phenomenex Luna C18柱(4.6 mm×250 mm,5 μm) ; 流动相: 乙腈-0.5%甲酸梯度洗脱(0~5 min,76 ∶ 24; 5~15 min,76 ∶ 24~30 ∶ 70;15~16 min,30 ∶ 70~76 ∶ 24; 16~24 min,76 ∶ 24); 检测波长: 288 nm; 流速: 1.0 mL/min; 柱温:40℃; 进样量:20 μL。
1.7 数据分析 药物分子透过单细胞层的表观渗透系数:表观渗透系数计算公式为:Papp= (dQ/dt)/A×C0,其中dQ/dt是单位时间内药物的转运量(nmol·s-1),A 是聚碳酯膜的表面积,C0为供给室中待测物的初始浓度。外排率计算公式为:ER= Papp(BL-AP)/Papp(AP-BL)。所有数据以 表示,数据采用SPSS 16.0软件进行统计学处理,组间比较采用One-Way ANOVA检验。
表示,数据采用SPSS 16.0软件进行统计学处理,组间比较采用One-Way ANOVA检验。
在显微镜下观察Caco-2细胞形态学的完整性,可观察到Caco-2细胞形成致密的紧密连接,细胞融合成连续的单层。用DDS-12A数字电导仪测量跨膜电阻(transepithelial electrical resistance,TEER),检测到TEER 均大于350 Ω·cm2。实验结果说明Caco-2细胞已经形成了完整的单细胞层,可以用于药物跨膜转运实验。
2.2 MTT实验结果Caco-2细胞在IPHP浓度为7.5、15、30、60、120、240、480 μmol·L-1在24 h的存活率分别为:98.74%、93.32%、87.52%、86.51%、80.30%、79.26%、65.26%。由Tab1结果可知,当IPHP的药物浓度小于120 μmol·L-1时,细胞的存活率大于80%。因此,本实验所采用的药物浓度低于120 μmol·L-1,此时药物对细胞的作用在安全浓度范围内。
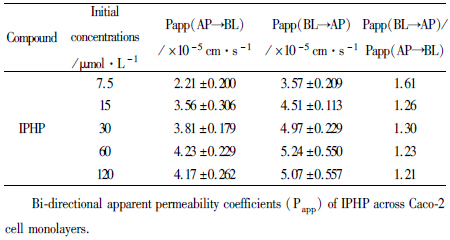
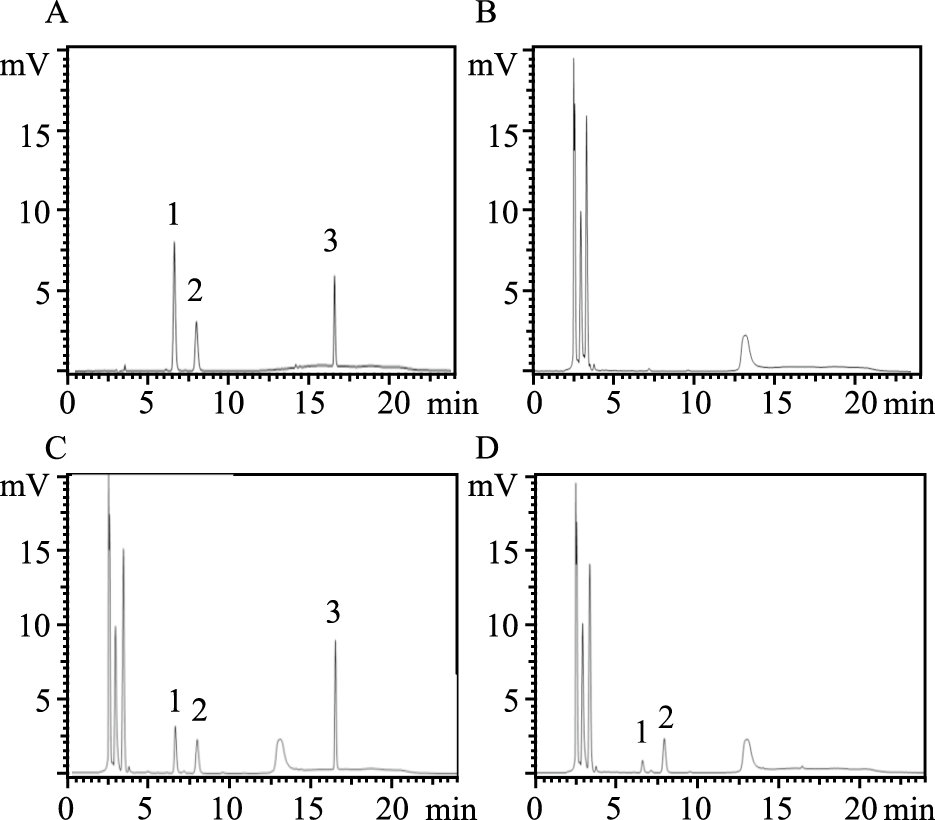
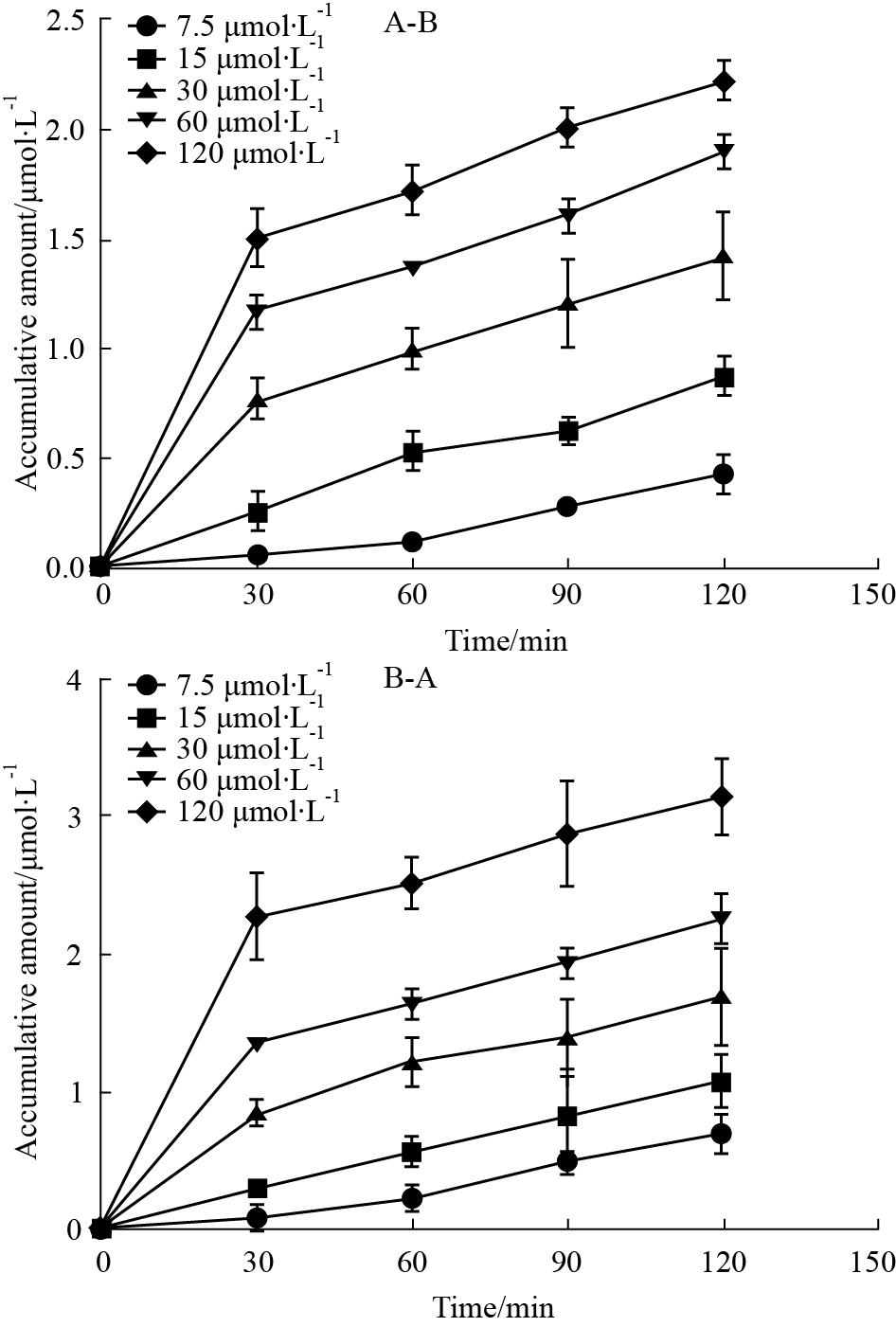
采用高效液相色谱法检测标准品、空白Hanks液、空白Hanks加橙皮素,IPHP和内标橙皮苷、IPHP在Caco-2细胞转运样品的色谱图见 Fig2,空白Hanks不干扰测定。高效液相色谱法测定不同时间点不同浓度下单细胞层两侧培养液中IPHP的浓度,结果见Fig3。随着药物浓度的增加,Caco-2细胞对IPHP的摄取量逐渐增加,并且外排率ER分别为:1.61、1.26、1.30、1.23、1.21 。结果见 Tab2。
|
| Fig 2 HPLC chromatograms of standard hesperidin, IPHP and hesperitin (A), blank Hanks (B), blank Hanks sample spiked with hesperedin , IPHP and hesperetin (C), Hanks sample obtained 30 min after transport of IPHP from A to B side (D). 1: Hesperidin;2: IPHP;3: Hesperitin |
|
Fig 3
Cumulative amount-time curve of IPHP in Caco-2 cell model (A→B and B→A, ,n=3) ,n=3)
|
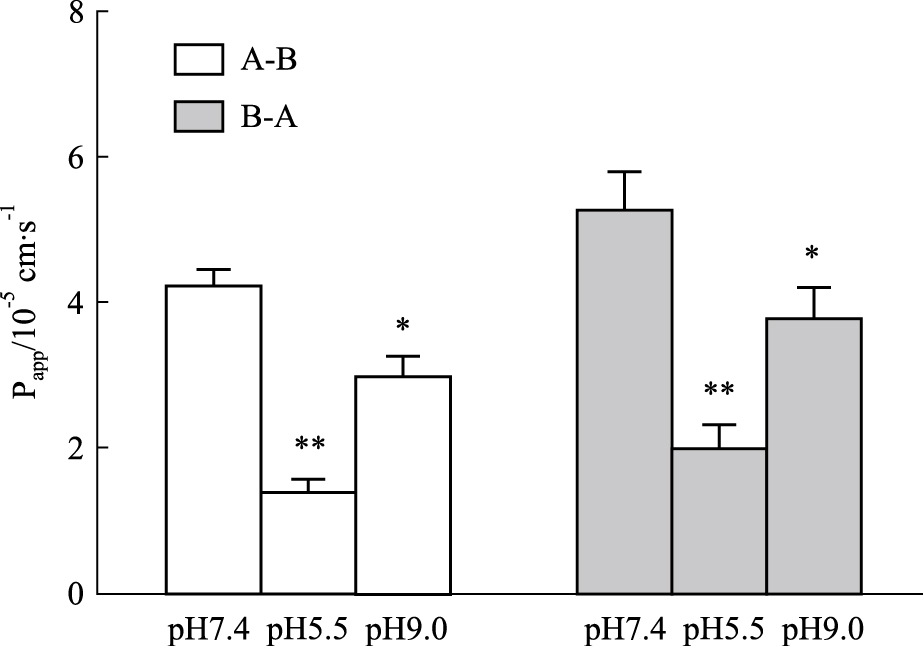
pH对药物的吸收的结果如Fig4所示,pH 5、pH 7.4和pH 9的Papp(AP-BL)(×10-5)和Papp(BL-AP)(×10-5)分别为:(1.47±0.111) cm·s-1和(1.98±0.354) cm·s-1;(4.23±0.229) cm·s-1和(5.24±0.550) cm·s-1 ;(3.01±0.262) cm·s-1和(3.77±0.412) cm·s-1。在pH 7.4的环境下药物的转运量明显大于pH 5(P<0.01)和pH 9 (P<0.05)。结果表明,IPHP在中性环境中吸收情况要优于在酸性和碱性条件下,这可能与IPHP的结构特点有关,其在中性环境中吸收更好。
|
Fig 4
Effect of pH on Papp of IPHP across Caco-2 cell monolayers ( ,n=3)
*P<0.05, **P<0.01 vs Papp of IPHP at pH 7.4. ,n=3)
*P<0.05, **P<0.01 vs Papp of IPHP at pH 7.4.
|
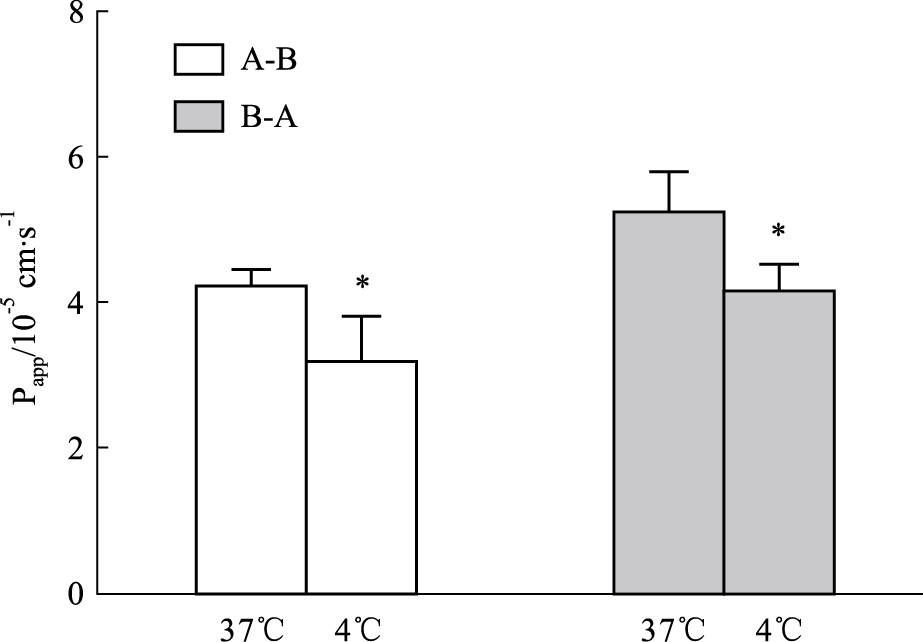
温度主要影响ATP依赖性转运蛋白的活性,可能对IPHP在Caco-2细胞上的转运产生一定的影响。因此本实验将探讨IPHP在4 ℃和37 ℃温度条件下的吸收转运情况,结果见Fig5。由实验结果可以看出,37 ℃条件下IPHP的Papp (AP-BL)(×10-5)和Papp(BL-AP)(×10-5)分别为[4.23±0.229] cm·s-1和(5.24±0.550) cm·s-1,而4 ℃条件下其Papp(AP-BL)(×10-5)和Papp (BL-AP)(×10-5)分别为(3.21±0.626) cm·s-1和(4.17 ± 0.354) cm·s-1。37 ℃环境下的AP到BL侧和BL到AP侧的渗透率均高于4 ℃环境(P<0.05),说明IPHP在Caco-2细胞上的转运受温度的影响,可能与相关ATP依赖性转运蛋白有关。
|
Fig 5
Effect of pH on Papp of IPHP across Caco-2 cell monolayers ( ,n=3)
*P<0.05, **P<0.01 vs Papp of IPHP at pH 7.4. ,n=3)
*P<0.05, **P<0.01 vs Papp of IPHP at pH 7.4.
|
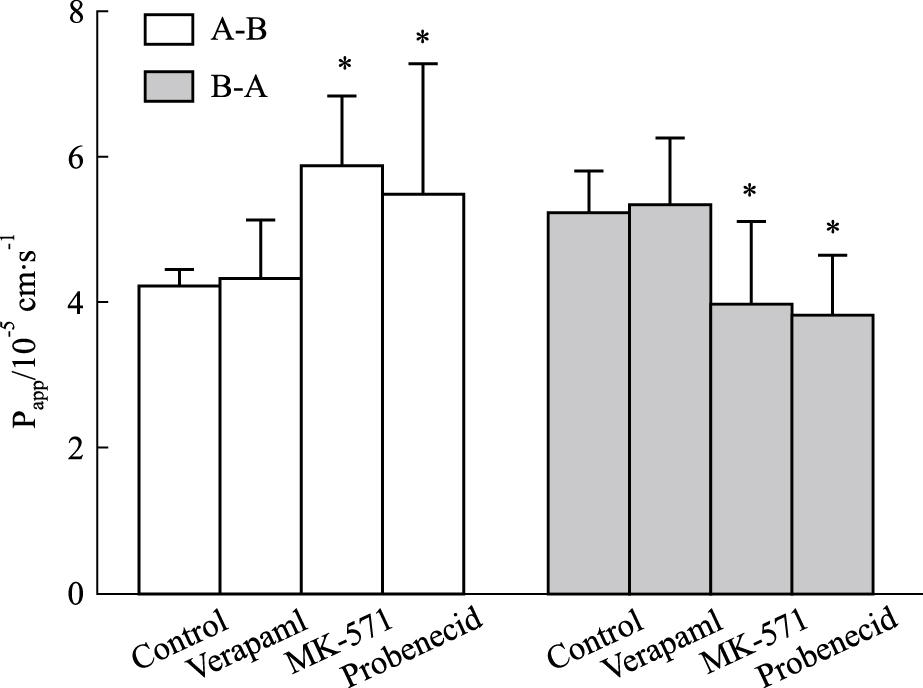
我们为了探讨转运蛋白的作用,加入了一系列的转运蛋白抑制剂,如P-gp抑制剂维拉帕米、MRP2抑制剂MK-571和丙磺舒,来观察转运蛋白对IPHP吸收转运的影响,结果见Fig6。实验结果表明,当加入P-gp抑制剂维拉帕米时,药物渗透系数Papp (AP-BL) (×10-5)和Papp (BL-AP) (×10-5)为(4.33±0.79) cm·s-1和(5.32 ± 0.94) cm·s-1,相较于正常细 胞组未发生明显变化(P>0.05)。而加入MRP2抑
|
Fig 6
Effect of transporter inhibitor on Papp of IPHP across Caco-2 cell monolayers ( ,n=3)
*P<0.05 vs the control. ,n=3)
*P<0.05 vs the control.
|
制剂MK-571和丙磺舒的组药物渗透率Papp(AP-BL)(×10-5)和Papp(BL-AP)(×10-5) 分别为(5.87±0.96) cm·s-1和(3.97±1.12) cm·s-1;(5.45± 1.82) cm·s-1和(3.79 ± 0.87) cm·s-1,由实验数据可以看出,Papp(BL-AP) (×10-5)值均比Papp (AP-BL) (×10-5)值大,且相较于正常组,外排量明显降低(P<0.05),吸收量明显增加(P<0.05)。说明加入抑制剂后,某些转运蛋白受到了一定程度的抑制,导致外排量下降,吸收量增加。实验结果表明IPHP在Caco-2细胞上的转运可能与MRP2有关,而与P-gp无关。
3 讨论Caco-2细胞是人克隆结肠腺癌细胞,在适宜的培养条件下,将Caco-2细胞种在多孔的可渗透性聚碳酸酯膜上,经过21 d的融合分化可形成连续的单层。Caco-2细胞与人小肠上皮细胞在形态学上相似,具有相同的细胞极性和紧密连接;此外,Caco-2细胞含有与小肠刷状缘上皮相似的转运系统,例如外排蛋白P-gp、MRP2等[8, 9, 10, 11]。因此,Caco-2细胞被广泛应用于药物的跨膜转运实验,用以预测药物在人小肠的吸收的情况,较之体内的动物实验具有简单、方便、经济等特点,更适合于药物的高通量筛选。
本实验采用Caco-2单层细胞模型,模拟IPHP在肠道的吸收情况,探讨IPHP在肠道吸收的机制。MTT实验筛选出合适的用于转运的药物浓度,在安全浓度范围内进行转运实验,研究发现,IPHP在Caco-2细胞上的转运具有浓度依赖性,且随着浓度的增加其转运量逐渐增加,说明IPHP的吸收可能以被动转运为主。IPHP不同浓度从A侧到B侧的渗透系数Papp(AP-BL) (×10-5)分别为:(2.21±0.200) cm·s-1,(3.56±0.306) cm·s-1,(3.81±0.179) cm·s-1,(4.23±0.229) cm·s-1,(4.17±0.262) cm·s-1,B侧到A侧的渗透系数Papp(BL-AP) (×10-5)分别为:(3.57±0.209) cm·s-1,(4.51±0.113) cm·s-1,(4.97±0.229) cm·s-1,(5.24±0.550) cm·s-1,(5.07±0.557) cm·s-1,外排率分别为:1.61,1.26,1.30,1.23,1.21。在Caco-2 细胞模型中药物分子的表观渗透系数与口服吸收相关联。有文献报道[12, 13],当药物的表观渗透系数大于1×10-6 cm·s-1时,其表现出良好的吸收性。吸收较好药物的表观渗透系数在0. 1~ 1×10-6 cm·s-1,而吸收差的药物,其表观渗透系数小于1×10-7 cm·s-1 。实验结果表明,药物IPHP的吸收良好,ER在0.5~1.5之间,差异不大,进一步说明IPHP的转运方式主要是被动转运。pH 7.4条件下IPHP的转运量高于pH 5.0和pH 9.0,说明药物在中性环境中的更容易被吸收,这可能与药物IPHP的中性结构特点有关,IPHP结构中4位羰基与5位羟基易形成氢键,7位羟基和氨基容易形成氢键,3′位羟基与甲氧基的氧在空间结构上也容易形成5元环氢键,这些氢键都是分子内氢键,同时5,6元环比较稳定,使得分子趋于稳定,从而可能表现出中性的性质。药物在中性状态下溶解更加,更容易被吸收。IPHP在4℃时的转运量相较于37℃明显减少,说明温度对IPHP的吸收是有影响的,可能与相关ATP依赖性转运蛋白有关。加入了P-gp抑制剂维拉帕米后,IPHP的转运量相较于正常组并无明显差异,说明P-gp并未参与IPHP的转运,而加入了MRP2抑制剂MK-571和丙磺舒的两组,Papp(BL-AP)值相较于正常组明显降低,Papp(AP-BL)值明显增加。说明MRP2可能参与了IPHP在Caco-2细胞上的转运,但是MK-571和丙磺舒并非专一性的MRP2抑制剂,其对BCRP等外排蛋白也有抑制作用,因此我们认为MRP2可能参与了IPHP的外排。
综上所述,IPHP在Caco-2细胞模型上以被动转运的吸收方式为主,同时可能有MRP2等相关外排蛋白介导其转运,且具有较好的吸收特性。
| [1] | Gam K, hiraki T, Matsuura N, et al. Mechanism of peroxisome proliferator-activated receptor gamma (PPARγ) transactivation by hesperetin glucuronides is distinct from that by a thiazolidine-2,4-dione agent[J]. Chem Pharm Bull (Tokyo), 2014,62(5):491-3. |
| [2] | Srirangam R, Majumdar S. Passive asymmetric transport of hesperetin across isolated rabbit cornea[J]. Int J Pharm, 2012,394 (1-2):60-7. |
| [3] | 汪纪仓,朱华丽,刘凤军.橙皮素对铅致大鼠脑组织氧化损伤的保护效应[J].动物医学进展, 2012, 33(9):43-4. Wang J C, Zhu H L, Li F J. Protective effect of hesperetin on lead-induced oxidative Damages in rat brain[J]. Prog Vet Med, 2012,33(9):43-4. |
| [4] | 秦 娣,李 俊,李 荣,等.5,7,3'-三乙酰橙皮素在大鼠体内的药代动力学研究[J].安徽医科大学学报,2012,47(8):940-3. Qin D, Li J, Li R, et al. Pharmacokinetics of 5,7,3'-triacetyl hesperetin in rats[J]. Acta Univ Med Anhui, 2012,47(8):940-3. |
| [5] | 彭 磊,张 茜,李 荣,等.橙皮苷衍生物抗炎活性的筛选研究[J].安徽医科大学学报,2011,46(1):36-9. Peng L, Zhang Q, Li R, et al. Anti-inflammatory activity screening of hesperidin derivatives[J]. Acta Univ Med Anhui, 2011,46(1):36-9. |
| [6] | Li R, Cai L, Xie X F, et al. 7,3'-dimethoxy hesperetin induces apoptosis of fibroblast-like synoviocytes in rats with adjuvant arthritis through caspase3 activation[J]. Phytother Res, 2010,24(12):1850-6. |
| [7] | 李 荣,李 俊,石静波,等. 7,3'-二甲氧基橙皮素对佐剂性关节炎大鼠免疫功能的影响[J].安徽医科大学学报,2012,47(9):1058-62. Li R, Li J, Shi J B, et al. Effect of 7,3'-dimethoxy hesperetin on immune function in rats with adjuvant arthritis[J]. Acta Univ Med Anhui, 2012,47(9):1058-62. |
| [8] | 陈伟薇,李 俊,宋 珏. 药物肠吸收的研究方法进展[J].安徽医药,2009,13(4):349-51. Chen W W, Li J, Song Y. Study methods progress on drug intestinal absorption [J]. Anhui Med Pharm J, 2009,13(4):349-351. |
| [9] | 杨延平,杨 勇.Caco-2细胞模型的应用进展[J].今日药学,2012,3(22):189-91. Yang Y P, Yang Y. Research progress on Caco-2 cell model[J]. Pharm Today, 2012,3(22):189-91. |
| [10] | Press B, Di Grandi D. Permeability for intestinal absorption:Caco-2 assay and related issues[J]. Curr Drug Met, 2008,9(9):893-900. |
| [11] | Chen Z, Ma T, Huang C, et al. Efficiency of transcellular transport and efflux of flavonoids with different glycosidic units from flavonoids of Litsea coreana Lin a MDCK epithelial cell monolayer model[J]. Eur J Pharm Sci, 2014,53:69-76. |
| [12] | 尤 青,马增春,谭洪玲,等.人参水提物在 Caco-2 模型的吸收特征[J].中国药理学通报,2013,29(12):1711-6. You Q, Ma Z C, Tan H L, et al. Absorption characteristics of Panax ginseng water extract in Caco-2 cell monolayer[J]. Chin Pharmacol Bull, 2013,29(12):1711-6. |
| [13] | Artursson P, Karlsson J. Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial (Caco-2) cells[J]. Biochem Biophys Res Commun, 1991,175(3):880-5. |