2. 沈阳师范大学粮食学院, 辽宁 沈阳 110034;
3. 安徽中医药大学, 安徽省中药研究与开发重点实验室, 安徽 合肥 230038
2. Shenyang Normal University College of Grain Science and Technology, Shenyang 110034, China;
3. Anhui Province Key Laboratory of Research and Development of Chinese Medicine, Anhui University of Traditional Chinese Medicine, Hefei 230038, China
银杏叶提取物(ginkgo biloba extract,GBE)是临床治疗脑血管疾病的一线药物,疗效得到国内外医学界充分肯定。银杏内酯B(ginkgolide B,GB)是GBE中重要的活性成分之一,GB是血小板活化因子(platelet activation factor,PAF)受体最有效的拮抗剂[1],它可减轻脑缺血/再灌注介导的脑组织脂质过氧化反应,提高自由基清除系统酶的活性,对脑损伤有明显保护作用[2, 3]。
然而,GB的药代研究数据发现其在脑部浓度非常低[4, 5],如:尾静脉注射GB (10 mg·kg-1) 20 min后脑部浓度仅为0.24 μg·g-1[4]。这里除了脑细胞对GB的清除效应外,其血脑屏障(blood brain barrier,BBB)对药物的屏障作用及BBB上P-糖蛋白(p-glycoprotein,P-gp)对药物的外排作用亦不容忽视[6]。因此,本实验室以提高GB脑靶向性、增强药效为目的,设计合成了一系列GB脑靶向前药[7, 8],如酯类前药PGB(Fig 1),它是在GB的10位羟基位置引入另一分子T而得到。T具有钙离子拮抗作用,同时对P-gp也具有一定的抑制作用。前期研究结果证实:PGB保留GB的抗血小板聚集活性[9],同时增加了拮抗钙离子通道蛋白的作用[7]。
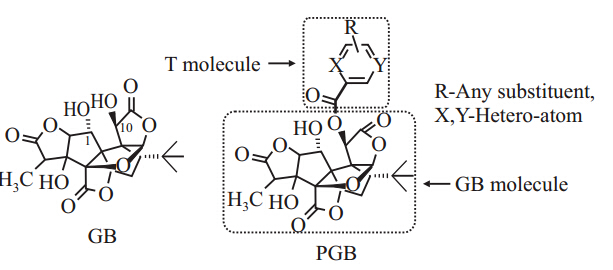
|
| Fig 1 Chemical structures of GB and PGB |
PGB是作用于脑部而发挥药效的药物,所以对其脑靶向性评价及对脑缺血的保护作用研究尤为重要。为此,本文采用LC-MS/MS法,考察大鼠尾静脉注射PGB后的脑部药动学规律并评价其脑靶向性;采用颈动脉结扎致小鼠不完全性脑缺血模型,通过伊文斯蓝法考察PGB对缺血小鼠脑毛细血管通透性的影响。在证实PGB具有脑靶向作用的基础上,深入探究其靶向机制将为其它药物的脑靶向前药设计提供科学指导。
理论上来说,BBB通透性增加及P-gp外排功能减弱均有利于增加PGB的脑部浓度,从而提高其脑靶向效率。为此,我们采用摇瓶法,结合HPLC测定PGB在正辛醇-水体系的脂水分配系数(logP),以此推测PGB的BBB通透性。P-gp结合力(亲和力)大小直接影响P-gp外排功能的强弱,在此,我们分别采用Molegro Virtual Docker (MVD)分子对接软件计算PGB、GB与P-gp的结合力大小;并以ATPase活性分析法测定PGB、GB对人P-gp膜ATP酶活性的影响,以考察它们与P-gp的亲和力。
1 材料与方法 1.1 材料 1.1.1 药品与试剂PGB为本实验室合成,其结构经IR、NMR、MS确证,纯度>99%;GB为合肥拓峰生物工程有限公司提供,纯度≥ 98%;盐酸维拉帕米为武汉拉那白医药化工有限公司提供,纯度99%;HPLC级甲醇购自美国Tedai公司;伊文斯蓝购自BIOSHARP公司;人P-gp膜购自美国BD公司;Tris、MES、DL-二硫苏糖醇(DTT)购自萨恩(上海)化学技术有限公司;甲酰胺、正钒酸钠、Mg-ATP、消泡剂A、SDS购自美国Sigma公司;其它试剂购自国药集团,均为分析纯。
1.1.2 仪器API 3200型三重四级杆串联质谱仪,配有电喷雾离子化源及Analyst 1.4.1数据处理软件,美国Applied Biosystem公司;高效液相色谱系统,配有515高压泵、2420蒸发光散射检测器(ELSD)、2487紫外光谱检测器(UVD)、Empower数据处理系统,美国Waters公司;Spectra Max M2e 多功能酶标仪,美国Molecular Devices公司;标准PB-10酸度计,北京赛多利斯仪器系统有限公司;HH-4数显恒温水浴锅,常州国华电器有限公司;台式电热恒温培养箱,上海跃进医疗器械厂;96孔细胞培养板,美国Corning公司。
1.1.3 实验动物SD大鼠,♀♂兼用,体质量(200±20)g,由安徽医科大学实验动物中心提供,动物许可证号SCXK(皖)2005-001;SPF级昆明种小鼠,♂,体质量(20±2)g,由安徽医科大学实验动物中心提供,动物许可证号:SCXK(皖)2011-002。动物自由进食,饮水,标准颗粒饲料,室温(18~22)℃,实验前常规饲养1周。
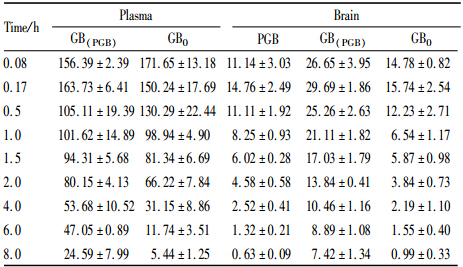
1.2 方法 1.2.1 PGB脑靶向性评价 1.2.1.1 动物分组及给药SD大鼠随机分为PGB组(12.83 mg·kg-1)或GB组(10 mg·kg-1),尾静脉注射给药,于给药后0.08、0.17、0.5、1、1.5、2、4、6、8 h时经大鼠眼底静脉丛采血,置于预先肝素化的试管中,4℃离心 (4 000 r·min-1,10 min),精密吸取上层血浆,于-20℃保存,待测。取血后立即取出脑组织,用生理盐水洗净,滤纸吸干,称重后加入4倍量生理盐水(kg·L-1)制成脑匀浆,于-20℃保存,待测。
1.2.1.2 生物样品处理精密吸取血浆或脑匀浆190 μl,加入GA溶液(4 mg·L-1,内标)5.0 μL,混匀后加入乙酸乙酯1.0 mL,涡旋振荡3 min,4℃离心 (12 000 r·min-1,10 min),取上层有机相,40℃水浴氮气流下吹干,残渣用400 μL流动相复溶,离心10 min,取上清液。其中血浆样品的上清液稀释10倍,脑匀浆样品不稀释,取10 μL进行LC-MS/MS分析。
1.2.1.3 测定条件[10]色谱条件:色谱柱:Waters Symmetry shield RP18 (3.9 mm×150 mm ID,5 μm);流动相:甲醇-10 mmol·L-1乙酸铵溶液(85 ∶ 15,V/V);流速:0.8 mL·min-1;柱温40℃;进样量10 μL。
质谱条件:电喷雾ESI离子源;负离子模式;多反应监测(MRM)扫描方式;电喷雾电压(IS)-4500 V;离子源温度(TEM)500℃;定量分析的离子对:PGB,[M-H]-,m/z 543.3/137.2;GB,[M-H]-,m/z 423.6→367.1和GA,[M-H]-,m/z 407.2→350.8。
1.2.1.4 脑靶向性评价[11]采用中国药理学会编制的3P97药代动力学分析软件,计算静脉注射药物后血浆及脑组织中的药代动力学参数,并以治疗有效性(therapeutic availability,TA)和靶向指数(drug targeting index,DTI)定量评价PGB的脑靶向特性。

式中:AUC表示药物从零时间至所有原形药物全部消除这一段时间的药-时曲线下面积。
AUCbrain(PGB)、AUCbrain(GB)分别表示注射PGB和原药GB后的脑内GB的AUC。
AUCblood(PGB)、AUCblood(GB)分别表示注射PGB和原药GB后的血浆内GB的AUC。
1.2.2 PGB对不完全性脑缺血模型小鼠脑毛细管通透性的影响SPF级小鼠按体质量均衡随机分为假手术组、模型组、GB组(5 mg·kg-1)、PGB高、中、低剂量(10、5、2.5 mg·kg-1)组。除假手术组、模型组外,其余各组均腹腔注射给药,给药容积为5 mL·kg-1,假手术组、模型组给予等容积的溶媒,每3 d称量体质量1次,根据体质量变化调整给药容量,连续腹腔注射7 d。
d 8各组小鼠用5.25%水合氯醛溶液麻醉,手术分离两侧颈总动脉,用动脉夹持续夹闭双侧颈总动脉20 min,打开双侧动脉夹,缝合颈部皮肤。休息2 h后由尾静脉注射2.5% 伊文斯蓝溶液 (10 mL·kg-1)。注射1 h后,将小鼠颈椎脱臼处死,开颅取脑,将脑组织浸于生理盐水中清洗,滤纸吸干,准确称重,将脑组织浸泡于脑质量10倍体积(kg·L-1)的甲酰胺中,45℃培养箱温育72 h,12 000 r·min-1离心20 min,取上清液,于620 nm处,酶标仪测光密度(OD)值。
1.2.3 PGB脂水分配系数测定[12] 1.2.3.1 测定条件色谱柱:Symmetry shied C18柱(250×4.6 mm,5 μm);测定GB时的其它色谱条件:流动相:甲醇-水-四氢呋喃(30 ∶ 60 ∶ 10,V/V);流速:0.8 mL·min-1;柱温:25℃;蒸发光散射检测器,氮气25 psi,增益值100,漂移管60℃,蒸发器级别60%。
测定PGB时的其它色谱条件:流动相:甲醇-水(55 ∶ 45,V/V);流速:0.8 mL·min-1;柱温:25℃;紫外检测波长275 nm。进样量均为10 μL。
1.2.3.2 样品配制精密配制浓度为1.0及 0.1 g·L-1的PGB、GB正辛醇(二次蒸馏水饱和)溶液,避光保存,备用。
1.2.3.3 平衡时间确定分别取0.1、1.0 g·L-1 PGB正辛醇溶液10 mL于锥形瓶中,加入10 mL二次蒸馏水(正辛醇饱和)混合振荡。分别振荡1、2、3、4、5、6 h后,分离水相和有机相,检测水相中PGB浓度。当浓度不再增加时,即为平衡时间。同法确定GB正辛醇溶液的平衡时间。
1.2.3.4 脂水分配系数测定分别取0.1 g·L-1 PGB或GB正辛醇溶液10 mL与10 mL二次蒸馏水(1 ∶ 1)混合,25℃下振荡3 h (根据1.2.3.3结果确定);另取1.0 g·L-1 PGB或GB正辛醇溶液10 mL与50 mL二次蒸馏水(1 ∶ 5)混合,25℃下振荡5 h(根据1.2.3.3结果确定)。上述各溶液振荡后分离有机相和水相,分别测定两相中PGB、GB浓度。
正辛醇/水分配系数以log P表示,其计算公式为:
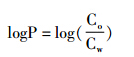
式中:Co表示化合物在正辛醇中的浓度,Cw表示化合物在水相中的浓度。
1.2.4 PGB与P-gp结合力的分子对接计算 [13]采用MVD软件模拟配体分子与受体蛋白的结合力或亲和力。这里的受体蛋白为P-gp,它的晶体结构[14]来源于蛋白质数据库(protein data bank,PDB)的鼠P-gp PDB code:3G5U);配体分子选择PGB、GB、T 和维拉帕米(verapamil,Ver)。T分子是PGB结构(Fig 1)中具有P-gp抑制作用的活性分子;Ver是一种常用的P-gp抑制剂,可激活P-gp的ATP酶活性。在分子对接过程中,采用准确性较高的MolDock打分算法,MolDock Score 绝对值越大,配体分子与P-gp结合力越大。结合力越大,越易被P-gp外排,从而可以使同时存在的其它分子的外排受到抑制。
1.2.5 PGB对人P-gp 膜ATP酶活性的影响[15, 16] 1.2.5.1 溶液配制反应基质液:称取EGTA 75.8 mg、KCl 187.3 mg、DTT 31.2 mg、NaN3 32.5 mg溶于100 mL Tris-MES 缓冲液(PH 6.8)得到反应基质液。
标准Pi溶液:称取NaH2PO4 30.0 mg溶于10 mL反应基质液得到3 g·L-1的NaH2PO4储备液。用反应基质液稀释至0.3、0.25、0.2、0.15、0.1、0.05 g·L-1,即为标准Pi溶液。
药物溶液:(1) PGB或GB溶液:分别称取8.2 mg PGB 或6.4 mg GB,用反应基质液溶解并定容至10 mL,配成1 500 μmol·L-1的PGB或GB母液,并稀释至750、300、150、30 μmol·L-1;(2) Ver溶液:称取7.4 mg盐酸维拉帕米,用反应基质液溶解并定容至10 mL,配成1 500 μmol·L-1的Ver母液,并稀释至750、300、150、30 μmol·L-1。
P-gp膜溶液:取人P-gp膜母液 (5 g·L-1)于37℃水浴快速解冻,用反应基质液稀释至1 g·L-1,置于冰上待用。
正钒酸钠工作液:称取正钒酸钠27.5 mg溶于5 mL反应基质液,取其中的100 μL溶液用反应基质液稀释至10 mL,得到300 μmol·L-1的正钒酸钠工作液。
Mg-ATP液:称取Mg-ATP 31.2 mg,溶于5 mL反应基质液,得到12 mmol·L-1的Mg-ATP溶液。
反应终止液和显色液:称取SDS 1.01g溶于10 mL蒸馏水,加入20 μL消泡剂A,配成SDS质量分数为10%含0.2%消泡剂A的反应终止液;称取钼酸铵432.6 mg、醋酸锌27.5 mg,用蒸馏水溶解并定容至10 mL得到显色剂A。称取抗坏血酸4 g,溶于36 mL蒸馏水,配成质量分数为10%抗坏血酸溶液,此为显色剂B。使用时两种溶液以1 ∶ 4 (V/V)混合作为显色剂。
1.2.5.2 试验分组非P-gp ATP酶活性组(正钒酸钠+P-gp膜);阳性对照组(Ver系列浓度+P-gp膜);试验组(GB或PGB系列浓度+P-gp膜)。
1.2.5.3 反应孵育条件反应在96孔板中进行。P-gp膜溶液和试验药物溶液各20 μL,在37℃培养箱中预热5 min,随后加入20 μL 37℃预热5 min的Mg-ATP溶液,开始反应。另将含有正钒酸钠的反应液作为对照,以排除P-gp制作过程中非P-gp ATP酶活性和非酶作用的ATP水解的影响。该反应液(60 μL)在37℃孵育相应时间,之后每孔加入30 μL反应终止液,再加入200 μL显色剂(含40 μL显色剂A和160 μL显色剂B),37℃孵育20 min,多功能酶标仪在620 nm处测吸光度。
1.2.5.4 Pi标准曲线将配制好的0~0.3 g·L-1标准Pi溶液接种于96孔板上,每孔60 μL,每个浓度平行5孔,37℃孵育30 min后,加入30 μL反应终止液,其余按1.2.5.3项下处理。
1.2.5.5 时间-ATP酶活性实验根据试验分组,分别在96孔板中加入正钒酸钠工作液、300 μmol·L-1 Ver溶液、300 μmol·L-1 GB溶液或PGB溶液各20 μL,每组平行3孔。随后每孔加入稀释后的P-gp膜溶液20 μL,37℃培养箱中预热5 min,最后加入37℃预热的Mg-ATP溶液20 μL,混匀后37 ℃分别孵育0、15、30、45、60 min。其余按1.2.5.3处理。根据Pi标准曲线求算反应释放的无机磷量,绘制ATP酶活-时间曲线。
1.2.5.6 浓度-ATP酶活性实验根据试验分组,分别在96孔板中分别加入正钒酸钠工作液、Ver、GB、PGB系列工作液(1500、750、300、150、30 μmol·L-1)各20 μL,每一浓度平行3孔。随后每孔加入稀释后的P-gp膜溶液20 μL,在37℃培养箱中预热5 min,再加入37℃预热的Mg-ATP溶液20 μL,混匀后37℃孵育60 min(根据1.2.5.5结果确定),之后按1.2.5.3处理。根据Pi标准曲线求算反应释放的无机磷量,绘制ATP酶活-药物浓度曲线。
1.2.5.7 数据处理将所测得的ATP酶活性数据代入米氏方程
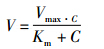
其中,V和Vmax分别为药物激活的ATP酶活性及其最大值,Km为米氏常数,即ATP酶活为最大值一半时的底物浓度;C代表底物浓度。
1.3 统计学方法 所有实验数据均以 表示,采用SPSS 18.0进行F检验。
表示,采用SPSS 18.0进行F检验。
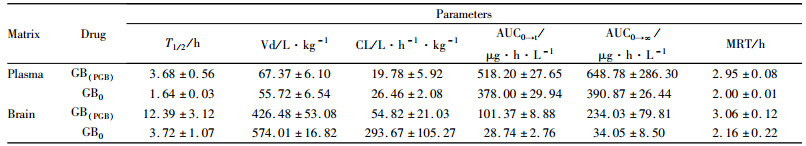
大鼠尾静脉注射PGB,给药5 min后在脑匀浆中即检测到PGB以及PGB降解的GB。与直接注射GB(以GB0表示)相比,注射PGB后在脑匀浆检测到的GB(以GB(PGB)表示)浓度均有较大幅度提高。注射PGB或GB后,在血浆和脑匀浆检测到的药物浓度数据以及它们的药动学参数列于Tab 1和2。由“1.2.1.4”下的公式计算TA为6.87,DTI为4.14,这表明将GB改造成PGB后,PGB可以迅速通过BBB,且脑靶向性大大提高。同时,我们也观察到PGB降解GB的脑内半衰期(T1/2)延长,清除率(CL)下降,PGB呈现出一种长效缓释特性,这对于脑血管疾病的长期用药是非常有利的。
 , n=6)
, n=6)
 |
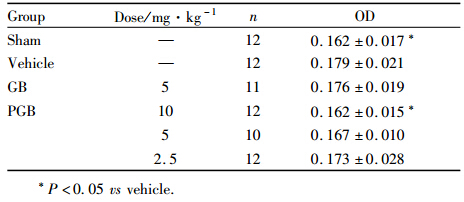
小鼠腹腔注射连续给药7d后,模型组与假手术组相比,伊文斯蓝通过小鼠脑毛细血管的量明显增加,这说明不完全性脑缺血小鼠模型复制成功(P<0.05),如Tab 3所示。GB给药组的伊文斯蓝透过量与模型组相比有所减少,但其差异无统 计学意义;而PGB低、中、高剂量组的伊文斯蓝透过量均低于模型组,且呈现一定的剂量依赖性,其中PGB高剂量组的降低程度最为明显,差异具有统计学意义(P<0.05)。以上结果表明,PGB对不完全性脑缺血小鼠的保护作用强于GB,这可能也得益于PGB的脑靶向性提高。
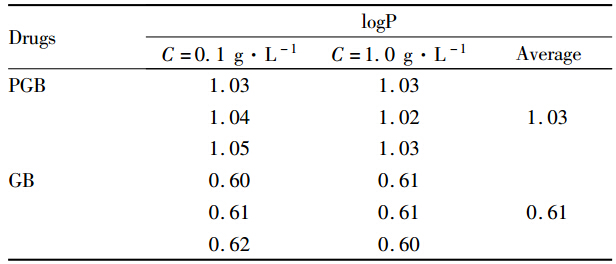
PGB的脂水分配系数测定结果见Tab 4。由表可知,将GB制成前药PGB后其亲脂性增强(logP=1.03),更易穿透BBB到达脑部。
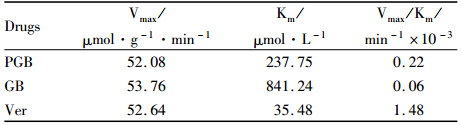
各配体与P-gp的分子对接计算结果见Tab 5。由MolDock Score计分数据预测配体分子与P-gp的结合力,其结合力大小排序为:PGB >GB ≥Ver>T。PGB与P-gp结合力大于GB,即当脑内同时存在PGB和降解的GB时,PGB由于结合力大优先被外排出脑,从而减弱了P-gp对GB的外排作用,最终使GB的脑内浓度升高。
| Drugs | MolDock score/ KJ·mol-1 | Rerank score/ KJ·mol-1 | HBond/ KJ·mol-1 |
| PGB | -143.36 | -94.63 | -6.44 |
| GB | -116.40 | -82.98 | -9.02 |
| T | -64.40 | -53.82 | -8.39 |
| Ver | -110.35 | -86.28 | -0.11 |
在0~0.2 g·L-1的浓度范围内,无机磷吸光度(A)与NaH2PO4浓度线性良好(Fig 2),且覆盖了整个待测样本的浓度范围。
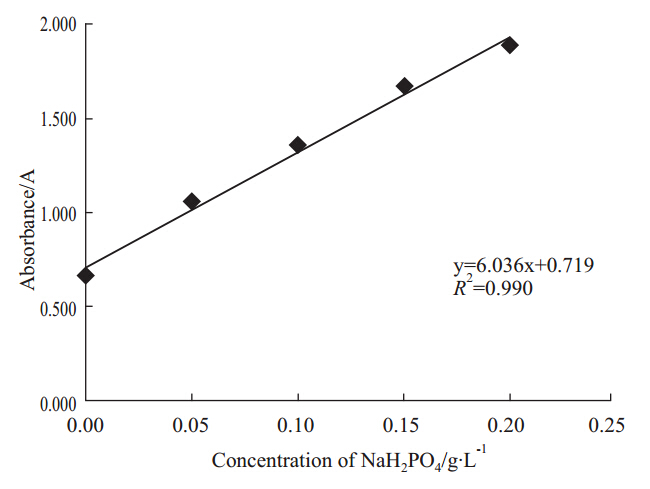
|
| Fig 2 Standard curve of inorganic phosphate concentration |
结果显示,PGB、GB、Ver诱导的P-gp ATP酶活性存在时间依赖性。随着时间延长,各种药物依赖的ATP水解释放的无机磷量均增多,且无机磷释放量与时间之间呈现较好的线性关系(Fig 3)。为达到最大灵敏度,选择60 min作为药物与P-gp膜作用时间,此时的吸光度均在Pi浓度测定标准曲线的线性范围之内。
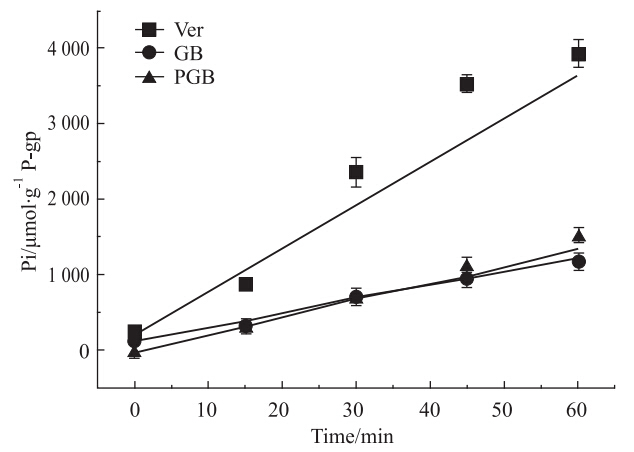
|
| Fig 3 Time dependency of substrate induced P-gp ATPase activity as measured by inorganic phosphate released by three drugs |
PGB是一种兼具PAF受体拮抗和钙离子拮抗作用的新型GB前体药物,本研究证实了PGB具有较优的脑靶向性,其以治疗有效性(TA)和靶向指数(DTI)评价的脑靶向效率达6.87和4.14。
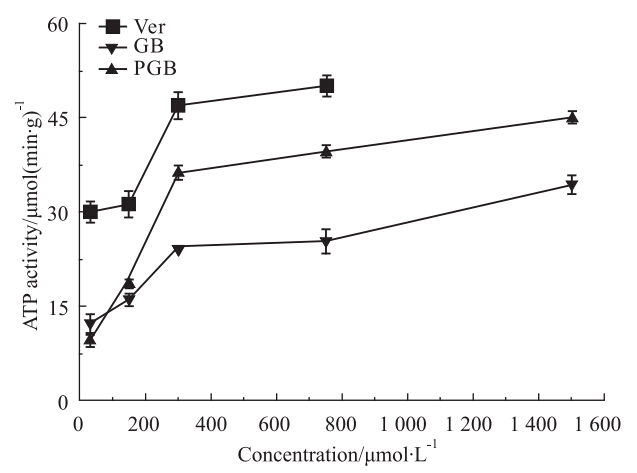
|
| Fig 4 Concentration dependency of substrate induced P-gp ATPase activity as measured by inorganic phosphate released by three drugs |
药物有无脑靶向性关键有两点:一是药物能跨越BBB大量入脑,二是入脑药物不被外排出脑。跨膜输入依赖于药物对BBB的通透性,BBB通透性通常取决于药物本身的相对分子量、脂溶性以及特定的载体或受体转运系统等。BBB上存在的P-gp外排泵,能将许多脂溶性好、易透过BBB的药物外排出脑组织,所以减少输出需降低P-gp的外排泵效能。
正辛醇-水体系的分配系数是预测药物透膜转运能力的重要指标。本研究通过摇瓶法结合HPLC测得PGB的logP数值(1.03)高于GB (0.61),这说明将GB改造为PGB后脂溶性增强,更易于跨越BBB到达脑部,使脑内可供降解为GB的PGB量上升。这一推测在尾静脉注射PGB后GB脑内浓度检测(Tab 1)中得到了较好地证实。
P-gp 对药物外排作用具有竞争性和ATP依赖性,本实验中,我们采用了分子对接软件预测PGB、GB与P-gp的结合力,以此分析它们被P-gp外排的优先性;研究PGB、GB对人P-gpATP 酶活性的影响,以此分析它们对P-gp外排功能的抑制作用。分子对接计算结果提示,PGB与P-gp的结合力高于GB; PGB、GB对人P-gp膜 ATP酶活的测定结果表明:二者均能提高P-gp ATP酶活,阻断P-gp介导的其它药物外排,但PGB比GB具有更高的亲和力,即PGB对P-gp的外排抑制作用更强,上述结果表明,当脑内同时存在PGB及PGB降解的GB时,PGB由于亲和力强易被外排出脑,从而有效减弱或阻断P-gp对GB的外排,最终使GB的脑内浓度升高,在一定程度上增强了GB的脑靶向性。
综上所述,PGB的脑靶向作用主要得益于较高的脂溶性和对P-gp的强抑制作用。以上研究结果提示:增大药物的脂溶性(logP)及药物与P-gp 亲和力可在一定程度上实现脑靶向给药,这对于脑靶向前药设计提供一种新的设计策略,即可以借助计算化学的logP 计算和分子对接的P-gp亲和力预测来设计筛选脑靶向前药。
| [1] | Strømgaard K, Nakanishi K. Chemistry and biology of terpene trilactones from ginkgo biloba [J]. Angew Chem Int Ed, 2004, 43:1640-58. |
| [2] | 黄贱英,孙建宁,梅世昌,黄纪明.银杏内酯B对缺血/再灌脑损伤大鼠的保护作用[J].中国药理学通报,2008, 24(2):269-72. Huang J Y, Sun J N, Mei S C, Huang J M. Protective effects of ginkgolide B on cerebral ischemia reperfusion injury in rats [J]. Chin Pharmacol Bull, 2008, 24 (2):269-72. |
| [3] | Lv P, Fang W R, Geng X H, et al. Therapeutic neuroprotective effects of ginkgolide B on cortex and basal ganglia in a rat model of transient focal ischemia [J]. Eur J Pharm Sci, 2011, 44 (3):235-40. |
| [4] | 王 磊,李 宁,韩德恩,等.环孢素A对银杏内酯B大鼠体内药动学的影响[J].药学学报,2009, 44 (6):632-9. Wang L, Li N, Han D E, et al. Effec of cyclosporine A on the pharmacokinetics of ginkgolide B in rats [J]. Acta Pharm Sin, 2009, 44 (6):632-9. |
| [5] | Suehiro M, Simpson N R, Underwood M D, et al. In vivo biodistribution of ginkgolide B, a constituent of Ginkgo biloba, visualized by MicroPET [J].Planta Med, 2005, 71(7):622-7. |
| [6] | 王玉璘,王少侠,郭 红,胡利民.血脑屏障中P-糖蛋白的调节机制 [J].中国药理学通报,2011,27(9):1196-200. Wang Y L, Wang S X, Guo H, Hu L M. Regulatory mechanisms of P-glycoprotein at the blood-brain barrier [J]. Chin Pharmacol Bull, 2011, 27(9):1196-200. |
| [7] | 袁 媛. 银杏内酯B孪药脑靶向性和药效机制研究 [D].合肥工业大学, 2012. uan Y. Mechanisms research of brain targeting and pharmacodynamic of ginkgolide B twin drug [D]. Hefei University and Technology, 2012. |
| [8] | 吴泽宇. 银杏内酯B前药设计、合成及脑靶向性研究 [D].合肥工业大学, 2012. Wu Z Y. Design, synthesis and brain targeting research of prodrug of ginkgolide B [D]. Hefei University and Technology, 2012. |
| [9] | 潘 见,袁 媛,惠爱玲,等.银杏内酯B前体药物的抗血小板聚集活性研究[J].中国药理学通报,2012,28 (10):1435-8. Pan J, Yuan Y, Hui A L, et al. Antiplatelet aggregative activity of prodrug of Ginkgolide B [J].Chin Pharmacol Bull, 2012, 28 (10):1435-8. |
| [10] | Yuan Y, Pan J,Wu Z Y, et al. Validated LC-MS-MS method for the determination of prodrug of ginkgolide B in rat plasma and brain:application to pharmacokinetic study [J]. J Chromatogr Sci, 2013, 51(3):266-72. |
| [11] | 张志荣. 靶向药物的药动学/药效学模型.[M]//张志荣等,编著. 靶向治疗分子基础与靶向药物设计. 北京:科学出版社, 2005, 449-51. Zhang Z R. Drug targeting pharmacokinetic/pharmacodynamic model. [M]//Zhang Z R, et al. Ed. Molecular basis of targeted therapy and drug targeting design. Beijing:Science Press, 2005, 449-51. |
| [12] | 潘 见,吴泽宇,惠爱玲,陶 敏.银杏内酯B及其前药脂水分配系数的测定[J].时珍国医国药, 2011,22(10):2397-400. Pan J, Wu Z Y, Hui A L, Tao M. Determination of partition coefficients of ginkgolide B and its prodrug [J]. Lishizhen Med Mat Med Res, 2011, 22(10):2397-400. |
| [13] | Hui A L, Chen Y, Zhu S J, et al. Design and synthesis of tacrine-phenothiazine hybrids as multitarget drugs for Alzheimer's disease [J]. Med Chem Res, 2014, 23 (7):3546-57. |
| [14] | Aller S G, Yu J, Ward A, et al. Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding [J]. Science, 2009, 373:1718-22. |
| [15] | Wang J S, Zhu H J, Gibson B B, et al. Sertraline and its metabolite desmethylsertraline, but not Bupropion or its three major metabolites, have high affinity for P-glycoprotein [J]. Biol Pharm Bull, 2008, 31 (2):231-4. |
| [16] | 臧彩红,张 艳,江金花,等. 盐酸千金藤碱逆转肝癌多药耐药性与P-gp ATP 酶活性的关系研究[J]. 中国药理学通报,2011,27(7):1002-6. Zang C H, Zhang Y, Jiang J H, et al. Effect of cepharanthine hydrochloride on overcoming multidrug resistance and P-gp ATPase activity in mice model of hepatocellular carcinoma [J]. Chin Pharmacol Bull, 2011, 27(7):1002-6. |