


2. 辽宁中医药大学, 辽宁 沈阳 110032
2. Liaoning University of Traditional Chinese Medicine Shenyang 110032, China
癫痫,俗称“羊角风”或“羊癫风”,是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。在众多癫痫模型中,戊四唑可使致痫动物产生与人类极为相似的行为及神经病理学改变,且戊四唑本身无特殊的神经毒性作用,致痫不伴有神经元坏死,如果致痫动物出现神经元损伤,可明确判断是癫痫发作本身所致,使得结果分析更直观、简单,是一种研究癫痫发作与神经损伤关系的较理想造模药物[1]。虽然戊四唑诱发大鼠急性癫痫模型已经十分成熟,但癫痫急性发作后对海马神经元的损伤随时间的变化情况仍不明确,本研究在戊四唑诱发大鼠急性癫痫后于不同时间点将大鼠处死,对大鼠脑组织切片进行尼氏染色及免疫组织化学染色,考察戊四唑诱发大鼠急性癫痫后在不同时间点海马区的损伤程度,以确定在中药药效学研究中戊四唑诱发大鼠急性癫痫模型病理取材的最佳时间。
戊四唑,Sigma,批号:SLBF5034V。水合氯醛,北京市旭东化工厂,批号:20000530。多聚甲醛,国药集团化学试剂有限公司,批号:F20091203。甲苯胺蓝,SOLARBIO,批号:528A027。caspase-3,博士德生物,批号:BA111。AIF,博士德生物,批号:83410P365。DAB显色试剂盒,福建迈新生物技术开发有限公司,批号:1403030031。TMS-P超敏试剂盒,福建迈新生物技术开发有限公司,批号:1312029706。无水乙醇,沈阳市新化试剂厂,批号20140428。二甲苯,沈阳市新化试剂厂,批号:20140106。枸橼酸,国药集团化学试剂有限公司,批号:20130307。枸橼酸钠,国药集团化学试剂有限公司,批号:20121009。磷酸二氢钠,沈阳试剂三厂,批号:0601。磷酸氢二钾,沈阳试剂一厂,批号:850901。氯化钠,国药集团化学试剂有限公司,批号:20130909。
1.2 动物Wistar大鼠 46 只,♀♂各半,体质量180~200 g,SPF级,由辽宁长生生物技术有限公司提供,许可证号:SCXK(辽)2010-0001。
1.3 仪器光电显微镜:奥林巴斯中国有限公司,BX53型。电热恒温培养箱:厦门医疗电子仪器厂,JKDP2型。烤片机:阳光神琦医用科技有限公司,YG-280型。
2 方法 2.1 癫痫急性模型的建立及脑标本制备 [2, 3]从46 只Wistar大鼠中按体重随机抽取6只为空白对照组,空白对照组与144 h组同时麻醉,灌流取脑。其余40 只大鼠全部一次腹腔注射10 g·L-1戊四唑(64 mg·kg-1)。剔除因强直发作死亡的动物以及30 min内癫痫强度未达到 Racine[4] 5 级发作的动物,在剩余的大鼠中随机抽取24 只,并按体重随机分为4 组,分别为24 h组、72 h组、120 h组、144 h组,每组6 只。分别于注射戊四唑后24、72、120、144 h相应组别大鼠用100 g·L-1水合氯醛 (10 ml·kg-1)深度麻醉,仰卧固定于解剖板上,在剑突下开胸,暴露心脏,用输液针从心尖部插入左心室,在右心耳处剪口放血,先用200 ml生理盐水快速灌注,然后减慢灌注速度直到从右心耳处流出无色液体,接着用溶于0.1 mol PBS的40 g·L-1多聚甲醛(pH 7.4)约150 ml继续灌注固定。灌注完后断头取脑,然后放入40 g·L-1多聚甲醛,4 ℃固定72 h。将组织块脱水至蜡23 h,然后石蜡包埋,在石蜡切片机上连续冠状切片,厚度5 μm,切片放入40℃的蒸馏水中展开,然后用涂布100 g·L-1多聚赖氨酸的清洁载玻片捞出,晾干后46 ℃烘烤2 h备用。
2.2 尼氏染色方法 [5, 6]常规脱蜡至水后将切片浸入10 g·L-1甲苯胺蓝溶液染色6 min,蒸馏水浸 5 min去除浮色,依次放入700 ml·L-1乙醇2 min,950 ml·L-1乙醇5 min,无水乙醇浸泡3 min;然后用透明剂(二甲苯)透明2次,每次5 min,中性树胶封片。每只大鼠随机选择2 张经尼氏染色的大脑切片进行观察[7] 。将切片置于200 倍显微镜下,观察各组大鼠海马CA1区神经细胞尼氏小体的染色情况,于400 倍镜下对各组大鼠脑片海马CA1相同部位进行神经元计数。
2.3 免疫组织化学染色p8, 9]石蜡切片严格按照DBA试剂盒说明书进行免疫组化染色操作,观察海马区的病理变化,并使用Image J软件对经免疫组化染色的大脑切片海马区200 倍放大图片进行灰度值分析。
2.4 统计学分析采用SPSS 17.0统计软件对试验结果进行分析处理,计量资料采用x±s表示,组间比较用单因素方差分析。
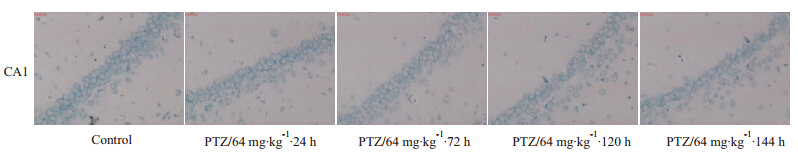
3 结果 3.1 大鼠海马CA1区神经元损伤尼氏染色结果由Fig 1可见空白对照组大鼠海马CA1区锥体细胞排列整齐、紧密,细胞结构完整,细胞核圆形或椭圆形,核仁清晰,胞质内可见丰富的尼氏小体,急性癫痫造模后24、72、120、144 h大鼠海马CA1区神经元逐渐丢失,细胞排列疏松部分神经元胞体皱缩,核固缩,胞质内尼氏小体减少,海马神经元损伤情况随着时间延长逐渐加重,但细胞计数结果显示造模后120 h组的细胞个数和144 h组细胞个数差异未见显著性(Tab 1)。
|
| Fig.1 Nissl staining of CA1 regions Fewer neurons were in PTZ.24h,PTZ.72h,PTZ.120h and PTZ.144h groups compared with control group. |
由Fig 2、3可见,大鼠注射戊四唑后海马CA1、CA3及皮层caspase-3和AIF蛋白阳性表达较空白组明显,且随着时间的延长阳性细胞染色逐渐加深。由表 2可得出,与空白对照组相比,造模后120 h caspase-3和AIF的阳性细胞蛋白表达灰度值差异最明显,P<0.05(Tab 2)。
 |

|
| Fig.2 Caspase-3 activity in hippocampus of rats (×200) |
神经细胞胞质含有较发达的粗面内质网、游离核糖体、微丝、神经丝和微管以及高尔基复合体等,粗面内质网常呈现规则的平行排列,游离核糖体分布于其间,在光镜下呈嗜碱性颗粒或小块,称尼氏体。尼氏体染色后呈块状(形如虎斑)或颗粒状,核周围尼氏体颗粒较大,近边缘处较小而细长。 在神 经元受损时,尼氏体的数量可减少甚至消失,因尼氏体消失,胞质着色浅,胞体肿胀,细胞由多极形状变为圆形,因此,根据神经细胞形状和数量差异,可判别神经细胞损伤程度[10]。本研究中,大鼠戊四唑急性癫痫模型造模后120 h以内海马CA1区锥体细胞随着时间的延长损伤加重,模型组胞质染色逐渐变浅,细胞排列混乱,稀疏,细胞核固缩变小。

|
| Fig.3 AIF activity in hippocampus of rats (×200) |
caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是细胞杀伤机制的重要组成部分。caspase-3[11]最主要的底物是多聚 (ADP-核糖) 聚合酶(PARP),该酶与DNA修复、基因完整性监护有关。在细胞凋亡启动时,116 ku 的PARP在Asp216-Gly217 之间被Caspase-3剪切成31 ku和85 ku两个片段,使PARP中与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能。结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡[12]。caspase-3阳性表达为胞质染色,由试验结果可以看出戊四唑急性癫痫模型造模后120 h以内海马锥体细胞的细胞质染色随着时间的延长逐渐加深,表明caspase-3蛋白表达增加,细胞损伤加重。
凋亡诱导因子(apoptosis-inducing factor,AIF)[13]是一种具有凋亡诱导活性的蛋白质,定位于线粒体的膜间隙。细胞受到凋亡刺激时,AIF分子从线粒体释放到胞质,然后再易位到核,与染色体 DNA结合,使染色体核周边凝集和DNA 断裂成约50 ku 的大片段。AIF具有凋亡诱导活性和氧化还原酶活性,但二者的作用是脱偶联的。AIF在介导细胞凋亡过程中起双重作用,一方面充当细胞凋亡的起始因子,另一方面又是细胞凋亡的直接效应因子。AIF正常情况下位于线粒体中,能清除细胞内的自由基而阻止凋亡。当细胞受到凋亡刺激后,AIF首先从线粒体转移到胞质中,然后再转移到细胞核中,促进细胞凋亡[14, 15]]。免疫组化中,AIF阳性细胞核呈棕黄色,由试验结果可以看出戊四唑急性癫痫模型造模后120 h以内海马锥体细胞核染色随着时间的延长逐渐加深,表明AIF蛋白表达增加,细胞损伤加重。
试验结果表明,大鼠戊四唑急性癫痫模型造模后120 h海马锥体细胞损伤最严重,与空白对照组差异最明显,为药效学研究的最佳取材时间。
| [1] | 高学杰.促红细胞生成素对戊四氮致痫幼鼠脑保护作用研究[D].福建医科大学,2010. Gao X J.A study of neuroprotective effects of erythropoietin on the rats with epilepsy induced by Pentylenetetrazole[D]. Fujian Medical University, 2010. |
| [2] | 王守权,隋鸿锦,宫 瑾,等.戊四氮急性癫痫模型齿状回分子层突触的可塑性变化[J].解剖学杂志,2004,27(3):288-90. Wang S Q,Sui H J, Gong J, et al. Synaptic plasticity in molecular layer of dentate gyrus after acute epilepsy induced by pentetrazole in rats[J]. Chin J Aant, 2004,27(3):288-90. |
| [3] | 王 玢,迟华基,袁芳曜,等.中药复方对戊四氮致痫大鼠海马神经元caspase-3表达的影响[J].山东教育学院学报,2010,142(6):39-41.Wang F,Chi H J,Yuan F Y,et al.Effect of Chinese medicine compound on the expression of caspase-3 in hippocampus of epileptic rats induced by pentatrazole[J]. J Shandong Educat Institute, 2010,142(6):39-41. |
| [4] | Racine R J. Modification of seizure activity by electrical stimulation. Ⅱ. Motor Seizure[J]. Electroencephalogr Clin Neurophysiol, 1972,32(3):281-94. |
| [5] | Shibeeb O,Wood J P,Casson R J, Chidlow G. Effects of a conventional photocoagulator and a 3-ns pulse laser on preconditioning responses and retinal ganglion cell survival after optic nerve crush [J]. Experimental Eye Res,2014,127:77-90. |
| [6] | Dhaher R,Damisah E C, Wang H,et al. 5-Aminovaleric acid suppresses the development of severe seizures in the methionine sulfoximine model of mesial temporal lobe epilepsy [J]. Neurobiol Dis,2014,67:18-23. |
| [7] | 张 玮,韩 宁,胡金凤,等.化合物IMM-H004对大鼠急性全脑缺血/再灌注损伤的保护作用[J]. 中国药理学通报,2013,29(12):1654-9.Zhang W, Han N, Hu J F,et al. Neuroprotective effect of compound IMM-H004 against transient global brain ischemia/reperfusion in rat[J].Chin Pharmacol Bull, 2013,29(12):1654-9. |
| [8] | 冯建利,姚 博,闫 鹏,等.大鼠局灶性脑缺血/再灌注后凋亡诱导因子的表达及其与神经细胞凋亡的关系[J].中国老年学杂志,2007,27(10):1955-7.Feng J L,Yao B, Yan P, et al. The expression of apoptosis inducing factor after focal cerebral ischemia and reperfusion in rats and its relation to nerve cell apoptosis[J].Chin J Gerontol,2007,27(10):1955-7. |
| [9] | 李巧云,张海华,游仁芳.Caspase-3表达及神经元凋亡的影响[J].南昌大学学报,2013,53(10):11-4.Li Q Y,Zhang H H, You R F. The effects of caspase-3 the expression on neuronal apoptosis[J]. J Nanchang Univ Med Sci,2007,53(10):1955-7. |
| [10] | 顾 兵,金建波,李华南,等.神经组织染色方法的研究概况[J].中国药理学通报,2011,27(10):1472-5.Gu B,Jin J B,Li H N,et al.Overview of nervous tissue staining method[J]. Chin Pharmacol Bull, 2011,27(10):1472-5. |
| [11] | Kalonia H, Kumar A. Suppressing inflammatory cascade by cyclo-oxygenase inhibitors attenuates quinolinic acid induced Huntington's disease-like alterations in rats [J]. Life Sci,2011, 88(17-18):784-91. |
| [12] | 王海燕,王来栓.细胞凋亡通路研究进展[J].国外医学·生理、病理科学与临床分册,2003,23(5):491-2.Wang H Y,Wang L S.Advances in apoptosis pathway[J]. Foreign Med Sci Sect Pathophysiol Clin Med, 2003,23(5):491-2. |
| [13] | Fleisch V C, Leighton P A, Wang H, et al. Targeted mutation of the gene encoding prion protein in zebrafish reveals a conserved role in neuron excitability [J]. Neurobiol Dis,2013, 55:11-25. |
| [14] | 王昌正,曹 诚,马清钧,等.凋亡诱导因子(AIF)对细胞凋亡的调控[J].生命的化学,2005,25(6):454-6.Wang C Z, Cao C, Ma Q J, et al. The regulation of apoptosis by apoptosis-inducing factor[J].Chem Life,2005,25(6):454-6. |
| [15] | 张 军,胡大海.AIF诱导细胞凋亡[J].医学分子生物学杂志,2008,5(1):87-90.Zhang J, Hu D H.AIF in apoptosis induction[J]. J Med Mol Biol, 2008,5(1):87-90. |


