


腺苷是一种内源性嘌呤核苷酸,广泛分布于机体内。腺苷是酶反应和细胞修复所需辅助因子的组成部分,也是一种独特的细胞调节物,其能影响机体内不同细胞的多种生理过程,从而调节不同组织器官的生理功能,几乎在所有的组织或器官中都可以发现腺苷受体(adenosine receptors,ARs)或由ARs介导的效应。
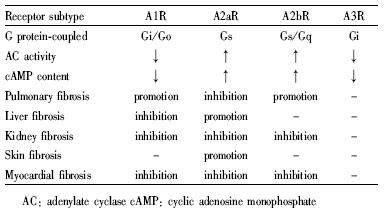
腺苷大多通过作用于细胞膜上的ARs来发挥相应的生理作用。ARs属G-蛋白偶联受体超家族,可分为4种亚型,即腺苷A1R、A2aR、A2bR和A3R。腺苷通过激活并结合细胞表面特异的ARs来调节腺苷酸环化酶(adenylate cyclase,AC)的活性,其中腺苷A1R和A3R可抑制AC的活性,使环腺苷酸(cyclic adenosine monophosphate,cAMP)水平降低;而腺苷A2aR和A2bR却可以激活AC的活性,使cAMP水平升高[1],从而产生一系列的生理效应。
随着ARs亚型选择性激动剂和拮抗剂的开发,人们对腺苷及其受体作用的多样性研究越来越深入,并逐步认识到腺苷及其受体在纤维化疾病中发挥着不可忽视的作用。近年来,关于ARs在纤维化疾病中的研究日益增多,本文就针对以下几种纤维化疾病进行讨论,为进一步的研究奠定理论基础。
1 肺纤维化肺纤维化是多种原因引发的,肺部多种细胞、细胞因子、细胞外基质(extracellular matrix,ECM)等因素相互作用导致的,肺成纤维细胞过度增殖、ECM过度沉积的肺部损伤。尤其是特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)长期以来被认为是一种进行性发展、不可逆的病理改变,且至今尚无有效的治疗策略来阻止其自然进程。IPF患者诊断后5年病死率达到65%,严重威胁公众健康[2]。
博来霉素气管内给药建立的肺纤维化模型是目前应用最广且最经典的肺纤维化动物模型。有文献报道在博来霉素诱导的肺纤维化模型中,选用磷酸二酯酶抑制剂喀利普兰可明显升高模型组血浆中cAMP含量,抑制肺组织中内皮素的过度表达,从而缓解肺纤维化症状[3]。cAMP含量的升高可直接影响ARs在肺纤维化疾病中的作用。有研究指出在慢性阻塞性肺病以及小鼠肺部疾病的模型中腺苷水平明显升高[4, 5],所以研究者推测,腺苷可能参与肺部疾病的发生发展。
腺苷的4个亚型在肺部疾病中发挥着不同的作用。当激活腺苷A1R时,可减少肺部缺血/再灌注造成的损伤[6]。在支气管狭窄的兔子模型中,使用腺苷A1R拮抗剂可大量减少腺苷和过敏原的产生。腺苷A1R可作为炎症因子参与支气管狭窄导致的肺纤维化疾病[7]。同时,已有文献证实运用腺苷A2aR激动剂可减少哮喘和慢性阻塞性肺部疾病的动物模型中肺部炎症的发生。例如,在卵清蛋白引起的大鼠肺炎模型中,运用腺苷A2aR激动剂CGS21680可抑制中性粒细胞和嗜酸性粒细胞的数量,从而减少支气管灌洗液的产生,减轻其向肺纤维化的发展趋势[8]。2012年,Folkesson等[9]的研究表明,使用腺苷A2aR激动剂 GW328267C 可以改善急性肺损伤大鼠的肺功能。这些研究证明了腺苷A2aR在肺部疾病中可起到保护作用。
在已知的4个腺苷受体中,腺苷A2bR具有诱导分化肺成纤维细胞的能力。在肺间质疾病患者和其他肺纤维化模型体内,腺苷A2bRmRNA和蛋白水平明显升高[10]。Harry等[11]的实验证实,在博来霉素诱导的小鼠肺纤维化模型中,腺苷A2bR与肺泡巨噬细胞中内皮素-1和IL-6的释放关系密切,使用腺苷A2bR特异性拮抗剂可明显减少内皮素-1和IL-6的释放,减慢肺纤维化的发展速度,而在博来霉素诱导的肺纤维化模型中,使用腺苷A2bR拮抗剂可明显减少气管内胶原的沉积和产生。同样,在用博来霉素分别刺激野生型C57BL/6小鼠和腺苷A2bR敲除小鼠的实验中证明了腺苷A2bR敲除小鼠的肺纤维化现象明显轻于野生型C57BL/6小鼠[12]。
2 肝纤维化肝纤维化是指由各种致病因子导致肝内结缔组织异常增生,肝内弥漫性ECM过度沉积的病理过程。在肝纤维化的发生发展中,肝星状细胞(hepatic stellates cell,HSC)起着主导作用。HSC处于肝实质细胞与窦状小管内皮层细胞之间,是人体内一类储存维生素A的细胞。正常情况下,HSC处于静息状态并且只产生少量的ECM用于基质膜的形成。当肝脏受到各种因素刺激时,通常静止的HSC经表型转化成为肌成纤维细胞,表达多种细胞因子及受体大量增殖,大量合成ECM,表达平滑肌α-肌动蛋白(α-SMA)。现今,α-SMAⅠ型胶原、Ⅲ型胶原的表达已被认为是HSC激活的明显特征之一,成为肝纤维化的重要评价指标。
HSC上的腺苷A2aR活化在肝纤维化疾病中扮演着重要的角色。有研究发现,经乙醇诱导后释放的大量腺苷通过激活HSC上的腺苷A2aR促进大鼠和人HSC胶原的合成[13]。已有报道指出,在LX-2人肝星形细胞株中,腺苷A2aR通过其偶联的Gs蛋白可上调 cAMP-PKA 信号通路,再分别经由其下游信号通路PKA-SRC-ERK1/2 MAPK和p38 MAPK诱导Ⅰ型胶原和Ⅲ型胶原的生成[14],证实腺苷A2aR与肝纤维化之间存在关系。近来有研究报道指出,使用腺苷A2aR拮抗剂可保护甚至逆转小鼠酒精性肝纤维化[15]。
近年来,有关腺苷A1R与肝纤维化之间存在关系的报道日益增多。2009年,Peng等[16]的研究表明,缺乏或阻断腺苷A1R可减少小鼠酒精性脂肪肝的发生,2010年也有同样的报道指出腺苷A1R特异性拮抗剂DPCPX可保护酒精诱导的肝脏疾病的发生[17]。
由于肝纤维化疾病的危害性,它的治疗得到了大家的广泛关注,其中咖啡的摄入量和肝纤维化间存在着一定关系的报道引起了大家的兴趣,咖啡的主要成分咖啡因是非选择性ARs拮抗剂,可以减少肝纤维化的发生和发展[18]。本课题组目前就腺苷A1R和A2aR信号通路介导酒精性肝纤维化中HSC活化增殖的作用机制及咖啡因的影响进行研究,观察腺苷A1R和A2aR在HSC中的表达及作用,以及其介导的cAMP和PI信号通路对HSC活化增殖的影响,并探讨两者相互联系以及咖啡因的作用,为进一步阐明乙醇致肝纤维化机制,以及如何合理利用ARs调节剂防治酒精性肝纤维化提供新的思路。课题组前期研究已表明,咖啡因对乙醛刺激的HSC-T6增殖具有抑制作用,且明显降低HSC-T6中CTGF和TGF-β1的表达水平[19],同时研究发现,咖啡因的此种作用可通过抑制腺苷A2aR介导的cAMP/PKA/Src/ERK1/2/p38 MAPK信号通路的活化而产生效应[20]。
3 肾纤维化肾纤维化是由于肾脏细胞受损,肌成纤维细胞的激活和基质蛋白的沉积,造成肾实质硬化。肾脏内的腺苷主要通过肾髓质氯化钠的转运和肾脏缺血引起的细胞内ATP途径产生。已有文献报道肾小球前内皮细胞、小管上皮细胞和间质纤维母细胞都可通过腺苷A1R介导的cAMP通路,在肾内反应性缺血中起重要作用[21],激活腺苷A1R可抑制AC,使cAMP的水平降低,导致肾血管的收缩,从而减少肾脏的血流。有文献证明,在运用腺苷A1R激动剂预处理缺血/再灌注损伤的C57BL/6小鼠24 h后发现,肾脏功能与运用腺苷A1R拮抗剂预处理的小鼠相比有明显的改善,且减少了炎症标记物的表达、组织坏死和细胞凋亡[22]。由于腺苷A2aR与A1R对AC的作用相反,激活腺苷A2aR可升高cAMP的水平,增加肾脏血流。有关研究表明,在大鼠肾纤维化模型中加入腺苷A2aR激动剂或阻断A2bR都可明显改善肾脏功能,缓解肾纤维化的发生[23, 24],这说明腺苷A2R在肾纤维化中发挥着重要作用。
4 皮肤纤维化真皮纤维化疾病是以胶原为主的ECM在真皮中过度聚集为特征的一组疾病。研究证实,细胞在缺氧、缺血及感染等病理过程中可产生大量腺苷,腺苷通过与ARs结合发挥对免疫应答及炎性反应的调控作用,腺苷可通过刺激胶原合成而促进创面愈合,腺苷A2aR的激活可以促进创面愈合,加重皮肤纤维化症状[25]。研究表明在皮肤纤维化疾病中腺苷A2aR的表达明显升高。利用腺苷A2aR拮抗剂可以减少纤维化组织中I型胶原的表达,加入腺苷A2aR激动剂则增加纤维化指标的表达。与单独用药组相比,腺苷A2aR激动剂和拮抗剂联合用药可明显逆转I型胶原的表达,且通过cAMP和AKT途径增加胶原的表达[26, 27]。同样有文献报道腺苷A2aR可通过CTGF介导的途径,增加皮肤纤维化组织中胶原的产生[28]。研究表明,腺苷A2aR基因敲除小鼠瘢痕转化生长因子β表达降低,瘢痕增生明显减轻[29]。CD39和CD73是腺苷A2aR发挥作用的重要因子之一,已有实验证实,在博来霉素导致的小鼠皮肤纤维化模型中敲除CD39/73,可减少腺苷的产生,同时缓解皮肤纤维化症状[30]。
5 心肌纤维化心肌纤维化是指心肌成纤维细胞增殖和胶原过度沉积,最终导致心脏功能障碍和不可逆性心力衰竭。心肌细胞过度增殖以及ECM合成增加可导致纤维组织增生甚至心肌纤维化。在心肌成纤维细胞中,腺苷可以抑制细胞增殖和减少胶原蛋白的合成,从而改善心力衰竭患者的心脏重建和间质纤维化[31]。
近年来已有研究表明腺苷A2bR在心肌纤维化方面有着重要作用[32],实验中发现在心肌成纤维细胞中腺苷A2bR的含量明显高于其他ARs,且通过cAMP通路发挥作用[33]。激活腺苷A2bR可增加心肌成纤维细胞腺苷的合成,减少心肌胶原蛋白的产生,降低纤维化的发生率,表明这种受体在心肌纤维化中起保护作用[34, 35]。同时也有文献报道,在结扎冠状动脉左前降支导致的心肌梗死大鼠中,激活腺苷A2bR可以减少心肌重构和心肌胶原蛋白产生,改善心脏功能[36]。此外,有文献表明,激活腺苷A1R可减慢心率和降低心肌收缩性,其通过减少心肌梗死和坏死来提高心肌对能量缺乏的耐受从而发挥保护心肌的作用[37]。近期研究表明,在狗的心脏衰竭模型中,已经证明使用腺苷A1R激动剂可明显改善其左冠状动脉的血液灌注及减少心肌的重构[38]。以上这些研究成果为我们治疗心肌纤维化疾病提供了新的方向。
6 结语纤维化疾病几乎可发生于人体的各个组织和器官,它的发病过程通常历时数月甚至数年不等,轻者成为纤维化,重者引起组织结构破坏而发生器官硬化,且组织纤维化已成为许多疾病致残、致死的主要原因,严重威胁着人类健康和生命。 在现阶段的医疗水平条件下,纤维化疾病一般可以通过器官移植得以治愈,然而目前所需的器官往往供不应求,因此只有极少数的患者能有幸得到根治,大多数患者将在等待移植器官的过程中死亡。近年来,ARs由于其复杂的生物学作用以及在多种疾病中的重要调节作用已受到越来越多的关注,本文就ARs在肺、肝、肾、皮肤、心肌几种常见的纤维化疾病中的作用及其功能相关的参数进行了阐述(Tab 1)。随着ARs在纤维化疾病发病机制中的研究不断深入,将会给临床合理用药、开发治疗纤维化有效的药物提供新的思路及方向,给深受纤维化疾病折磨的患者带来新的曙光。但目前大多数相关研究尚处于动物实验阶段,因此ARs调节剂在运用于临床抗纤维化疾病前仍需不懈努力地探索。
 |
| [1] | Hinton D J, McGee-Lawrence M E, Lee M R, et al. Aberrant bone density in aging mice lacking the adenosine transporter ENT1[J]. PLos One, 2014, 9(2):e88818. |
| [2] | 崔冰胡, 卓 伟. 抗纤维化药物治疗研究进展[J]. 生理科学进展, 2008, 39(3):233-8. Cui B H, Zhuo W. Study on anti-fibrotic drug therapy [J]. Adv Physiol Sci,2008, 39(3):233-8. |
| [3] | 潘金兵, 侯宇虹, 钱皓喻. 喀利普兰对肺纤维化大鼠内皮素水平的影响[J]. 郑州大学学报(医学版), 2012, 47(5):710-3. Pan J B, Hou Y H, Qian H Y. Rolipram to pulmonary fibrosis and endothelin levels of rats [J]. J Zhengzhou Univ (Med Sci), 2012, 47(5):710-3. |
| [4] | Schneider D J, Lindsay J C, Zhou Y, et al. Adenosine and osteopontin contribute to the development of chronic obstructive pulmonary disease[J]. FASEB J, 2010, 24(1):70-80. |
| [5] | Blackburn M R, Lee C G, Young H W, et al. Adenosine mediates IL-13-induced inflammation and remodeling in the lung and interacts in an IL-13-adenosine amplification pathway[J]. J Clin Invest, 2003, 112(3):332-44. |
| [6] | Della Latta V, Cabiati M, Rocchiccioli S. The role of the adenosinergic system in lung fibrosis[J]. Pharmacol Res,2013, 76:182-9. |
| [7] | Burnstock G, Brouns I, Adriaense D, Timmermans J P. Purinergic signaling in the airways[J]. Pharmacol Rev, 2012, 64:834-68. |
| [8] | Jacobson K A, Balasubramanian R, Deflorian F, et al. G protein-coupled adenosine (P1) and P2Y receptors:ligand design and receptor interactions[J]. Purinergic Signal, 2012, 8(3):419-36. |
| [9] | Folkesson H G, Kuzenko S R, Lipson D A, et al. The adenosine 2A receptor agonist GW328267C improves lung function after acute lung injury in rats[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(3):L259-271. |
| [10] | Zhou Y, Murthy J N, Zeng D, et al. Alterations in adenosine metabolism and signaling in patients with chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis[J]. PLos One, 2010,5, e9224. |
| [11] | Karmouty-Quintana H, Zhong H, Acero L, et al. The A2B adenosine receptor modulates pulmonary hypertension associated with interstitial lung disease[J]. FASEB J, 2012, 26:2546-57. |
| [12] | Zhou Y, Schneider D J, Morschl E, et al. Distinct roles for the A2B adenosine receptor in acute and chronic stages of bleomycin-induced lung injury[J]. J Immunol, 2011, 186(2):1097-106. |
| [13] | Chan E S, Montesinos M C, Fernandez P, et al. Adenosine A(2A)receptors play a role in the pathogenesis of hepatic cirrhosis[J]. Br J Pharmacol, 2006, 148(8):1144-55. |
| [14] | Che J, Chan E S, Cronstein B N. Adenosine A2A receptor occupancy stimulates collagen expression by hepatic stellate cells via pathways involving protein kinase A, Src, and extracellular sig-nal-regulated kinases 1/2 signaling cascade or p38 mitogen-activated protein kinase signaling pathway[J]. Mol Pharmacol, 2007, 72(6):626-36. |
| [15] | Chiang D J, Roychowdhury S, Bush K, et al. Adenosine 2A receptor antagonist prevented and reversed liver fibrosis in a mouse model of ethanol-exacerbated liver fibrosis[J]. PLos One, 2013, 8(7):e69114. |
| [16] | Peng Z, Borea P A, Varani K, et al. Adenosine signaling contributes to ethanol-induced fatty liver in mice[J]. J Clin Invest, 2009, 119(3):582-94. |
| [17] | Robson S C, Schuppan D. Adenosine:Tipping the balance towards hepatic steatosis and fibrosis[J]. J Hepatol, 2010, 52(6):941-3. |
| [18] | Stroffolini T, Cotticelli G, Medda E, et al. Interaction of alcohol intake and cofactors on the risk of cirrhosis[J]. Liver Int, 2010, 30(6):867-70. |
| [19] | 代雪飞, 吕雄文, 管文婕,等. 咖啡因对乙醛刺激的大鼠肝星状细胞HSC-T6增殖、凋亡的影响及部分作用机制[J].安徽医科大学学报, 2011, 46(8):772-5. Dai X F, LüX W, Guan W J, et al. Effect of caffeine on proliferation and apoptosis in HSC-T6 stimulated by acetaldehyde and its partial mechanisms[J]. Acta Unive Med Anhui, 2011, 46(8):772-5. |
| [20] | Wang H, Guan W J, LüX W,et al. Caffeine inhibits the activation of hepatic stellate cells induced by acetaldehyde via adenosine A2A receptor mediated cAMP/PKA/Src/ERK1/2/p38MAPK signal pathway[J]. PLos One, 2014, 9(3):e92482. |
| [21] | Jackson E K, Dubey R K. Roleof the extracellular cAMP-adenosine pathway in renal physiology[J]. Am J Physiol Renal Physiol, 2001, 281(4):F597-F612. |
| [22] | Lee H T, Gallos G, Nasr S H, et al. A1 adenosine receptor actibation inhibits inflammation, necrosis, and apoptosis after renal ischemia-reperfusion injury in mice[J]. J Am Soc Nephrol, 2004, 15(1):102-11. |
| [23] | Xiao H, Shen H Y, Liu W, et al. Adenosine A2A receptor:a target for regulating renal interstitial fibrosis in obstructive nephropathy[J]. PLos One, 2013, 8(4):e60173. |
| [24] | Dai Y, Zhang W, Wen J, et al. A2B adenosine receptor-mediated induction of IL-6 promotes CKD[J]. J Am Soc Nephrol, 2011, 22(5):890-901. |
| [25] | Altavilla D, Squadrito F, Polito F, et al. Activation of adenosine A2A receptors restores the altered cell-cycle machinery during impaired wound healing in genetically diabetic mice[J]. Surgery, 2011, 149(2):253-61. |
| [26] | Lazzerini P E, Natale M, Gianchecehi E, et al. Adenosine A2A receptor activation stimulates collagen production in sclerodermic dermal fibroblasts either directly and through a cross-talk with the cannabinoid system[J]. J Mol Med, 2012, 90(3):331-42. |
| [27] | Miguel P, Patricia F, Aranzazu M, et al. Adenosine 2A receptor promotes collagen production by human fibroblasts via pathways involving cyclic AMP and AKT but independent of Smad 2/3[J]. FASEB J, 2014, 28:802-12. |
| [28] | Chan S L, Liu H L, Patricia F, et al. Adenosine A2A receptors promote collagen production by a Fli1-and CTGF-mediated mechanism[J]. Arthritis Res Ther, 2013, 15(3):R58. |
| [29] | Katebi M, Fernandez P, Chan E S, et al. Adenosine A2A receptor blockade or deletion diminishes fibrocyte accumulation in the skin in a murine model of scleroderma, bleomycin-induced fibrosis[J]. Inflammation, 2008, 31(5):299-303. |
| [30] | Patricia F, Miguel P, Gideon S, et al. Extracellular Generation of adenosine by the ectonucleotidases CD39 and CD73 promotes dermal fibrosis[J]. Am Pathol, 2013, 183(6):1741-6. |
| [31] | Khashaba A, Mortada A, Omran A. Intracoronary versus intravenous adenosine-induced maximal coronary hyperemia for fractional flow reserve measurements[J]. Clin Med Insights Cardiol, 2014, 12(8):17-21. |
| [32] | 易 云, 高 云.腺苷A2B受体在心血管系统研究新进展[J]. 中国药理学通报, 2014, 30(1):21-4. Yi Y, Gao Y. Recent research progress of adenosine A2B receptor in cardiovascular system[J]. Chin Pharmacol Bull, 2014, 30(1):21-4. |
| [33] | Epperson S A, Brunton L L, Ramirez-Sanchez L, et al. Adenosine receptors and second messenger signaling pathways in rat cardiac fibroblasts[J]. Am J Physiol Cell Physiol, 2009, 296(5):C1171-7. |
| [34] | Dubey R K, Gillespie D G, Mi Z, Jackson E K. Exogenous and endogenous adenosine inhibits fetal calf serum-induced growth of rat cardiac fibroblasts:role of A2B receptors[J]. Circulation, 1997, 96(8):2656-66. |
| [35] | Dubey R K, Gillespie D G, Jackson E K. Adenosine inhibits collagen and protein synthesis in cardiac fibroblasts:role of A2B receptors[J]. Hypertension, 1998, 31(4):943-8. |
| [36] | Wakeno M, Minamino T, Seguchi O, et al. Long-term stimulation of adenosine A2b receptors begun after myocardial infarction prevents cardiac remodeling in rats[J]. Circulation, 2006, 114(18):1923-32. |
| [37] | 宗楷淇, 马增春, 高 月. 腺苷A1受体的作用研究进展[J]. 中国药理学通报, 2008, 24(5):573-6. Zong K Q, Ma Z C, Gao Y. Research progress on the role of adenosine A1 receptor [J]. Chin Pharmacol Bull, 2008, 24(5):573-6. |
| [38] | Sabbah H N, Gupta R C, Kohli S, et al. Chronic therapy with a partial adenosine A1-receptor agonist improves left ventricular function and remodeling in dogs with advanced heart failure[J]. Circ Heart Fail, 2013, 6(3):563-71. |

