连翘苷元(phillygenin)又称连翘脂素,为木犀科植物连翘中提取的木脂素类化合物单体。药理实验研究表明,连翘苷元是连翘中具有较强抗氧化活性的木脂素类化合物,可以强有力地清除自由基[1],可以抑制低密度脂蛋白的氧化作用[2],对高密度脂蛋白的氧化也具有非常强的抑制作用[3]。连翘苷元具有抗炎活性,对脂多糖诱导RAW 264.7 细胞产生NO具有抑制作用[4]。连翘苷元可以明显抑制环腺苷磷酸二酯酶的活性[5]。连翘苷元可以减轻亚硝酸盐导致的肾脏上皮细胞LLC-PK1损伤,对过氧亚硝酸盐阴离子引发的相关疾病可能有治疗或预防作用[6]。
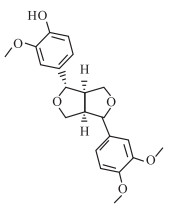
连翘苷元结构式如Fig1所示。连翘具有保肝作用[7, 8],连翘苷元又具有抗炎、抗氧化作用,作为连翘的活性成分,猜测连翘苷元对肝脏可能具有保护作用,本文运用CCl4致大鼠肝损伤模型研究连翘苷元的肝脏保护作用。
|
| Fig 1 Structure of phillygenin |
连翘苷元由鲁南制药中药共性技术国家重点实验室制备,纯度>99%,淡黄色粉末。联苯双酯滴丸:浙江万邦药业股份有限公司,每丸含联苯双酯1.5 mg,批号:A02130124。CCl4:国药集团化学试剂有限公司。超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性、谷胱甘肽(GSH)、丙二醛(MDA)检测试剂盒均购自南京建成生物工程研究所。TNF-α、IL-8 ELISA试剂盒购自Biosource公司。
1.2 仪器BS200型全自动生化分析仪、Sigma 3K15离心机(德国Sigma公司产品);Bullet Blender 快速组织细胞破碎仪(美国Next Advance公司);Multiskan GO酶标仪(美国Thermo公司产品)。
1.3 动物SD大鼠,♂,体质量180~220 g,购自北京维通利华实验动物技术有限公司,合格证号:11400700046285。在恒温(21~23) ℃、恒湿(45%~65%)、各12 h明暗周期的饲养室,同性别4只大鼠同笼饲养,用全价颗粒饲料喂养,自由进食和饮水。
2 方法 2.1 模型制备及给药方法健康♂SD大鼠48只,随机分为正常对照组、模型组、联苯双酯组(200 mg·kg-1,阳性对照)、连翘苷元低、中、高剂量组(0.05、0.15、0.5 mg·kg-1),每组8只。阳性对照组每天灌胃给药1次,连翘苷元组每天皮下注射给药1次,连续10 d,末次给药后,每只大鼠腹腔注射6 ml·kg-1以植物油配制的5%CCl4溶液[9]。
2.2 检测指标及检测方法造模后24 h,戊巴比妥钠麻醉后腹主静脉采血入分离胶促凝管,混匀,放置30 min,3 000 r·min-1离心10 min,取血清,全自动生化分析仪检测血清ALT、AST活性和TBIL含量;ELISA法检测血清TNF-α、IL-8含量;采血后放血处死,取肝脏,称总重,计算肝脏指数;取左叶肝脏加生理盐水1 ∶ 9制作组织匀浆,2 500 r·min-1离心10 min,取上清测定SOD、GSH-Px、GSH活性、蛋白含量、MDA含量。取右叶肝脏,以10%福尔马林溶液固定,石蜡包埋,HE染色,做病理组织学检查,根据文献方法进行病理学评分[10]。
2.3 数据处理 实验数据均以 表示,用ANOVA 进行统计学检验。
表示,用ANOVA 进行统计学检验。
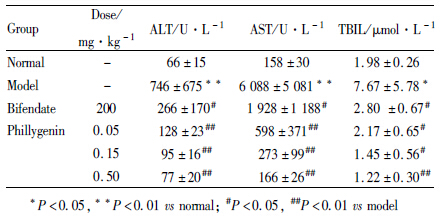
与正常对照组相比,模型组及各给药组连续给药10 d,腹腔注射CCl4 24 h后,大鼠血清中ALT、AST活性和TBIL含量均明显升高。联苯双酯(200 mg·kg-1)可明显降低血清中ALT和AST的活性和TBIL含量;连翘苷元(0.05、0.15、0.5 mg·kg-1)可明显降低肝损伤大鼠血清中ALT和AST的活性,明显降低TBIL含量,效果明显优于联苯双脂,见Tab1。
与正常对照组相比,模型组及各给药组连续给药10 d,腹腔注射CCl4 24 h后,模型组肝组织中SOD、GSH和GSH-Px的活性明显下 降,联苯双酯(200 mg·kg-1)可明显升高肝组织中SOD、GSH和GSH-Px的活性,连翘苷元低、中、高剂量组SOD和GSH的活性均明显升高,其中连翘苷元(0.5 mg·kg-1)组GSH活性高于正常组,连翘苷元中、高剂量组GSH-Px的活性均明显升高。经CCl4损伤后,大鼠肝组织中脂质过氧化产物MDA含量明显增加,说明大鼠肝细胞损伤严重,联苯双酯(200 mg·kg-1)可明显减少MDA的产生,连翘苷元也可抑制MDA的产生,减轻细胞的损伤。见Tab2。
 , n=8)
, n=8)
 |
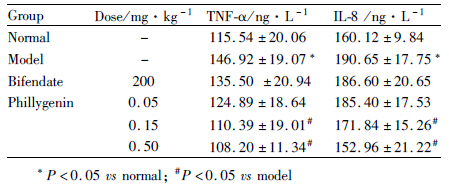
与正常对照组相比,模型组及各给药组连续给药10 d,腹腔注射CCl4 24 h后,模型组血清中TNF-α、IL-8明显上升,联苯双酯(200 mg·kg-1)对上述细胞因子没有明显降低作用,连翘苷元(0.15、0.5 mg·kg-1)组可以明显降低TNF-α、IL-8含量。见Tab3。
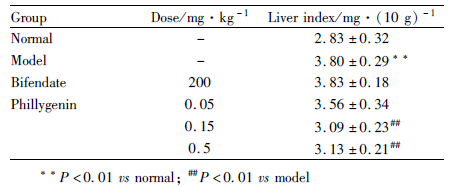
对照组肝脏形态正常,被膜光滑、色泽红润、质地柔软。模型组肝脏明显肿胀,色泽黄白,肝组织呈颗粒状,表面可见弥漫性出血点及散在淤斑,质地偏硬,肝脏指数明显增加,其余各组肝脏表面散在点、片状出血点,面积较模型组小,联苯双酯对肝脏指数影响不明显,连翘苷元(0.15、0.5 mg·kg-1)明显降低肝脏指数,见Tab4。
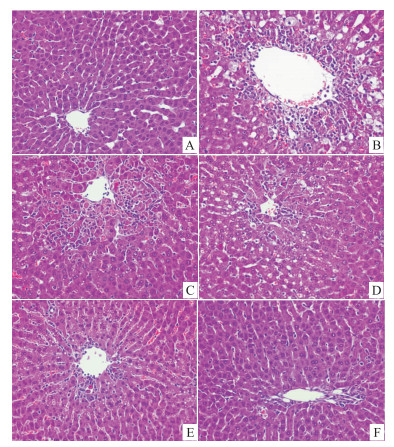
正常组大鼠肝小叶结构正常,肝索结构清晰可辨,肝细胞形态正常,未见肝细胞变性、坏死等。CCl4模型组肝脏小叶中心部明显坏死,坏死区周围可见肝细胞水肿及坏死,炎性细胞浸润,脂肪变性,有明显的点状和灶状坏死。给予连翘苷元后动物肝脏病变程度明显减轻,连翘苷元低剂量组及联苯双酯组肝病变程度稍有减轻,局部仍伴有肝细胞坏死,连翘苷元中剂量组大鼠肝细胞排列规则,肝小叶中心部仍可见肝细胞损伤,高剂量组结构同正常组无明显区别,无明显损伤。见Fig2。
|
| Fig 2 Effect of phillygenin on hepatic tissue of rats caused by CCl4 (×400) A: Normal group; B: Model group; C: Bifendate group; D: Phillygenin (0.05 mg·kg-1)group; E: Phillygenin (0.15 mg·kg-1)group; F: Phillygenin (0.5 mg·kg-1)group. |
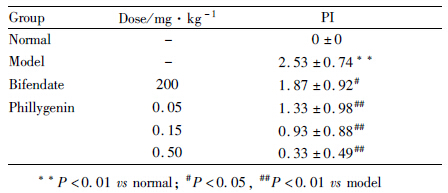
大鼠肝组织病理指数评分见Tab5,模型组病理指数明显高于正常组,表明肝损伤程度非常严重;各给药组病理指数明显低于模型组,其中,连翘苷元各剂量组病理指数明显低于模型组,连翘苷元(0.15、0.5 mg·kg-1)肝脏病理指数明显低于联苯双脂组。
连翘具有抗菌、抗病毒、解热镇吐、降压利尿、抗肝损伤、抗内毒素等作用。常用连翘治疗风热感冒、 痈肿疮毒、淋巴结结核、尿路感染等症,为我国临床常用传统中药之一,具有较高的药用价值。连翘主要含有萜类、苯乙醇及其苷类、木脂素类、黄酮类和一些醇、酯、醚、醛、酮等类化合物,其中连翘苷、连翘脂素、齐墩果酸、芦丁、连翘酯苷是其作用的主要有效成分,其中连翘苷可被肠道细菌代谢为连翘脂素,连翘脂素可能是连翘的主要活性成分[11]。
本研究首次运用CCl4大鼠急性肝损伤的模型研究了连翘苷元对肝损伤的作用。CCl4是经典的化学性肝毒剂,腹腔注射致小鼠和大鼠肝损伤模型重现性好,既可以造成肝细胞实质性损伤(细胞变性和坏死),又可以引起肝功能异常。CCl4所致肝损伤中自由基的形成及引发的链式过氧化反应是其主要机制[12],肝细胞受到自由基攻击,细胞膜的通透性升高,导致细胞内酶释放,引起血清酶的升高,在血清酶检查中,ALT、AST反映肝实质损害及病变的活动性,即反映肝细胞有无变性和坏死。TBIL在周围组织产生后随白蛋白转运到肝脏,TBIL水平体现了肝脏对其摄取、结合和排泄的能力。CCl4导致肝细胞肿胀和炎性浸润,导致肝脏指数明显增加,本研究表明,CCl4注射后24 h,ALT、AST、TBIL明显升高,肝脏指数明显增加,对大鼠预先使用连翘苷元,其血清中AST、ALT较模型组含量明显降低,TBIL水平明显下降,肝指数明显降低。
GSH可清除H2O2、超氧阴离子,是GSH-Px的底物,为GSH-Px分解氢过氧化物所必需。很多能形成亲电子代谢产物的化学毒物如CCl4能直接或间接地攻击GSH,使其耗竭,因而GSH 含量的多少是衡量机体抗氧化能力的重要因素。SOD有消除自由基,防止自由基启动脂质过氧化的作用,是一种重要的抗氧化酶。脂质过氧化反应是肝损伤发生的重要机制,脂质过氧化的主要降解产物MDA可严重损伤肝细胞的细胞膜结构,导致肝细胞的肿胀、坏死。MDA的含量可反映脂质过氧化的程度。连翘苷元可提高CCl4所致急性肝损伤大鼠肝组织匀浆中SOD、GSH和GSH-Px的活性,降低其MDA的水平。提示连翘苷元可以通过提高机体抗氧化酶的活性,清除自由基,抑制脂质过氧反应,降低脂质过氧化主要产物MDA的产生,从而拮抗CCl4引起的氧化损伤,发挥其保护肝脏的作用。
TNF-α是由机体单核巨噬细胞等多种免疫细胞所产生的具有重要生物活性的细胞因子。正常情况下,TNF-α在机体内浓度较低,具有调节免疫应答、促进细胞生长分化等多种生理功能,而在病理状态下,如乙肝病毒感染,机体细胞因子网络失调,TNF-α水平发生改变,并随着浓度增高,可引起局部炎症反应,导致组织损害,甚至多器官、多系统损伤。研究表明在CCl4导致的急性肝损伤过程中,血清TNF-α水平升高[13]。CCl4所致肝损伤,类似肝脏的炎症损伤,IL-8在肝损伤严重时处于高活化状态,重型肝炎或肝损伤由于高活性的TNF-α诱导肝细胞、枯否氏细胞、内皮细胞合成大量IL-8,血清中及肝组织局部的IL-8能促进肝脏的炎症反应[14]。本实验结果显示,模型组TNF-α和IL-8水平明显升高,连翘苷元可以降低TNF-α 和IL-8水平,提示连翘苷元可能通过抑制TNF-α和IL-8释放保护肝脏。
综上所述,连翘苷元具有明显的肝保护作用,在设定的剂量范围内,随剂量增加对肝损伤的保护作用增加,连翘苷元(0.5 mg·kg-1)剂量组的ALT、AST、TBIL已达到正常水平,肝指数和正常组没有明显差异。肝脏组织病理学检查结果也表明随剂量增加肝脏损伤程度明显减轻,连翘苷元(0.5 mg·kg-1)组已几乎与正常组没有差异,说明在这一剂量下连翘苷元对CCl4所致肝损伤起到了完全的阻止作用。SOD、GSH及GSH-Px的活性检测结果也显示高剂量组抗氧化酶的活性已经达到甚至超过正常水平,脂质过氧化物MDA则低于正常,说明连翘苷元可以通过提高肝脏抗氧化酶的活性,降低脂质过氧化物的含量,对CCl4致肝损伤起保护作用。另外,连翘苷元可以抑制炎症因子如TNF-α和IL-8的释放,减轻炎症因子对肝脏的损伤作用,从而对肝脏发挥保护作用。连翘苷元保肝效果明显,具有较好的对肝损伤保护作用的开发前景。
| [1] | Hung C Y, Tsai Y C, Li K Y.Phenolic antioxidants isolated from the flowers of Osmanthus fragrans[J].Molecules, 2012, 17(9):10724-37. |
| [2] | Chen C C, Chen H Y, Shiao M S, et al.Inhibition of low density lipoprotein oxidation by tetrahydrofurofuran lignans from Forsythia suspense and Magnolia coco[J].Planta Med, 1999, 65(8):709-11. |
| [3] | Chang M J, Huang T M, Min B S, et al.Lignans from the fruit of Forsythia suspense (Thunb.) Vahl protect high-density lipoprotein during oxidative stress[J].Biosci Biotechnol Biochem, 2008, 72(10):2750-5. |
| [4] | Lee D G, Lee S M, Bang M H, et al.Lignans from the flowers of Osmanthus fragrans var.aurantiacus and their inhibition effect on NO production[J].Arch of Pharmacol Res, 2011, 34(12):2029-35. |
| [5] | Nikaido T, Ohmoto T, Kinoshita T, et al.Inhibition of cyclic AMP phosphodiesterase by lignans [J].Chem Pharmaceut Bull, 1981, 29(12):3586-92. |
| [6] | Piao X L, Cho E J, Cho E J, et al.Cytoprotective effect of lignans from Forsythia suspensa against peroxynitrite-induced LLC-PK1 cell damage[J].Phytother Res, 2009, 23(7):938-42. |
| [7] | 杨建雄, 刘静.连翘叶茶保肝作用的实验研究[J].陕西师范大学学报(自然科学版), 2005, 33(3):82-5. Yang J X, Liu J.Experimental on effect of protecting liver of Forsythia Suspensa leaves tea[J].J Shaanxi Norm Univ (Nat Sci Ed), 2005, 33(3):82-5. |
| [8] | 徐春媚, 王文生, 曹艳红, 等.连翘护肝作用的实验研究[J].黑龙江医药科学, 2001, 24(1):11-2. Xu C M, Wang W S, Cao Y H, et al.Lianqiao:Protection of liver function[J].Heilongjiang Med Pharm, 2001, 24(1):11-2. |
| [9] | Jalali Ghassam B, Ghaffari H, Prakash H S, Kini K R.Antioxidant and hepatoprotective effects of Solanum xanthocarpum leaf extracts against CCl4-induced liver injury in rats[J].Pharm Biol, 2014, 52(8):1060-8. |
| [10] | 邓利娟, 李湛军, 罗楹, 范慧红.Caspase抑制剂F1013对刀豆蛋白A诱导小鼠急性肝损伤的治疗作用[J].中国药理学通报, 2012, 28(1):136-9. Deng L J, Li Z J, Luo Y, Fan H H.Therapeutical effect of the caspase selective inhibitor F1013 on ConA-induced acute hepatic injury in mice[J].Chin Pharmcol Bull, 2012, 28(1):136-9. |
| [11] | Ye L H, Li Y X, Peng C, et al.Determination of phillygenin in rat plasma by high-performance liquid chromatography and its application to pharmacokinetic studies[J].Eur J Drug Metab Pharmacokinet, 2013, 38(3):201-7. |
| [12] | Shah H, Hartman S P, Weinhouse S.Formation of carbonyl chloride in carbon tetrachloride metabolism by rat liver in vitro [J].Cancer Res, 1979, 39(10):3942-7. |
| [13] | Al-Harbi N O, Imam F, Nadeem A, et al.Carbon tetrachloride-induced hepatotoxicity in rat is reversed by treatment with riboflavin[J].Int Immunopharmacol, 2014, 21(2):383-8. |
| [14] | Hilld B, Marsano L, Mcccain C J.Increased plasma interleukin-8 concentrations in alcoholic hepatitis[J].Hepatology, 1993, 18(3):576-80. |