2. 省部共建新疆特种资源植物药重点实验室, 新疆 石河子 832002;
3. 石河子大学生命科学学院, 新疆 石河子 832002
2. Key Laboratory of Xinjiang Endemic Phytomedicine Resources, Ministry of Education, Shihezi University, Shihezi Xinjiang 832002, China;
3. School of Life Scisences, Shihezi University, Shihezi Xinjiang 832002, China
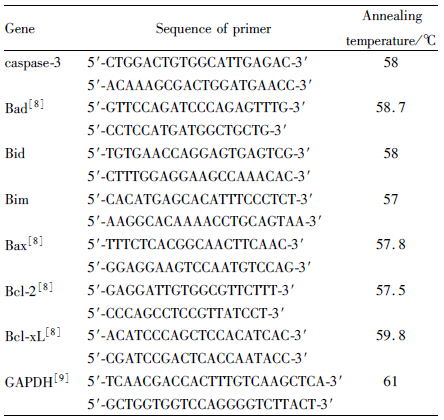
viniferin是葡萄等植物产生的一类以二苯乙烯骨架为主的多酚产物,因在抵抗病菌侵染时承担重要保护作用又称为葡萄抗毒素[1]。这类产物近年来被证明具有很好的抗氧化、心血管保护及抑制肿瘤血管新生等活性[2]。α-维尼非林(α-viniferin,Fig1)作为其中的典型代表被证实对白血病(leukemia)细胞的敏感程度较高[3]。但国内鲜有研究报道α- viniferin对白血病的药理作用。因此本研究拟以慢性髓系白血病K562细胞为模型,研究α-viniferin对K562细胞促凋亡作用与相关机制。
|
| Fig 1 Inhibitory rate of α-viniferin on K562 cells after |
人慢性髓系白血病K562细胞购自中国科学院上海细胞库;α-viniferin购自云南西力生物技术有限公司。RPMI 1640细胞培养基购自美国Gibco公司;新生牛血清购自杭州四季青生物工程材料有限公司。Giemsa染料、二甲基亚砜(DMSO)、吖啶橙(AO)、溴化乙锭(EB)购自美国Sigma公司;Hoechst 33258染料购自北京索莱宝科技有限公司;细胞凋亡线粒体膜电位检测试剂盒购自南京建成生物工程研究所;caspase-3、caspase-9荧光定量检测试剂盒购自美国Biovision公司;UNIQ-10柱式TRIzol总RNA提取试剂盒购自上海生工生物工程股份有限公司;cDNA逆转录试剂盒购自TaKaRa公司。
1.2 主要仪器CO2细胞培养箱(Thermo Forma,美国Thermo公司);Centrifuge 5430R、5424低温离心机(德国Eppendorf公司);Obsever A1倒置荧光显微镜(德国ZEISS公司);Varioskan Flash 3001多功能酶标仪(美国Thermo公司);PCR仪(德国Eppendorf公司)、UVP凝胶成像系统 (美国Spring公司)。
1.3 细胞培养K562 细胞采用含10%的新生牛血清 RPMI 1640,青霉素(100 kU·L-1) 和链霉素(50 mg·L-1),在 37 ℃、5% 的CO2孵育箱中培养,取对数生长期细胞用于实验。
1.4 α-viniferin对 K562 细胞增殖的抑制作用96孔培养板上每孔接种1×104个细胞,培养液体积为200 μL,实验组分别加入不同浓度(0、0.5、2、8、32、128 mg·L-1)的α-viniferin,对照组不加药,每组设 6 个复孔,37 ℃分别培养12、24、48 h,每孔加入 5 g·L-1 的MTT溶液20 μl,继续培养4 h,800×g离心5 min 弃上清,加入DMSO 150 μl,振荡10 min,酶标仪检测490 nm 处的吸光度(OD)值,并绘制相应的抑制率-浓度曲线[4]。
1.5 细胞凋亡检测6孔培养板上每孔种植 5×105个细胞,体积为3 ml,实验组加32 mg·L-1的α-viniferin,对照组不加药,37 ℃分别培养24 h,800×g离心5 min 弃上清收集细胞,分别用Hoechst 33258[5]、Giemsa[6]、AO/EB法染色[7],可见光、荧光观察拍照。
1.6 细胞凋亡线粒体膜电位检测不同浓度(0、2、8、32 mg·L-1)α-viniferin处理细胞24 h,收集细胞,取 500 μL JC-1工作液将细胞均匀悬浮,37 ℃,5% CO2的培养箱中孵育 15~20 min;室温离心(300×g,5 min),收集细胞,用1×孵育缓冲液洗2次;吸取500 μL 1×孵育缓冲液重新悬浮细胞;酶标仪对其进行荧光检测:激发光:488 nm,发射光:530 nm。
1.7 caspase-3、caspase-9活性检测药物诱导细胞凋亡。收集2×106个细胞。转移细胞到冷冻的50 μL cell lysis Buffer中,冰上孵育细胞10 min。每个样品加入50 μL的2 × Reaction Buffer(含10 mmol·L-1 DTT),加5 μL 1 mmol·L-1 LEVD-AFC底物(终浓度为50 μmol·L-1)。37 ℃孵育2 h。将样品转移至96孔板中,荧光检测:激发光:400 nm;发射光:505 nm。
1.8 α-viniferin对K562细胞凋亡相关基因mRNA表达的影响分别使用 α-viniferin (0、2、8、32 mg·L-1)处理24 h。本实验使用相对定量 RT-PCR方法来检测细胞凋亡相关分子Bad、Bid、Bim、Bax、Bcl-2、Bcl-xL的表达变化。使用 UNIQ-10柱式TRIzol总RNA提取试剂盒提取总 RNA,检测定量RNA水平及含量,并用cDNA反转录试剂盒将RNA逆转录为cDNA。PCR 扩增条件为: 热启动,起始温度 94 ℃,3 min; 变性 94 ℃,30 s; 复性 58 ℃,30 s; 延伸 72℃,45 s;扩增循环数40。PCR 产物经琼脂糖凝胶(2%) 电泳后,使用核酸染料染色,凝胶成像系统拍照分析。引物序列及退火温度见Tab1。
所有实验重复3次,采用SPSS 19.0统计软件分析,实验结果以 表示,各组间比较采用单因素方差分析及Dunnett法检验。
表示,各组间比较采用单因素方差分析及Dunnett法检验。
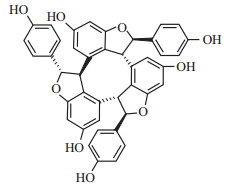
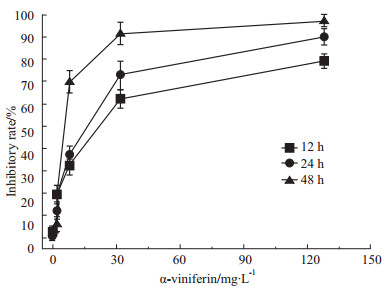
α-viniferin对K562细胞的抑制作用随作用浓度与时间增加而增强。如Fig2 所示呈现一定的时效与量效关系。浓度小于8 mg·L-1时α-viniferin对K562细胞的抑制率较低,大于此浓度时抑制率呈快速上升趋势。24 h半数抑制浓度(IC50)为13.61、128 mg·L-1 处理48 h细胞几乎全部死亡(抑制率为97.07%)。根据这些结果,后续实验选择药物浓度32 mg·L-1、处理时间为24 h进行研究。
|
Fig 2
Inhibitory rate of α-viniferin on K562 cells after treatment of 12,24 and 48 h ( , n=3) , n=3)
|
普通光镜下观察正常对照组K562细胞呈规则圆形、透明、折光性好,边界清晰光滑整齐,细胞大小均一(Fig3A、3E)。α-viniferin(32 mg·L-1)处理24 h后,K562细胞破裂且呈大小不均一的囊泡化特殊结构,折光性降低,边界模糊不完整,细胞出现明显凋亡形态(Fig3B)。细胞核DNA经Hoechst 33258荧光试剂染色后,空白对照组细胞核形态规则,呈弥散均匀的圆形荧光(Fig3C)。药物处理组则出现浓染致密的颗粒块状荧光,此现象则表现了凋亡所特有的核固缩、染色质高度凝聚和碎裂不均一化形态(Fig3D)。通过Giemsa染色可以看出药物处理组细胞边界不规则出现凋亡小泡(Fig3F)。经AO/EB双染可以看出α-viniferin处理K562细胞后出现早期凋亡和晚期凋亡,但未发现细胞坏死现象(Fig3F、3H)。
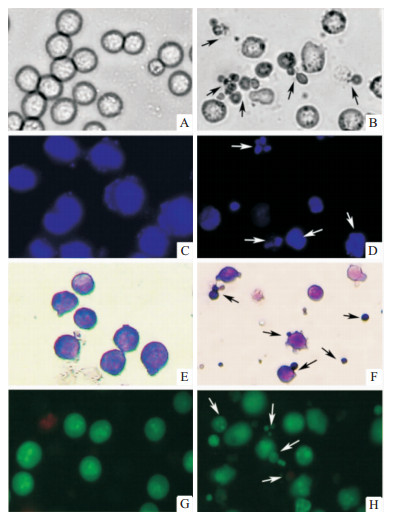
|
| Fig 3 Cellular morphological characteristic changes of K562 cells treated by α-viniferin (400×) A、C、E、G:K562 cells without α-viniferin treatments; B、D、F、H:K562 cells treated with 32 mg·L-1 α-viniferin for 24 h. |
α-viniferin引起K562细胞线粒体膜电势下降呈药物浓度依赖性变化(Fig4)。在α-viniferin浓度由2 mg·L-1至32 mg·L-1增加过程中,通过JC-1染色荧光强度检测,随药物浓度增加红色荧光逐渐减弱,绿色荧光逐渐增强,细胞内绿色/红色荧光强度比升高,表明该部分线粒体膜电势降低,并呈现浓度依赖关系。
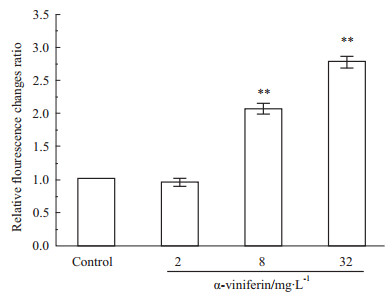
|
Fig 4
Cell mitochondrial membrane potential changes ( , n=3)
**P<0.01 vs control , n=3)
**P<0.01 vs control
|
如Fig5所示,正常对照组caspase-3、caspase-9活性较低,随着药物浓度增加细胞内caspase-3、caspase-9活性不断增加。caspase-9活性在2~8 mg·L-1时略有升高,在32 mg·L-1时活性明显高于其它给药组。而caspase-3的活性随着药物浓度增加而明显升高。
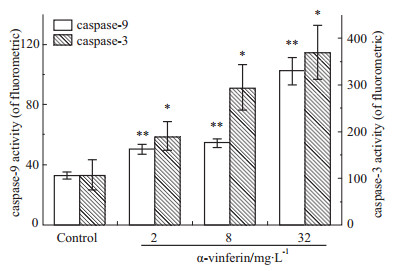
|
Fig 5
Analysis of cell caspase-3 and caspase-9 activity in response to K562 cells ( , n=3)
*P<0.05,**P<0.01 vs control , n=3)
*P<0.05,**P<0.01 vs control
|
如Fig6所示,不同药物浓度处理K562细胞后,细胞内caspase-3的表达量较空白对照组明显增加,这与Fig5中caspase-3活性随浓度升高而升高的现象相一致。Bcl-2家族中的 促凋亡基因Bad、Bid、Bim、Bax表达量均相对于空白对照组有所增加,其中Bax在32 mg·L-1处理后表达量显著增加。抗凋亡基因Bcl-2、Bcl-xL的表达量相对于对照组明显下降。
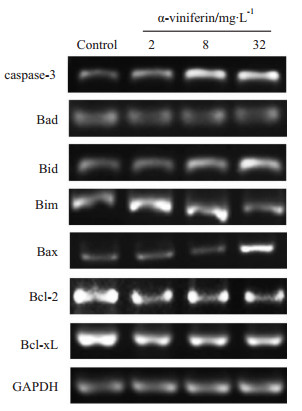
|
| Fig 6 Expression of apoptosis-related mRNA in different groups detected by semi-quantitative RT-PCR |
慢性粒细胞白血病K562细胞是一种危害性较大的恶性肿瘤细胞,其恶性表型为恶性克隆增殖性。化疗药物诱导K562细胞凋亡已经成为主要作用机制。
Sui等[10]研究报道,白藜芦醇对K562细胞的24 h半数抑制浓度为9 mg·L-1,而本实验研究发现α-viniferin作用K562细胞24 h后,IC50为13.61 mg·L-1。由此可见,在结构上α-viniferin虽为白藜芦醇的三聚体,但在药效学上,并不是白藜芦醇作用的简单叠加关系。由于结构不同α-viniferin很可能作用在细胞其他靶点而发挥其药效学作用。
体外实验研究证明,白藜芦醇可通过Fas/FasL途径[11]、Bcl-2家族蛋白[12]诱导caspase-3激活而引起K562细胞凋亡。在诱导凋亡过程中,白藜芦醇可下调Bcl-2,上调Bax,激活caspase-3。α-viniferin作为白藜芦醇的三聚体,国内外鲜有文献报道其对血系肿瘤细胞的影响,对于线粒体途径引起肿瘤细胞凋亡更是无文献报道。因此本文研究不同浓度的α-viniferin处理K562细胞24 h后,发现增殖抑制,形态学观察可见早期和晚期凋亡,但未发现细胞坏死现象。核固缩、染色质高度凝聚和碎裂,并伴有凋亡小体出现,为典型细胞凋亡现象。同时发现caspase-3 mRNA表达水平升高,凋亡相关基因Bax表达显著增强,Bcl-2表达下降。这些结果与白藜芦醇诱导肿瘤细胞凋亡现象相似。进一步证明α-viniferin可诱导K562细胞凋亡。Bax、Bcl-2是线粒体凋亡途径的重要调节分子。外界刺激因素引起细胞线粒体膜通透性改变,Bcl-2、Bcl-xL等下调,Bax、Bid、Bim、Bad等基因上调,进而使caspase家族出现凋亡级联反应,导致细胞发生凋亡反应[13]。本文发现,α-viniferin引起线粒体凋亡途径的关键蛋白酶caspase-9活性升高,线粒体膜通透性改变。上述研究结果表明,α-viniferin可通过线粒体凋亡途径诱导K562细胞凋亡。
综上所述,α-viniferin能抑制K562细胞增殖,并通过激活线粒体凋亡途径导致细胞凋亡。本研究指出了α-viniferin对K562细胞的致死类别与原因,对于这类化合物对白血病细胞的特殊敏感性,以及α-viniferin对白血病细胞的特异性方面仍需更多的证据。
| [1] | 孟旭辉, 张评浒, 张朝凤.芪类化合物及其合成酶的研究进展[J].中国野生植物资源, 2010, 29(3):15-20. Meng X H, Zhang P H, Zhang C F.Advance on the stilbenes and its synthase[J].Chin Wild Plant Res, 2010, 29(3):15-20. |
| [2] | 刘景磊, 陈韩英, 王晓琴, 等.ε-葡萄素抑制bFGF诱导血管新生作用分析[J].中国实验方剂学杂志, 2014, 20(13):164-8. Liu J L, Chen H Y, Wang X Q, et al.Analysis of inhibition of ε-viniferin on bFGF-induced angiogenesis [J].Chin J Exper Tradit Med Formul, 2014, 20(13):164-8. |
| [3] | NCI-60 DTP human tumor cell line screen.By National Cancer Institute.NO.NSC655524, 2012.http://dtp.nci.nih.gov/. |
| [4] | 易岚, 伍尤华, 谭晖, 等.二烯丙基二硫活化NADPH氧化酶诱导人白血病K562细胞凋亡[J].中国药理学通报, 2014, 30(8):1107-12. Yi L, Wu Y H, Tan H, et al.Diallyl disulfide induces apoptosis in human leukemia K562 cells through activation of NADPH oxidase[J].Chin Pharmacol Bull, 2014, 30(8):1107-12. |
| [5] | 缪珊, 张海, 石小鹏, 等.色胺酮对人白血病细胞株K562细胞增殖抑制、凋亡诱导的影响[J].中国药理学通报, 2009, 25(2):256-9. Miao S, Zhang H, Shi X P, et al.Induction of apoptosis by tryptanthrin on K562 cells[J].Chin Pharmacol Bull, 2009, 25(2):256-9. |
| [6] | 梁蓉, 王哲, 乔岩, 等.氨基葡萄糖硫酸盐对白血病细胞K562增殖的影响[J].中国药理学通报, 2003, 19(11):1226-30. Liang R, Wang Z, Qiao Y, et al.Inhibition of glucosamine sulphate on the proliferation of leukemia cell line K562[J].Chin Pharmacol Bull, 2003, 19(11):1226-30. |
| [7] | 杨帆, 孙秋艳, 刘亮亮, 等.维康醇诱导小鼠B16F0细胞凋亡的研究[J].中国药理学通报, 2013, 29(9):1269-74. Yang F, Sun Q Y, Liu L L, et al.Alteronol induced apoptosis of mouse melanoma B16-F0 cells[J].Chin Pharmacol Bull, 2013, 29(9):1269-74. |
| [8] | Tringali C, Lupo B, Cirillo F et al.Silencing of membrane-associated sialidase Neu3 diminishes apoptosis resistance and triggers megakaryocytic differentiation of chronic myeloid leukemic cells K562 through the increase of ganglioside GM3[J].Cell Death Differ, 2009, 16(1):164-74. |
| [9] | Ai W, Zheng H, Yang X, et al.Tip60 functions as a potential corepressor of KLF4 in regulation of HDC promoter activity [J].Nucleic Acids Res, 2007, 35:6137-49. |
| [10] | Sui T, Ma L, Bai X, et al.Resveratrol inhibits the phosphatidylinositide 3-kinase/protein kinase B/mammalian target of rapamycin signaling pathway in the human chronic myeloid leukemia K562 cell line [J].Oncology Letters, 2014(7):2093-8. |
| [11] | 郝春燕, 苏海翔, 魏虎来, 等.白藜芦醇通过Fas依赖途径诱导K562细胞凋亡[J].实用癌症杂志, 2004, 19(6):561-3. Hao C Y, Su H X, Wei H L, et al.Resveratrol induces apoptosis in K562 cells through a Fas-dependent pathway[J].Pract J Cancer, 2004, 19(6):561-3. |
| [12] | 温志震, 于宝海, 魏虎来, 等.白藜芦醇诱导K562细胞凋亡过程中Bcl-2蛋白水平的改变[J].中国临床药理学与治疗学, 2006, 11(4):421-3. Wen Z Z, Yu B H, Wei H L, et al.Changes of Bcl-2 expression in apoptosis induced by resveratrol in K562 cells[J].Chin J Clin Pharmacol Therapeut, 2006, 11(4):421-3. |
| [13] | Tsujimoto Y, Shimizu S.Bcl-2 family:life-or-death switch[J].FEBS Lett, 2000, 466(1):6-10. |