2. 皖南医学院药理教研室, 安徽 芜湖 241001;
3. 中国人民解放军海军安庆医院, 安徽 安庆 246003
 , LIU Xiao-yun1, ZHANG Wen1, XU Jing-hong2, 3, XING Wen1, WANG An-cai1, SONG Jian-guo2
, LIU Xiao-yun1, ZHANG Wen1, XU Jing-hong2, 3, XING Wen1, WANG An-cai1, SONG Jian-guo2 

2. Dept of Pharmacology Wannan Medical College, Wuhu Anhui 24100, China;
3. the PLA Navy Anqing Hospital, Anqing Anhui 246003, China
高血压是常见慢性病,也是心脑血管病最主要危险因素之一。合理地应用降压药物,长期、有效地控制血压,对于降低高血压患者心脑血管疾病的发病率和死亡率十分重要。但目前我国仍有约75%接受药物治疗的患者尚未达到《中国高血压防治指南》(2010版)所推荐的目标血压。对于大部分2、3级高血压患者,血压水平较高、并发多种代谢异常和靶器官损害者,需要联合用药才能获得理想疗效。联合用药已成为降压疗法的基本趋势,并为临床广泛接受[1]。
血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor blocker,ARB)与二氢吡啶类钙离子通道阻滞剂(calcium channel blocker,CCB)均属于WHO/国际高血压学会所推荐的五类一线降压药物,可用于各类高血压患者的治疗。两药联用,是优选联合降压方案之一,现已有首个缬沙坦/氨氯地平复方制剂上市 [1]。
昼夜节律是生物界最常见的生物节律。人体许多心血管系统功能参数如血压、心率等均呈昼夜节律波动,以适应昼夜不同活动水平的需求。正常生理状态下,人的血压昼夜节律表现为:清晨4 ∶ 00~5 ∶ 00开始上升,6 ∶ 00~8 ∶ 00达到全天的最高峰后平稳下降;16 ∶ 00~18 ∶ 00再次出现一个次高峰,其后血压缓慢持续下降至0 ∶ 00~2 ∶ 00达低谷并维持到4 ∶ 00~5 ∶ 00。全天血压呈现“昼高夜低、双峰一谷”的特点。根据夜间血压的下降情况,可将血压节律分为四种类型:①杓型:夜间血压较白昼降低10%~20%;②非杓型:夜间血压较白昼降低0~10%;③超杓型:夜间血压较白昼降低>20%;④反杓型:夜间血压不降低甚至高于白昼水平。除杓型外,其他3种模式均为异常血压节律。血压的杓型节律有益于适应机体活动规律并保护心脏的结构和功能。异常血压节律与高血压靶器官的损害及心血管事件发生率明显相关,是独立于血压水平之外的重要致病因素。具有非杓型血压节律的高血压患者被认为是易并发心脑血管疾病的高危群体[2]。
近年学界提出,全面的高血压治疗策略是在控制血压的同时恢复患者血压的正常昼夜节律[3, 4]。不同药物或同一药物在不同时间用药,对患者血压及其昼夜节律可能产生不同的影响。因此,根据患者的生活规律合理选药,是提高降压药疗效、降低不良反应的重要途径之一。
缬沙坦/氨氯地平复方制剂每日用药1次即可有效地降低患者血压,但何时用药才能产生最佳治疗效果,迄今尚未见报道。本研究旨在探讨该药于昼夜不同时间给药对高血压患者血压昼夜节律的影响,分析择时用药的利弊,为临床制定合理的用药方案提供参考。
1 材料与方法 1.1 研究对象2013年9月~2013年12月我院收治入院的非杓型原发性高血压患者12例。
1.2 药品与试剂缬沙坦/氨氯地平复方制剂(每片含氨氯地平5 mg,缬沙坦80 mg;商品名:倍博特),北京诺华制药有限公司;肾素酶联免疫检测试剂盒:上海源叶生物科技有限公司;血管紧张素II酶联免疫检测试剂盒:武汉华美生物工程有限公司;内皮素酶联免疫检测试剂盒:上海源叶生物科技有限公司。
1.3 方法 1.3.1 患者入选标准及分组 入选患者的收缩压(systolic blood pressure,SBP)≥140 mmHg,舒张压(diastolic blood pressure,DBP)≥90 mmHg;血压节律应为非杓型,即:杓型值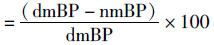 ≤10%(dmBP:白昼血压均值;nmBP:夜间血压均值),符合高血压诊断标准[5]。患者经询问病史、体检、胸透、心电图、超声心动图、眼底、尿常规等项检查,均属于1、2级低、中度危险因素高血压病患者。排除继发性高血压、器质性心脏病及内科严重疾病患者。12例患者按随机均衡原则分为2组。两组患者年龄、性别、入选时心率等指标差异均无显著性(Tab1)。两组患者分别于08:00或20:00口服倍博特1片,每日1次,连用1周。
≤10%(dmBP:白昼血压均值;nmBP:夜间血压均值),符合高血压诊断标准[5]。患者经询问病史、体检、胸透、心电图、超声心动图、眼底、尿常规等项检查,均属于1、2级低、中度危险因素高血压病患者。排除继发性高血压、器质性心脏病及内科严重疾病患者。12例患者按随机均衡原则分为2组。两组患者年龄、性别、入选时心率等指标差异均无显著性(Tab1)。两组患者分别于08:00或20:00口服倍博特1片,每日1次,连用1周。
两组患者分别于给药前及给药后d 3、7采用动态血压监测仪测定24 h血压,记录每2 h测定值。监测期间患者日常活动不受限,但应避免剧烈运动、情绪激动、焦虑,排除夜间睡眠差者。
1.3.3 生化指标测定采用酶联免疫吸附法检测血浆血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、血浆内皮素-1(endothelin-1,ET-1)、血浆肾素(plasma renin,PRA)水平,具体测定方法按各试剂盒说明书操作。
1.3.4 血压的时间生物学分析统一患者作息时间,06 ∶ 00~20 ∶ 00定为白昼,20 ∶ 00~6 ∶ 00(次日)定为夜间。主要分析指标:24 h平均收缩压和舒张压(24 h mSBP、24 h mDBP),白昼平均收缩压及舒张压(dmSBP、dmDBP),夜间平均收缩压和舒张压(nSBP、nDBP),杓型值。以余弦法拟合患者昼夜节律曲线并求算节律参数振幅(amplitude,A)、中值(median,M)及峰值相位Φ。
1.3.5 统计学分析 实验数据以 表示。采用SPSS 17.0进行统计分析,单因素方差分析比较多组参数之间的差异,两组间比较采用SNK法进行。
表示。采用SPSS 17.0进行统计分析,单因素方差分析比较多组参数之间的差异,两组间比较采用SNK法进行。
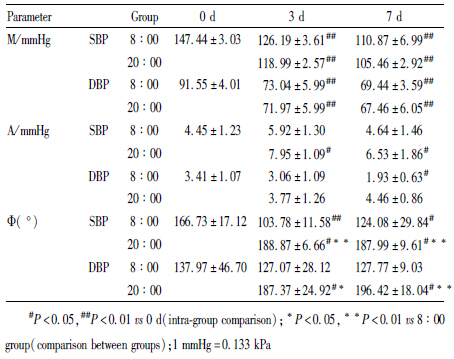
非杓型高血压患者的收缩压及舒张压均呈昼夜节律性变化。白昼血压高于夜间,并呈“双峰一谷”现象。收缩压的两峰值分别见于10 ∶ 00 [(153.17±3.19) mmHg]及18 ∶ 00[(154.00±2.52) mmHg];谷值见于2 ∶ 00[(140.50±6.24) mmHg]。峰谷值血压差异有显著性(P<0.01)。舒张压的峰、谷值模式与收缩压基本相似,12例患者最佳余弦曲线,收缩压为y(t)=147.44+4.45cos(15t-166.73°),舒张压为y(t)=91.55+3.41cos(15t-137.97°)(Fig1)。
|
Fig 1
Average cosine curves of blood pressure circadian rhythm in non-dipper hypertension patients ( ,n=12) ,n=12)
|
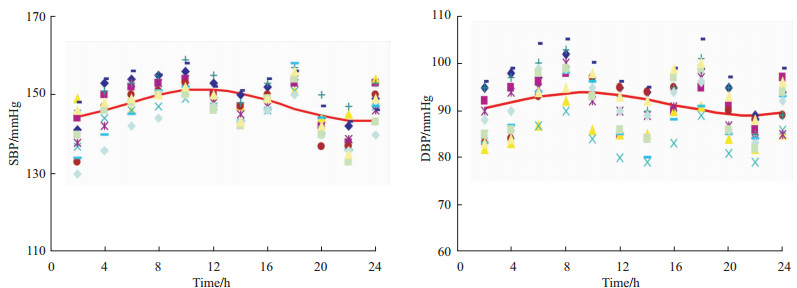
无论是8 ∶ 00给药还是20 ∶ 00给药,倍博特均能显著降低非杓型高血压患者的血压,且对收缩压降低更为明显。随着用药时间的延长,倍博特降压效果逐渐增强,用药3 d即可产生良好的疗效,使患者血压稳定在正常血压范围内。但用药时间不同,对患者昼夜节律峰相位的影响很大(P<0.01)。8 ∶ 00用药使峰相位前移;20 ∶ 00用药则使峰相位后移(Tab2、Tab3及Fig2)。
|
Fig 2
Average cosine curves of blood pressure circadian rhythm in non-dipper hypertension patients ( ,n=6)
A1-A2:8 ∶ 00 group dosing for 3d; B1-B2:20 ∶ 00 group dosing for 3 d;C1-C2:8 ∶ 00 group dosing for 7 d; D1-D2:20 ∶ 00 group dosing for 7 d;1 mmHg=0.133 kPa ,n=6)
A1-A2:8 ∶ 00 group dosing for 3d; B1-B2:20 ∶ 00 group dosing for 3 d;C1-C2:8 ∶ 00 group dosing for 7 d; D1-D2:20 ∶ 00 group dosing for 7 d;1 mmHg=0.133 kPa
|
 ,n=6)
,n=6)
 |
 ,n=6)
,n=6)
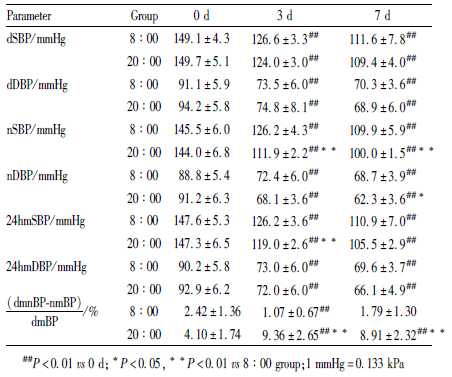 |
两组患者用药后d 3,SBP和DBP的昼夜均值及24h均值均下降(P<0.01),并随用药持续降低,至d 7达到较理想的控制水平。但20 ∶ 00用药组,于用药d 3对nSBP及24 h mSBP的降低作用明显大于8 ∶ 00用药组(P<0.01),且于用药d 7对nSBP及nDBP的降低作用仍大于8 ∶ 00用药组(P<0.05)。提示在相同剂量下,20 ∶ 00用药对夜间血压影响较大,且作用产生也较快。两时间点用药,对血压节律影响有极大差异,20 ∶ 00用药可以明显改善患者非杓型血压(P<0.01);而8 ∶ 00用药,则使患者非杓型血压有进一步加重倾向(Tab3)。
|
Fig 3
Influence of Exforge dosing time on plasma renin,angiotension Ⅱ and ET-1 levels in non-dipper hypertension patients ( ,n=6)
##P<0.01 vs 0d ,n=6)
##P<0.01 vs 0d
|
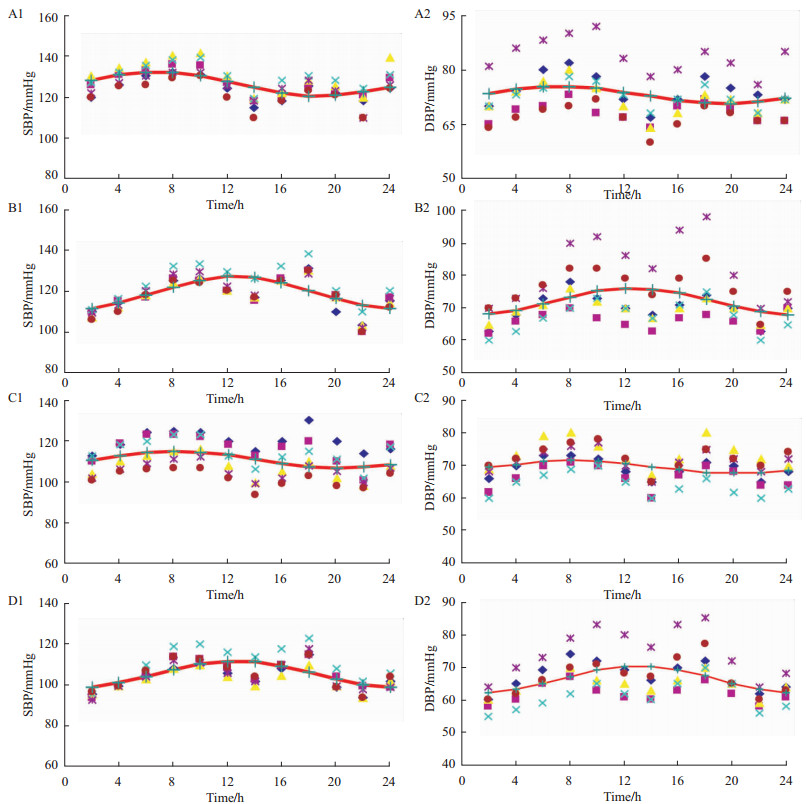
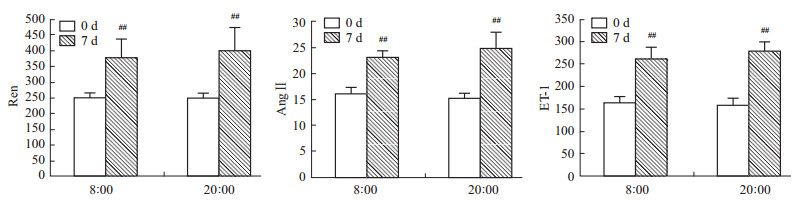
给药后7 d,患者血浆肾素、血管紧张素Ⅱ及内皮素-1水平均明显升高(P<0.01)。但8 ∶ 00组与20 ∶ 00组相比差异无统计学意义(P>0.05,Fig3)。
3 讨论血压的杓型昼夜节律对适应机体活动规律及保护心血管结构与功能必不可少,但许多原发性高血压患者血压的昼夜节律呈非杓型改变,即夜间血压下降不足10%,甚至高于日间白昼,出现逆转[6]。血压杓型节律的减弱或消失使患者的心、脑、肾等靶器官长时间处于高水平血液压力下,增加了靶器官受损害的风险,与心、脑、肾不良事件的发生率有密切关系[7]。
清晨时段是心脑血管病事件如心绞痛、心肌梗死、脑卒中等的高发期,血压的晨峰现象也被认为是诱发恶性心脑血管事件的重要因素之一。因此,能有效地抑制晨峰现象的降压治疗方案,可使多数心血管事件发生率大幅度下降[8]。
为更有效地改善高血压病患者的预后,近年来许多学者提出,全面的高血压治疗策略是在控制血压的同时恢复高血压患者血压正常的节律,并有效抑制清晨时段血压的快速上升[4, 9]。因此,在选择合理降压药物的同时,应选择合适的给药时间,使降压药物作用效应与高血压发生节律相一致,并能24 h 全程稳定地控制血压,恢复正常的杓型血压节律,减小血压节律的变异,从而减轻靶器官损害,降低心脑血管并发症的发生率。
研究显示,不同的降压药物,如利尿剂、血管紧张素转化酶抑制剂、血管紧张素受体拮抗剂及钙通道阻滞剂,用药时间不同对血压昼夜节律的影响也不相同[10]。RAAS系统抑制药及CCB类降压药,是临床上应用较为广泛的降压药物。回顾性研究结果显示,睡前给予尼群地平和雷米普利可将患者的非杓型血压昼夜节律调整为杓型模式,即适度降低患者夜间血压,并减少心血管事件的发生[11]。 MAPEC研究表明,睡前给予多种降压药物联合治疗,能更有效地控制血压,逆转非杓型血压的昼夜节律,降低心血管事件的发病率与死亡率[12]。然而,对于氨氯地平/缬沙坦复方制剂的时间药效学研究迄今尚未见报道。本研究发现,非杓型高血压患者收缩压及舒张压虽然也呈“昼高夜低、双峰一谷”的昼夜节律性变化,但昼夜血压变化幅度减小,血压振幅较低,表现为夜晚进入休息期血压仍维持较高水平,与白昼活动期相近。不同时间给药,倍博特降低非杓型高血压患者的血压的效果无明显差异,但8 ∶ 00给药使血压节律峰相位前移,20 ∶ 00给药则使峰相位后移。特别值得注意的是,对非杓型高血压患者,20 ∶ 00用药对夜间血压降低作用更强、更快,且可以使非杓型节律发生明显改善,使其逆转为接近杓型节律;而8 ∶ 00用药,则有使非杓型血压进一步加重趋势。因此,对于呈非杓型血压节律模式的高血压患者,于夜间休息期给药,可以获得良好的降压作用,同时有望纠正异常的非杓型血压节律,达到治疗的最佳效果。
目前关于血压昼夜节律的形成机制尚未完全阐明。现有资料表明,多种体液因子的昼夜变化对血压的昼夜节律有重要调节作用,其中主要包括血管内皮系统和RAAS系统。已知由血管内皮细胞产生的血管活性物质包括内皮依赖性舒张因子和收缩因子两大类。其中,ET-1与一氧化氮(nitrogen monoxide,NO)分别具有强大的收缩和扩张血管功能。在生理情况下,NO和ET-1呈动态平衡,共同调节血管的舒缩运动,从而调控血压的变化。正常成人血浆中的ET-1和NO水平呈典型的昼夜节律变化。高血压患者非杓型血压节律的形成过程中,常由于血管舒张因子如NO合成或释放障碍,同时伴有缩血管因子如ET-1水平上调;而ET-1水平升高又能促使血压的非杓型程度加重。血浆ET-1与各时间段舒张压高低呈显著正相关,与夜间舒张压的相关性最为显著[13, 14]。 RAAS本身亦具有明显的昼夜节律特征,并对血压的昼夜节律具有重要调节作用。RAAS过度活跃是转基因高血压大鼠模型血压节律异常的病理基础,表现为血浆血管紧张素转换酶活性明显升高,并呈现与正常大鼠相反的节律,24h血浆醛固酮和肾素含量分别是正常大鼠的4倍和7倍,白昼血浆皮质酮含量是正常大鼠的2倍,提示AngⅡ节律的反相紊乱是血压昼夜节律颠倒的主要病理基础,而白昼高水平的血浆皮质酮和肾素活性也参与血压昼夜节律的颠倒[15]。为观察血管紧张素对血压昼夜节律的作用,Schiffer等[16]将AngⅡ注入束缚应激的大鼠,发现注入AngⅡ期间血压的24h节律被颠倒,从而为AngⅡ参与血压昼夜节律的调节提供最直接的证据。
本研究发现,在实验研究周期内,不同时间给予倍博特均使AngⅡ、ET-1及肾素浓度增高,这可能是由于用药时间较短,倍博特所含缬沙坦抑制AngⅡ受体,短期内产生应激负反馈作用,使肾素、AngⅡ生成增多所致。若继续延长用药时间,应能降低AngⅡ、ET-1和肾素浓度。 此外,已有研究表明,血压昼夜节律与体内生物钟调控密切相关。生物体内各生物钟基因之间的相互作用形成一个相对保守的以转录-翻译为基础的自身调控反馈环路。Nonaka等[17]发现,小鼠的主动脉中Per2、Bmal1生物钟基因有明显的节律振荡,短暂给予AngⅡ可引起Per2基因的强烈表达,亦可引起生物钟其它成分呈同步周期性振荡,且这一作用受AT1受体介导(阻断该受体,Per2高表达现象消失)。同时,在离体培养的主动脉血管平滑肌细胞中,添加AngⅡ也能够诱导Per2、Bmal1等生物钟基因的表达。用AT1受体拮抗剂预孵育血管平滑肌1h,这种增强作用完全被抑制,说明AngⅡ受体拮抗剂可以抑制生物钟基因的表达。以上结果提示,AngⅡ可能参与其靶器官如主动脉、心脏、肾脏中生物钟基因表达的调节,以应答体内外环境的改变,这些改变可能导致血压昼夜节律失调。另外,有研究表明,AngⅡ与AT1受体结合后可激活蛋白激酶,通过MAPK信号通路致心肌肥大,而激活的磷酸化ERK可能通过影响PER2的表达来影响整个心肌细胞内时钟基因的昼夜节律性表达,进而引起细胞肥大,且AngII诱发的变化均可被替米沙坦所抑制[18]。因此,氨氯地平/缬沙坦复方制剂改善血压昼夜节律的分子机制与调节生物钟基因表达可能相关,但具体机制有待进一步研究。
| [1] | Waeber B, Ruilope L M.Amlodipine and valsartan as components of a rational and effective fixed-dose combination [J].Vasc Health Risk Manag, 2009, 5(1):165-74. |
| [2] | Takeda N, Maemura K.Circadian clock and cardiovascular disease [J].J Cardiol, 2011, 57(3):249-56. |
| [3] | Julius S, Kjeldsen S E, Weber M, et al.Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine:the VALUE randomised trial [J].Lancet, 2004, 363(9426):2022-31. |
| [4] | Allemann Y, Fraile B, Lambert M, et al.Efficacy of the combination of amlodipine and valsartan in patients with hypertension uncontrolled with previous monotherapy:the Exforge in Failure after Single Therapy (EX-FAST) study [J].J Clin Hypertens (Greenwich), 2008, 10(3):185-94. |
| [5] | 刘力生.中国高血压防治指南修订委员会.中国高血压指南2010[J].中华心血管病杂志, 2011, 39(7):579-615. Liu L S.Writing Group of 2010 Chinese Guidelines for the Management of Hypertension.2010 Chinese guidelines for the management of hypertension[J].Zhonghua Xin Xue Guan Bing Za Zhi, 2011, 39(7):579-615. |
| [6] | De la Sierra A, Redon J, Baneqas J R, et al.Prevalence and factors associated with circadian blood pressure patterns in hypertensive patients [J].Hypertension, 2009, 53(3):466-72. |
| [7] | Bastos J M, Bertoquini S, Silva J A, et al.Relationship between ambulatory blood pressure monitoring values and future occurrence of ischemic cerebrovascular and coronary events in hypertensive patients [J].Rev Port Cardiol, 2006, 25(3):305-16. |
| [8] | Rakugi H1, Kario K, Enya K, et al.Effect of azilsartan versus candesartan on morning blood pressure surges in Japanese patients with essential hypertension.[J].Blood Press Monit, 2014, 19(3):164-9. |
| [9] | Zeng J, Jia M, Ran H, et al.Fixed-combination of amlodipine and diuretic chronotherapy in the treatment of essential hypertension:improved blood pressure control with bedtime dosing-a multicenter, open-label randomized study[J].Hypertens Res, 2011, 34(6):767-72. |
| [10] | Mahabala C1, Kamath P, Bhaskaran U, et al.Antihypertensive therapy:nocturnal dippers and nondippers.Do we treat them differently? [J].Vasc Health Risk Manag, 2013, 9:125-33. |
| [11] | Lonn E, Shaikholeslami R, Yi Q, et al.Effects of ramipril on left ventricular mass and function in cardiovascular patients with controlled blood pressure and with preserved left ventricular ejection fraction:a substudy of the Heart Outcomes Prevention Evaluation (HOPE) trial [J].J Am Coll Cardiol, 2004, 43(12):2200-6. |
| [12] | Portaluppi F, Smolensky M H.Perspectives on the chronotherapy of hypertension based on the results of the MAPEC study [J].Chronobiol Int, 2010, 27(8):1652-67. |
| [13] | Elherik K, Khan F, McLaren M, et al.Circadian variation in vascular tone and endothelial cell function in normal males [J].Clin Sci, 2002, 102(5):547-52. |
| [14] | Parra D A, Lim D S, Buller C L, et al.Endothelial dysfunction and circadian blood pressure rhythmicity in young heart transplant recipients [J].Pediatr Cardiol, 2007, 28(1):1-7. |
| [15] | Lemmer B, Witte K, Enzminger H, et al.Transgenic TGR (mREN-2)27 rats as a model for disturbed circadian organization at the level of brain, the heart, and the kidneys [J].Chronobiol Int, 2003, 20(4):711-38. |
| [16] | Schiffer S, Pummer S, Witte K, et al.Cardiovascular regulation in TGR(mREN-2)27 rats:24h variation in plasma catecholamines, angiotensin peptides, and telemetric heart rate variability[J].Chronobiol Int, 2001, 18(3):461-74. |
| [17] | Nonaka H, Emoto N, Ikeda K, et al.AngiotensinⅡinduces Circadian gene experssion of clock genes in cultured Vascular smooth muscle cells[J].Circulation, 2001, 104(15):1746-8. |
| [18] | Cheng B1, Song J, Zou Y, et al.Responses of vascular smooth muscle cells to estrogen are dependent on balance between ERK and p38 MAPK pathway activities.[J].Int J Cardiol, 2009, 134(3):356-65. |