


2. 中国医科大学基础医学院神经生物教研室, 辽宁 沈阳 110001;
3. 中国医科大学附属盛京医院神经外科, 辽宁 沈阳 110004;
4. 中国医科大学附属一院神经内科, 辽宁 沈阳 110001
 , LIU Li-bo2
, LIU Li-bo2 
 , CHEN Fang-zhou3, LIU Yun-hui3, XUE Yi-xue2, LI Zhen3, LI Zhi-qing2, SHANG Xiu-li4
, CHEN Fang-zhou3, LIU Yun-hui3, XUE Yi-xue2, LI Zhen3, LI Zhi-qing2, SHANG Xiu-li4 2. Dept of Neurobiology, College of Basic Medicine, China Medical University, Shenyang 110001, China;
3. Dept of Neurosurgery, Shengjing Hospital of China Medical University, Shenyang 110004, China;
4. Dept of Neurology, the First Hospital of China Medical University, Shenyang 110004, China
脑胶质瘤是临床常见的原发性颅内肿瘤之一,恶性度高,预后差,严重影响人类健康。化疗是脑胶质瘤术后治疗的主要手段,但由于血肿瘤屏障(blood-tumor barrier,BTB)的存在,限制了大分子抗肿瘤药物进入中枢神经系统,严重影响了化疗效果[1]。前期,我们研究发现具有抑制肿瘤生长作用的物质内皮-单核细胞激活多肽Ⅱ (endothelial monocyte activating polypeptide Ⅱ,EMAP-Ⅱ)能够选择性开放BTB,增加药物转运进入肿瘤组织[2]。药物通过BTB进入脑组织的主要方式包括跨细胞途径和细胞旁途径,而蛋白、多肽等亲水性化疗药物主要通过开放紧密连接的细胞旁途径进入肿瘤组织[3]。近年,我们报道了EMAP-Ⅱ能够激活RhoA/ROCK途径,诱导细胞骨架重排和下调紧密连接相关蛋白表达,开放紧密连接,增加BTB的通透性[2, 4],但EMAP-Ⅱ激活RhoA/ROCK途径、下调紧密连接相关蛋白的具体分子机制尚不清楚。
腺苷单磷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)在调节细胞物质代谢中起重要作用[5]。肿瘤抑制因子肝激酶B1(liver kinase B1,LKB1)是AMPK的上游信号分子,通过磷酸化作用直接激活AMPK,AMPK激活后则抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的作用[6]。LKB1/AMPK/mTOR信号转导通路在多种常见肿瘤如胶质瘤、乳腺癌、前列腺癌、肝癌、肺癌及淋巴瘤等的研究中凸现出日益重要的作用,并且与胶质瘤的生长相关。本研究旨在验证EMAP-Ⅱ是否通过LKB1/AMPK/mTOR信号通路调控紧密连接开放,影响BTB的通透性。
1 材料与方法 1.1 试剂和仪器EMAP-Ⅱ (PeproTech公司);EGM-2 MV细胞培养液(Lonza公司);DMEM细胞培养液(Gibco 公司);bFGF、LKB1抑制剂radicicol、AMPK抑制剂compound C、mTORC1激活剂IGF1(Sigma公司);兔抗人ZO-1抗体和小鼠抗人occludin抗体(Life Technologies公司);小鼠抗人GAPDH抗体、辣根过氧化物酶标记的二抗和ECL化学发光检测试剂盒 (Santa Cruz公司)。主要仪器:多功能酶标仪(Molecular Devices,美国);电泳装置(Bio-Rad,美国);跨内皮电阻(transendothelial electrical resistance,TEER)测量系统(Millipore,美国)。
1.2 细胞培养人脑微血管内皮细胞(human cerebral microvascular endothelial cell line,hCMEC/D3)由法国巴黎第五大学Pierre-Olivier Couraud教授惠赠。人U87胶质瘤细胞由中国医科大学神经生物学教研室保存。分别用EGM-2 MV培养基5%胎牛血清和高糖DMEM培养基加10%胎牛血清培养hCMEC/D3和人U87细胞。
1.3 体外血肿瘤屏障模型的制作和处理根据Ma等[7]建立体外BTB模型的方法,将2×104个人U87胶质瘤细胞均匀接种于transwell的下室,培养2 d后,接种2×105个hCMEC/D3细胞于transwell上室建立体外BTB模型,共同培养4~6 d后hCMEC/D3细胞形成单层后使用。所有的细胞培养于37℃的湿润环境中(5% CO2和95%的空气)。
模型制备成功后,采用0.05 nmol·L-1的EMAP Ⅱ[4]作用0.5、1、2、3、6和12 h;应用LKB1抑制剂radicicol (10 μmol·L-1)[8]、AMPK抑制剂compound C (10 μmol·L-1)[8, 9]和mTORC1激活剂IGF1(100 μg·L-1)[10]分别进行20 min、20 min和24 h预处理后,再给予EMAP Ⅱ,进行后续实验。
1.4 跨内皮阻抗值的测定应用millipore 电阻测量系统在37℃恒温下检测血肿瘤屏障模型TEER的变化,所得结果为(TEER-背景电阻值)×生长面积(Ω · cm2)。
1.5 Western blot实验收集体外血肿瘤屏障模型的hCMEC/D3细胞,加入全蛋白裂解液裂解后获得蛋白,用考马斯亮蓝G-250结合法进行蛋白定量;等量蛋白样品(20 μg)经SDS-PAGE分离后,电转移到硝酸纤维素膜上,在5%脱脂奶粉中4℃封闭过夜;p-LKB1、LKB1、p-AMPK、AMPK、p-mTORC1、mTORC1、ZO-1、occludin和GAPDH抗体的稀释比例分别为1 ∶ 1 000、1 ∶ 1 000、1 ∶ 1 000、1 ∶ 1 000、1 ∶ 2 000、1 ∶ 2 000、1 ∶ 500、1 ∶ 300和1 ∶ 4 000,上述一抗分别与硝酸纤维素膜室温孵育2 h,辣根过氧化物酶标记的相应二抗(稀释比例为1 ∶ 5 000)室温孵育2 h后,用增强的化学发光法检测免疫复合物的表达。采用ChemiImager 5500 V2.03软件对蛋白条带进行扫描分析,结果以目的蛋白/β-actin的相对IDV (integrated density values)表示。
1.6 统计学分析 实验数据以 表示,用SPSS 13.0统计软件对数据进行分析。多组间比较采用One way ANOVA检验,两组间比较采用t检验。
表示,用SPSS 13.0统计软件对数据进行分析。多组间比较采用One way ANOVA检验,两组间比较采用t检验。
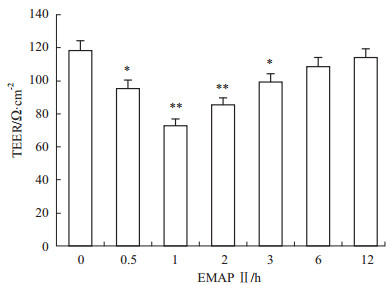
如Fig1所示,与EMAP Ⅱ 0 h组相比,EMAP Ⅱ作用0.5 h后,TEER值开始下降,在EMAP Ⅱ作用1 h时达最低值,之后TEER值逐渐回升,至12 h时可恢复至EMAP Ⅱ 0 h组水平。
|
Fig 1
Effect of EMAP-Ⅱ on TEER.
The BTB model in vitro was treated with EMAP Ⅱ for 0, 0.5, 1, 2, 3, 6 and 12 h ( , n=8) . *P<0.05, **P<0.01 vs EMAP-Ⅱ 0 h group values , n=8) . *P<0.05, **P<0.01 vs EMAP-Ⅱ 0 h group values
|
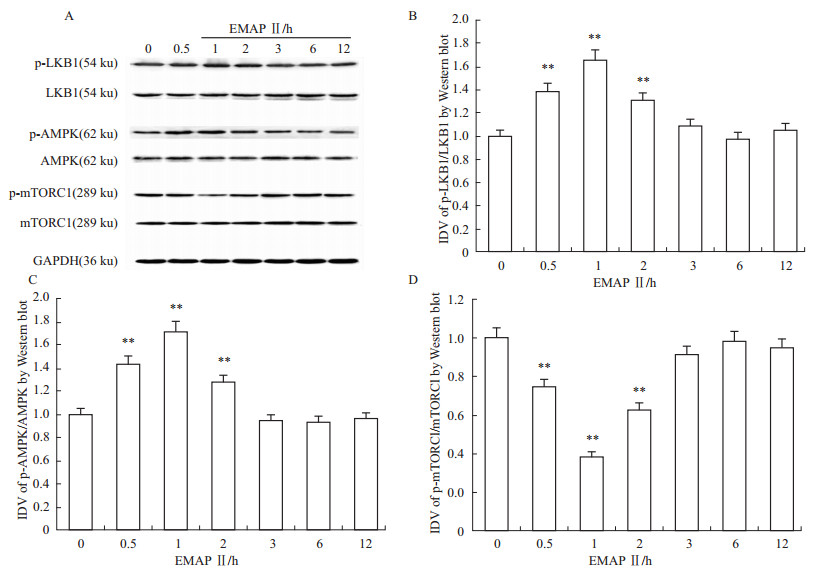
EMAP Ⅱ对LKB1、 AMPK 和mTORC1的磷酸化表达的影响如Fig2所示。EMAP Ⅱ作用后,体外BTB模型中微血管内皮细胞的LKB1、AMPK、mTORC1总蛋白水平未见明显改变;与EMAP Ⅱ 0 h组相比较,p-LKB1/ LKB1和p-AMPK/ AMPK在EMAP Ⅱ作用0.5、1和2 h 组表达水平明显增加,在EMAP Ⅱ作用3、6和12 h 组无明显改变;与EMAP Ⅱ 0 h组相比较,p-mTORC1/ mTORC1在EMAP Ⅱ作用0.5、1和2 h组表达水平明显降低,在EMAP Ⅱ作用3、6和12 h 组无明显改变;上述指标均在EMAP Ⅱ 作用1 h时效果最明显。
|
Fig 2
Western blot analysis of the expressing levels of p-LKB1/LKB1, p-AMPK/AMPK and p-mTORC1/mTORC1 in hCMEC/D3 after treatment with EMAP-Ⅱ ( , n=5)
**P<0.01 vs EMAP-Ⅱ 0 h group values , n=5)
**P<0.01 vs EMAP-Ⅱ 0 h group values
|
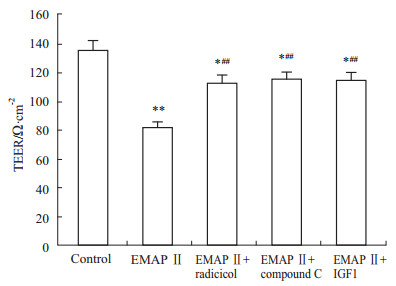
EMAP Ⅱ 作用前,给予LKB1抑制剂radicicol、AMPK抑制剂compound C和mTORC1激活剂IGF1进行预处理。如Fig3,与对照组相比,EMAP Ⅱ组,以及radicicol、compound C和IGF1预处理组均明显降低了体外血肿瘤屏障模型的TEER值,其中EMAP Ⅱ组降低最明显;与EMAP Ⅱ组相比,radicicol、compound C和IGF1有效阻断了EMAP-Ⅱ的作用,使TEER值明显增加。
|
Fig 3
Effect of EMAP-Ⅱ on TEER after radicicol, compound C and IGF1 pretreatment.
After pretreatment with radicicol, compound C and IGF1, the BTB model in vitro was treated with EMAP Ⅱ for 1 h ( , n=8) , n=8)*P<0.05, **P<0.01 vs control group values; ##P<0.01 vs EMAP-Ⅱ group values |
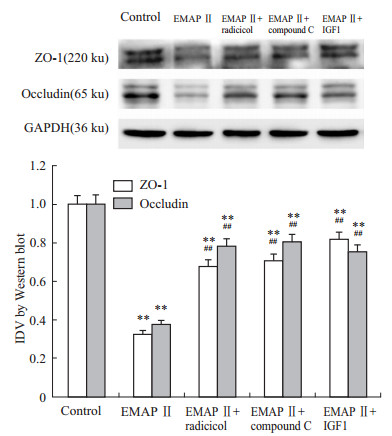
如Fig4所示,与对照组相比,EMAP Ⅱ 组,以及radicicol、compound C和IGF1预处理组均明显降低了紧密连接相关蛋白ZO-1和occludin的蛋白表达水平,其中EMAP Ⅱ组降低最明显;与EMAP Ⅱ组相比,radicicol、compound C和IGF1预处理能够有效阻断EMAP Ⅱ下调ZO-1和occludin蛋白表达的作用,使ZO-1和occludin的蛋白表达水平增高;上述结果与TEER值的变化趋势相似。
|
Fig 4
Pretreatment with radicicol, compound C and IGF1 before EMAP-Ⅱ, western blot analysis of the expressing levels of ZO-1 and occludin in hCMEC/D3 ( , n=5)
**P<0.01 vs control group values; ##P<0.01 vs EMAP-Ⅱ group values , n=5)
**P<0.01 vs control group values; ##P<0.01 vs EMAP-Ⅱ group values
|
本研究首次证明了EMAP Ⅱ能够通过激活LKB1/AMPK/mTORC1信号通路,下调紧密连接相关蛋白ZO-1和occludin的蛋白表达,从而增加血肿瘤屏障的通透性,LKB1/AMPK/mTORC1信号通路的抑制剂或激动剂部分阻断了EMAP Ⅱ增加血肿瘤屏障的通透性的作用。
研究证明EMAP Ⅱ是一种前炎性因子,具有促进肿瘤细胞凋亡、抑制肿瘤血管生成的作用[11]。在前期的研究中发现,EMAP-Ⅱ能选择性增加血肿瘤屏障的通透性,而对正常脑组织的通透性几乎没有影响[2]。在对EMAPⅡ选择性开放BTB机制的研 究中发现,EMAP Ⅱ能够通过RhoA/ROCK途径下调紧密连接相关蛋白表达的细胞旁途径[4];以及通过上调caveolin1和caveolin2表达的跨细胞途径,增加BTB的通透性[12]。
LKB1是一种丝氨酸/苏氨酸蛋白激酶,作为抑癌基因,参与细胞生长、分化、凋亡等多方面的调控。AMPK是LKB1最有代表性的底物,在细胞的能量代谢中处于中枢地位。AMPK激活后可以通过TSC2/TSC1复合体抑制mTOR活性,同时还能通过直接磷酸化mTOR结合蛋白Raptor (regulatory associated protein of mTOR)影响其活性。而mTOR则直接或间接参与了细胞增殖、生长和代谢有关的调控,处于复杂的细胞内信号转导途径的中心,整合了营养、能量、生长因子等众多信号来源,参与基因转录、凋亡、代谢、自噬以及血管形成的众多方面[13]。
研究发现,在血管内皮祖细胞内,EMAP Ⅱ能引起剂量依赖性的Ca2+迁移和动员[14]。在Ca2+诱导紧密连接相关蛋白的表达和分布的过程中,AMPK同时被激活[15]。在血管内皮细胞中,蛋白激酶C-ζ(PKC-ζ)可能通过磷酸化LKB1、促进其向胞质转移和与AMPK的相互作用,来促进LKB1/AMPK的激活[16]。我们研究小组发现,PKC-ζ参与了EMAP Ⅱ诱导BTB开放[17]。上述研究提示LKB1/AMPK/mTORC1信号通路可能参与EMAP Ⅱ选择性开放BTB的调控过程。我们的研究结果显示,EMAP Ⅱ作用能够明显增加p-LKB1/LKB1和p-AMPK/AMPK的表达,降低p-mTORC1/mTORC1的表达,在EMAP-Ⅱ作用1 h时变化最明显。这些结果证实,EMAP Ⅱ能够通过激活LKB1/AMPK/mTORC1信号通路增加血肿瘤屏障通透性。
ZO-1和Occludin是构成紧密连接的主要跨膜蛋白,对于维持血脑屏障结构和功能的完整性具有重要作用。我们前期报道了EMAP-Ⅱ作用下,体外血肿瘤屏障模型TEER值和紧密连接相关蛋白ZO-1、occludin的表达明显降低[4]。为了进一步明确LKB1/AMPK/mTORC1信号通路在EMAP Ⅱ选择性开放BTB的过程中所起的作用,在EMAP Ⅱ作用前,我们分别应用LKB1抑制剂radicicol、AMPK抑制剂compound C、mTORC1激活剂IGF1阻断该信号通路,结果显示radicicol、compound C和IGF1能够有效阻断EMAP Ⅱ作用,使体外BTB模型TEER值明显升高,以及紧密连接相关蛋白ZO-1和occludin的表达明显上调;上述结果表明,EMAP Ⅱ能够通过激活LKB1/AMPK/mTORC1信号通路开放紧密连接,进而增加BTB通透性。研究发现LKB1和AMPK激活后能够分别通过Rho及其下游信号分子MLC和cofilin诱导HeLa细胞和上皮细胞骨架重排[18, 19],研究证实激活RhoA/ROCK及其下游信号分子MLC和cofilin能够诱导脑微血管内皮细胞骨架重排,开放紧密连接[4],提示EMAP Ⅱ作用下,LKB1/AMPK/mTOR信号通路有可能通过Rho/ROCK调控细胞骨架重排,引起紧密连接开放,进而增加BTB的通透性。此外,我们的研究结果显示,radicicol、compound C和IGF1预处理并未完全阻断EMAP Ⅱ对TEER值和ZO-1、occludin蛋白表达的调控,与对照组相比,差异仍有统计学意义。这些研究结果提示,抑制LKB1/AMPK/mTORC1信号通路,只是部分抑制了EMAP Ⅱ增加BTB通透性的作用。说明LKB1/AMPK/mTORC1通路是EMAP Ⅱ明显增加BTB通透性的机制之一,可能还有其他机制。
综上所述,EMAP Ⅱ增加BTB通透性的过程与EMAP Ⅱ激活LKB1/AMPK/mTORC1通路相关,深入的相关研究可能为选择性增加BTB的通透性提供新靶点。
| [1] | Pardridge W M.Drug and gene delivery to the brain:the vascular route [J].Neuron, 2002, 36(4):555-8. |
| [2] | Xie H, Xue Y X, Liu L B, Liu Y H.Endothelial-monocyte-activating polypeptide Ⅱ increases blood-tumor barrier permeability by down-regulating the expression levels of tight junction associated proteins [J].Brain Res, 2010, 1319:13-20. |
| [3] | Salama N N, Eddington N D, Fasano A.Tight junction modulation and its relationship to drug delivery [J].Adv Drug Deliv Rev, 2006, 58(1):15-28. |
| [4] | Xie H, Xue Y X, Liu L B, et al.Role of RhoA/ROCK signaling in endothelial-monocyte-activating polypeptide Ⅱ opening of the blood-tumor barrier:role of RhoA/ROCK signaling in EMAP Ⅱ opening of the BTB [J].J Mol Neurosci, 2012, 46(3):666-76. |
| [5] | Tong X, Smith K A, Pelling J C.Apigenin, a chemopreventive bioflavonoid, induces AMP-activated protein kinase activation in human keratinocytes [J].Mol Carcinog, 2012, 51(3):268-79. |
| [6] | Chen N, Karantza V.Autophagy as a therapeutic target in cancer [J].Cancer Biol Ther, 2011, 11(2):157-68. |
| [7] | Ma J, Wang P, Liu Y, et al.Krüppel-like factor 4 regulates blood-tumor barrier permeability via ZO-1, occludin and claudin-5[J].J Cell Physiol, 2014, 229(7):916-26. |
| [8] | Hwang S L, Kim H N, Jung H H, et al.Beneficial effects of beta-sitosterol on glucose and lipid metabolism in L6 myotube cells are mediated by AMP-activated protein kinase [J].Biochem Biophys Res Commun, 2008, 377(4):1253-8. |
| [9] | Takata F, Dohgu S, Matsumoto J, et al.Metformin induces up-regulation of blood-brain barrier functions by activating AMP-activated protein kinase in rat brain microvascular endothelial cells [J].Biochem Biophys Res Commun, 2013, 433(4):586-90. |
| [10] | Wang Y, Wang W, Li D, et al.IGF-1 alleviates NMDA-induced excitotoxicity in cultured hippocampal neurons against autophagy via the NR2B/PI3K-AKT-mTOR pathway [J].J Cell Physiol, 2014, 229(11):1618-29. |
| [11] | 刘丽波, 孟繁杰, 薛一雪, 刘云会.内皮-单核细胞激活多肽对人U118胶质瘤细胞自噬的影响及机制[J].中国药理学通报, 2013, 29(7):922-6. Liu L B, Meng F J, Xue Y X, Liu Y H.Effects of endothelial-monocyte-activating polypeptide Ⅱ on autophagy of human U118 glioma cells [J].Chin Pharmacol Bull, 2013, 29(7):922-6. |
| [12] | Li Z, Liu Y H, Xue Y X, et al.Low-dose endothelial monocyte-activating polypeptide-Ⅱ increases permeability of blood-tumor barrier by caveolae-mediated transcellular pathway [J].J Mol Neurosci, 2014, 52(3):313-22. |
| [13] | Polewska J.Autophagy-molecular mechanism, apoptosis and cancer [J].Postepy Hig Med Dosw, 2012, 66:921-36. |
| [14] | Hou Y, Plett P A, Ingram D A, et al.Endothelial-monocyte-activating polypeptide Ⅱ induces migration of endothelial progenitor cells via the chemokine receptor CXCR3[J].Exp Hematol, 2006, 34(8):1125-32. |
| [15] | Zhang L, Li J, Young L H, Caplan MJ.AMP-activated protein kinase regulates the assembly of epithelial tight junctions [J].Proc Natl Acad Sci USA, 2006, 103(46):17272-7. |
| [16] | Xie Z, Dong Y, Zhang M, et al.Activation of protein kinase C zeta by peroxynitrite regulates LKB1-dependent AMP-activated protein kinase in cultured endothelial cells [J].J Biol Chem, 2006, 281(10):6366-75. |
| [17] | Li Z, Liu Y H, Xue Y X, et al.Signal mechanisms underlying low-dose endothelial monocyte-activating polypeptide-Ⅱ-induced opening of the blood-tumor barrier [J].J Mol Neurosci, 2012, 48(1):291-301. |
| [18] | Xu X, Omelchenko T, Hall A.LKB1 tumor suppressor protein regulates actin filament assembly through Rho and its exchange factor Dbl independently of kinase activity [J].BMC Cell Biol, 2010, 11:77-86. |
| [19] | Miranda L, Carpentier S, Platek A, et al.AMP-activated protein kinase induces actin cytoskeleton reorganization in epithelial cells [J].Biochem Biophys Res Commun, 2010, 396(3):656-61. |