


神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)是脊髓、大脑等神经系统中催化L-精氨酸(L-Arg)产生重要的神经介质——一氧化氮(nitric oxide,NO)的关键酶,nNOS在神经病理性疼痛的发生、发展过程中具有重要作用[1]。通过RNA干扰技术抑制nNOS的过度表达是治疗神经病理性疼痛的新途径。小干扰RNA(small interference RNA,siRNA)本身易被核酸酶降解、稳定性差、亲水性强且带负电,不易透过细胞膜进入胞内发挥作用。高效、安全siRNA递送载体的缺乏严重限制了RNA干扰技术的临床应用。
细胞穿透肽(cell penetrating peptides,CPPs)是一类由5~30个氨基酸组成的短肽,能将核酸片段、蛋白、多肽、噬菌体颗粒及磁性粒子等多种物质以非受体依赖的方式导入胞内,效率高、细胞毒性低,也不受细胞类型的限制[2]。CPPs与寡核苷酸形成的纳米复合物稳定性良好,在血清中不易被降解,转染效率甚至优于阳离子脂质体[3]。目前CPPs已在基因生物治疗、肿瘤靶向药物开发等领域逐步展现出诱人的前景,受到广泛关注[4]。
Tat(transactivator of transcription)是人类免疫缺陷病毒1型(HIV-1)基因编码的反式转录激活因子,是当前最受瞩目、研究最为深入的CPPs之一。Tat全长86个氨基酸,第49-57位(RKKRRQRRR)9个氨基酸是其发挥穿膜功能的核心序列[5]。Saleh等[6]发现该核心序列与膜活化多肽LK15(KLLKLLLKLLLKLLK)融合形成的细胞穿膜肽Tat-LK15运载siRNA转染细胞的能力为单独应用Tat时的2倍。因此,Tat-LK15或许可以作为一种良好的siRNA运载工具,明显优化RNA干扰技术在治疗神经病理性疼痛等方面的应用。
本研究在建立nNOS高表达的RGC-5视神经节细胞(retinal ganglion cell line,RGC-5)模型的基础上,探讨Tat-LK15运载siRNA沉默模型细胞nNOS基因表达的可行性,为后期在体应用RNA干扰技术抑制神经系统nNOS过度表达来治疗神经病理性疼痛提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试剂与仪器DMEM-高糖培养基(Hyclone,Cat.No.SH30022.01B),DMEM-低糖培养基(Hyclone,Cat.No.SH30021.01B),胎牛血清(Hyclone,Cat.No.SH30087.01),Opti-MEM(invitrogen,Cat.No.31985070),青、链霉素(Hyclone,Cat.No. SH30010),FAM-siRNA(上海吉玛),nNOS/siRNA和NCsiRNA(Sigma,美国),Tat-LK15(厦门博欣生物),LipofectamineTM RNAiMAX(invitrogen,13778075),anti-nNOS(Abcam,ab76067),Goat Anti-Rabbit IgG(Southern Biotech,4050-05),倒置光学显微镜(OLYMPUS CKX41,U-CTR30-2),倒置荧光显微镜(Leica,DMI6000B),流式细胞仪(BD,FACS Calibur),紫外分光光度计(艾本德,BioPhotometer plus),SYBR Green qPCR SuperMix(Invitrogen,15596-026),PCR仪ABI PRISM 7500(ABI),凝胶成像系统Doc Gel 2000型(BIO-RAD)。
1.1.2 细胞株与分组大鼠视神经节细胞RGC-5(广州莱德尔生物),制备高表达nNOS蛋白的RGC-5神经细胞模型。随机分为5组:对照组(正常细胞)、模型组(nNOS高表达)、Tat-S组(Tat-LK15运载nNOS/siRNA转染模型细胞)、Lipo-S组(Lipo运载nNOS/siRNA转染模型细胞)及Tat-N组(Tat-LK15运载NCsiRNA转染模型细胞)。
1.2 方法 1.2.1 siRNA序列与Tat-LK15nNOS双链siRNA正义链:5′-CAAGUUCCGCCUCACGUAUdTdT-3′,反义链:5′-AUACGUGAGGCGGAACUUGdTdT-3′;NCsiRNA正义链: 5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′。Tat-LK15序列:RKKRRQRRRGGGKLLKLLLKLLLKLLK,纯度95%,分子量:3 283.4 g·mol-1。
1.2.2 凝胶阻滞测定Tat-LK15/siRNA最佳交联比siRNA质量恒定为100 ng,Tat-LK15和siRNA以质量比为1 ∶ 3、1 ∶ 2、1 ∶ 1、2 ∶ 1、3 ∶ 1混合孵育20 min后上样,20%非变性聚丙烯酰胺凝胶,电压1.8 V·cm-1,低温电泳2 h。之后将凝胶在0.5 mg·L-1的EB溶液中染色45 min,观察并拍照。
1.2.3 细胞培养和转染细胞RGC-5细胞使用DMEM-高糖培养基(添加10%胎牛血清和1%青、链霉素),置于含5%CO2、37 ℃的细胞培养箱内培养。转染前1 d,取6孔板以细胞密度为每孔1×105个细胞接种,细胞培养至融合度为30%~50%时,去完全培养基,PBS洗2遍,加1 mL Opti-MEM培养基准备转染。Opti-MEM培养基500 μL稀释FAM-siRNA至终浓度50 nmol·L-1;Opti-MEM培养基500 μL稀释Tat-LK15,Tat-LK15与FAM-siRNA质量比为2 ∶ 1(最佳交联比)。孵育20 min后加到相应细胞培养板中,终培养基2 mL进行转染,4 h后去转染培养基,PBS洗2遍,加入完全培养基置于5%CO2、37 ℃细胞培养箱中。24 h后用荧光显微镜观察转染效果并拍照,流式细胞术检测转染效率,并与LipofectamineTM RNAiMAX (Lipo)5 μL相比较。
1.2.4 流式细胞术检测细胞转染效率转染24 h后收集细胞,重悬于预冷的1×结合缓冲液中使得其密度大约为每毫升1×106 细胞,流式细胞仪检测分析(激发波长为480 nm,发射波长为520 nm),计数10 000个细胞计算阳性细胞百分率,所有步骤避光进行。
1.2.5 流式细胞术检测细胞凋亡率提前1 d取6孔板以细胞密度1×105/孔接种培养。取Tat-LK15 1、2.5、5、10和20 μg分别孵育细胞24 h,并与正常细胞进行对照。处理结束收集细胞,PBS重悬,细胞密度约每毫升1×106个细胞。取0.5 mL离心去上清,加入500 μL 1×结合缓冲液混匀。再依次加入1.25 μL Annexin V-FITC,10 μL PI轻轻混匀;室温(18~24)℃避光反应15 min,1 h内检测。
1.2.6 制备高表达nNOS的细胞模型以缺氧缺糖(oxygen-glucose deprivation,OGD)和高盐(浓度145 mmol·L-1)的处理方式制备nNOS高表达的细胞模型[7]。将厌氧培养产气剂1包和厌氧指示剂放入方形培养罐制造缺氧模型,同时放入细胞培养板,以37 ℃、饱和湿度培养细胞。当指示剂在氧含量低于0.1%时(呈粉红色)开始计时,24 h后缺氧结束,置入普通培养箱复氧48 h后进行相关检测。
1.2.7 Tat-LK15/siRNA对nNOS的沉默效率造模成功后取5组细胞,siRNA终浓度为50 nmol·L-1,TAT-LK15与siRNA交联比为2 ∶ 1 (μg/μg),Lipo 5 mL。在造模缺氧24 h后取细胞板置于普通培养箱开始复氧,同时进行转染,复氧48 h(即转染48 h)后收集细胞检测nNOS mRNA和蛋白相对表达量。
1.2.8 Q-PCR检测nNOS mRNA收集细胞用TRIzol提取总RNA,紫外分光光度计测定总RNA纯度,逆转录合成cDNA。nNOS上游引物:5′-GGACGCTGGTGTATTCATCA-3′,下游引物:5′- AAGGCGATGGACTCAGATCT-3′ 扩增片段长度120 bp;β-actin上游引物:5′- AGGGAAATCGTGCGTGACAT-3′,下游引物:5′- GAACCGCTCATTGCCGATAG-3′ 扩增片段长度150 bp。PCR反应条件为:50 ℃ 热启动2 min,95 ℃预变性2 min后进入循环; 95 ℃变性15 s,60 ℃退火延伸读板32 s,共50个循环,设置3个复孔。以SDS v1.4软件对结果进行分析。
1.2.9 Western blot检测nNOS蛋白收集细胞,加入预冷的细胞裂解液提取蛋白,BCA法测定蛋白浓度。将调整的样品和上样缓冲液按4 ∶ 1混合,煮沸5 min蛋白变性;按每泳道总蛋白50 μg上样量进行SDS-PAGE电泳(分离胶浓度6%,浓缩胶浓度5%),待溴酚蓝电泳至接近分离胶底部时结束电泳。转膜,5%脱脂牛奶封闭,与稀释的anti-nNOS一抗(1 ∶ 1 000)4℃过夜,洗涤后再加入Goat anti-rabbit IgG二抗(1 ∶ 20 000)中37 ℃孵育1 h,漂洗后ECL显色,暗室进行曝光、显影和定影,经扫描后使用Gel-Pro analyzer分析软件分析蛋白条带灰度值,计算nNOS蛋白相对表达水平。
1.3 统计学处理 用SPSS 13.0统计软件进行统计学处理,实验结果以 表示,两样本采用独立样本t检验;多样本采用单因素方差分析。
表示,两样本采用独立样本t检验;多样本采用单因素方差分析。
非变性聚丙烯酰胺凝胶电泳显示,随着Tat-LK15剂量增加,核酸条带亮度逐渐变淡,当质量比为2 ∶ 1时电泳条带完全消失。说明在质量比2 ∶ 1(μg/μg)时,Tat-LK15已能充分交联siRNA(Fig1)。
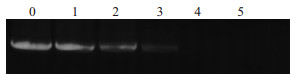
|
| Fig 1 Complex formation of Tat-LK15/siRNA electrophoresis 0: free siRNA; 1, 2, 3, 4, 5 respectively as complex formation Tat-LK15 and siRNA weight ratio of 1 ∶3, 1 ∶2, 1 ∶1, 2 ∶1 and 3 ∶1 (μg/μg). |
Tat-LK15与FAM-siRNA (50 nmol·L-1) 质量比为2 ∶ 1 (μg/μg) 时,流式细胞术检测其转染效率为(84.4±3.9)%,低于Lipo 5 μl的 (95.6±2.4)%(P<0.05),见Fig2、3 。
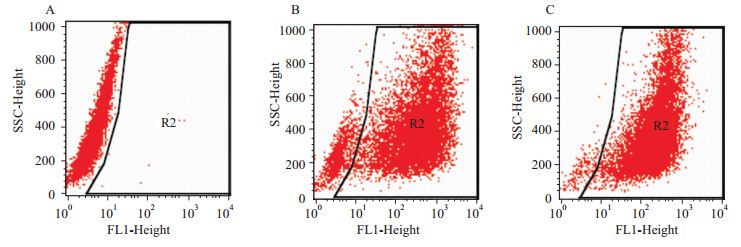
|
| Fig 2 Transfection efficiency examined by flow cytometry A:Blank group;B: Tat-LK15 and siRNA weight ratio of 2 ∶1(μg/μg);C:Lipo 5 μL. |
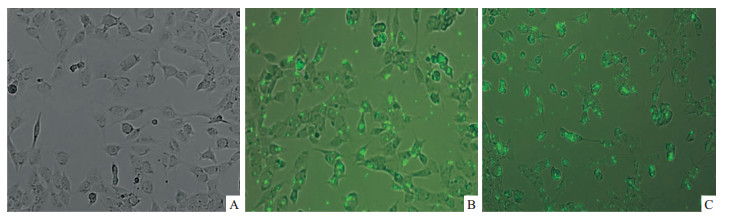
|
| Fig 3 Transfection of RGC-5 cells transfected with FAM-siRNA (Inverted fluorescence microscope×100) A: Blank group; B: Tat-LK15 and siRNA weight ratio of 2 ∶1 (μg/μg); C: Lipo 5 μL. |
Tat-LK15剂量增加到20 μg (6.1 μmol·L-1) 时,才开始出现一定的细胞毒性,细胞凋亡率高于对照[(10.3±1.1)% vs (7.4±0.9)%,P<0.05]。说明其细胞毒性低,具有良好的生物安全性(Tab1)。
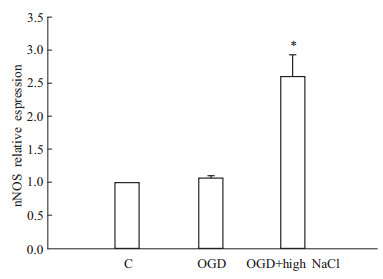
经过缺氧缺糖高盐处理后RGC-5细胞nNOS蛋白表达增高(P<0.05);单纯OGD处理nNOS表达无明显变化(P>0.05)。因此,缺氧缺糖高盐处理可以得到理想的nNOS高表达细胞模型(Fig4、5)。
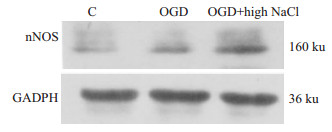
|
| Fig 4 Western blot of nNOS expression in RGC-5 cells exposed to OGD |
|
| Fig 5 Relative expression of nNOS protein in RGC-5 cells exposed to OGD C:Normal cells;OGD:Exposed to oxygen-glucose deprivation; OGD+high NaCl: Exposed to oxygen-glucose deprivation and 145 mmol·L-1 NaCl, *P<0.05 vs C group. |
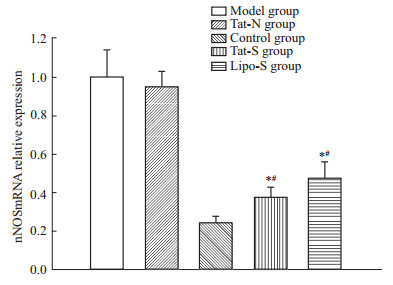
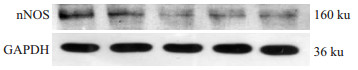
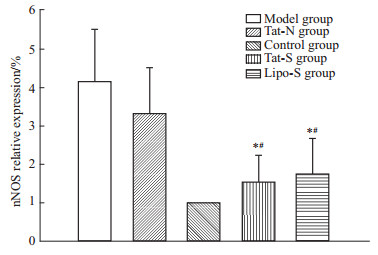
与模型组相比,Tat-S组nNOS mRNA表达降低63.1%,蛋白表达降低62.9%,差异有统计学意义(P<0.05)。Tat-N组与模型组,Tat-S组与Lipo-S组nNOSmRNA及蛋白表达水平无差异(P>0.05),见Fig6、7、8。
|
| Fig 6 Relative expression of nNOS mRNA in RGC-5 cells interfered by Tat-LK15/siRNA *P<0.05 vs model group;#P<0.05 vs Tat-N group. |
|
| Fig 7 Western blot of nNOS expression in RGC-5 cells in groups |
|
| Fig 8 Western blot of quantification of Tat-LK15 mediated nNOS knockdown in RGC-5 cells *P<0.05 vs model group;#P<0.05 vs Tat-N group. |
神经病理性疼痛是神经系统结构受损或功能障碍所导致的疼痛,是目前亟待解决的临床问题。nNOS在外周和中枢神经系统不同水平的过度表达是神经病理性疼痛形成、维持和发展的重要机制[8]。采用RNA干扰技术特异性沉默过度表达的nNOS则是治疗神经病理性疼痛的新思路。
要将siRNA成功导入细胞内并发挥干扰效应,安全高效的基因载体是关键。常用的siRNA载体包括病毒载体系统和阳离子脂质体等,前者可能导致严重的免疫反应,并有潜在的病毒体内复制扩散的风险[9];后者具有一定细胞毒性,干扰细胞代谢,动物实验表明,在体使用阳离子脂质体可诱发肺部炎症,甚至产生严重肺损伤[10]。而CPPs具转染效率高、无毒、无免疫性的特点,可将包括siRNA在内的多种物质以非受体依赖、非经典内吞的方式直接导入胞内,且不受细胞类型的限制。有研究证实,CPPs介导的寡聚核苷(oligonucleotides,ONs)可有效地抑制目的基因的表达,且不会激发体内的免疫反应,彰显了CPPs-Ons复合物在基因治疗领域的希望和巨大潜力[11]。
HIV-Tat是现今研究最广泛最深入的细胞穿透肽之一,Tat蛋白转导域已被广泛用于物质转运方面的研究,如化学合成Tat融合蛋白,或构建包含Tat和目的蛋白基因的质粒载体产生Tat融合蛋白,导入宿主细胞或用于在体研究等[12]。值得注意的是,目前随着Tat介导核酸跨膜转运的研究逐步深入。Park等[13]发现Tat能够携带质粒DNA穿过细胞膜进行基因转染,并对细胞活性无明显影响。Hyunmin 提出Tat-PAMAM融合蛋白可有效提高转导效率,成功用于介导抗体和siRNA的传送[14]。Eguchi等[3]通过结合一个双链RNA结合域(double strand RNA Binding Domain,DRBD)修饰的Tat蛋白结构域(即Tat-DRBD融合蛋白)可以包裹siRNA上的负电荷骨架,防止其沉淀聚集,从而改善Tat对siRNA的转染效率,甚至优于脂质体。Alain Pluen等证实Tat-LK15运载siRNA转染细胞的能力为单独应用Tat时的2倍。Arthanari等[15]则指出膜活化多肽LK15修饰的Tat(Tat-LK15)可高效地介导基因的传递,而细胞毒性在其浓度10 μmol·L-1时,即使用剂量的50倍才会开始出现。综上可见,Tat相关载体核酸转染效率高,细胞毒性低,在核酸转运方面可能具有良好的应用前景。
本研究发现Tat-LK15与siRNA质量比为2 ∶ 1时可完全包裹siRNA。Tat-LK15/siRNA在此交联比时转染RGC-5细胞的效率可达(84.4±3.9)%,低于Lipo的(95.6±2.4)%。Tat-LK15孵育RGC-5神经细胞时,增加Tat-LK15的剂量并没有引起明显的细胞毒性,仅当剂量增至实验剂量的10倍(20 μg)时才开始出现轻微的影响。构建nNOS高表达的细胞模型后,Tat-LK15/siRNA转染模型细胞,其nNOS mRNA表达降低63.1%,蛋白表达降低62.9%,效果与Lipo相当,甚至略优于Lipo。由此可见,尽管Tat-LK15的细胞转染效率略低于Lipo,但其细胞毒性极低,安全优势突出,且最终的转染效果并不亚于Lipo,可以作为运载siRNA干扰神经细胞nNOS表达的有效工具。本实验结果也为后期探讨Tat-LK15在体条件下运载siRNA干扰nNOS过度表达治疗神经病理性疼痛打下提供了理论依据。
综上所述,Tat相关载体作为最有应用前景的CPPs,在核酸转运等方面已经得到广泛的研究和关注,各类研究成果已逐步向临床应用等方面转化,相信经过不懈的努力,Tat相关载体做为有效的核酸转运手段,将在疾病的基因治疗等领域发挥不可低估的作用。
| [1] | Tanabe M, Nagatani Y, Saitoh K, et al.Pharmacological assessments of nitric oxide synthase isoforms and downstream diversity of NO signaling in the maintenance of thermal and mechanical hypersensitivity after peripheral nerve injury in mice[J].Neuropharmacology, 2009, 56(3):702-8. |
| [2] | Nasrollahi SA, Taghibiglou C, Azizi E, et al.Cell-penetrating peptides as a novel transdermal drug delivery system[J].Chem Biol Drug Des, 2012, 80(5):639-46. |
| [3] | Eguchi A, Dowdy S F.Efficient siRNA delivery by novel PTD-DRBD fusion proteins[J].Cell Cycle, 2010, 9(3):424-5. |
| [4] | Jafari M, Chen P.Peptide mediated siRNA delivery[J].Curr Top Med Chem, 2009, 9(12):1088-97. |
| [5] | Vives E, Brodin P, Lebleu B.A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus[J].J Biol Chem, 1997, 272(25):16010-7. |
| [6] | Saleh A F, Aojula H, Arthanari Y, et al.Improved Tat-mediated plasmid DNA transfer by fusion to LK15 peptide[J].J Control Release, 2010, 143(2):233-42. |
| [7] | Scorziello A, Pellegrini C, Secondo A, et al.Neuronal NOS activation during oxygen and glucose deprivation triggers cerebellar granule cell death in the later reoxygenation phase[J].J Neurosci Res, 2004, 76(6):812-21. |
| [8] | Zhou L, Zhu D Y.Neuronal nitric oxide synthase:structure, subcellular localization, regulation, and clinical implications[J].Nitric Oxide, 2009, 20(4):223-30. |
| [9] | Walther W, Stein U.Viral vectors for gene transfer:a review of their use in the treatment of human diseases[J].Drugs, 2000, 60(2):249-71. |
| [10] | Dokka S, Toledo D, Shi X, et al.Oxygen radical-mediated pulmonary toxicity induced by some cationic liposomes[J].Pharm Res, 2000, 17(5):521-5. |
| [11] | Andaloussi S E, Lehto T, Mager I, et al.Design of a peptide-based vector, PepFect6, for efficient delivery of siRNA in cell culture and systemically in vivo[J].Nucleic Acids Res, 2011, 39(9):3972-87. |
| [12] | 曲恒燕, 刘译源, 李媛媛, 等. TAT-tCNTF融合蛋白对Aβ25-35诱导SH-SY5Y细胞损伤的保护作用[J]. 中国药理学通报, 2010, 26(4):442-6. Qu H Y, Liu Z Y, Li Y Y, et al. Protective effects of TAT-tCNTF fusion protein on SH-SY5Y cells induced by β-amyloid peptide(25-35)[J]. Chin Pharmacol Bull, 2010, 26(4):442-6. |
| [13] | Park Y J, Liang J F, Ko K S, et al.Low molecular weight protamine as an efficient and nontoxic gene carrier:in vitro study[J].J Gene Med, 2003, 5(8):700-11. |
| [14] | Kang H, DeLong R, Fisher M H, et al.Tat-conjugated PAMAM dendrimers as delivery agents for antisense and siRNA oligonucleotides[J].Pharm Res, 2005, 22(12):2099-106. |
| [15] | Arthanari Y, Pluen A, Rajendran R, et al.Delivery of therapeutic shRNA and siRNA by Tat fusion peptide targeting BCR-ABL fusion gene in chronic myeloid leukemia cells[J].J Control Release, 2010, 145(3):272-80. |


