2. 南京中医药大学附属医院临床药理科, 江苏 南京 210029;
3. 南京军区总医院临床药理科, 江苏 南京 210002
 , SUN Bing-ting1, ZHAO Wen-zhu1, RONG Na1, DAI Guo-liang1, JU Wen-zheng2
, SUN Bing-ting1, ZHAO Wen-zhu1, RONG Na1, DAI Guo-liang1, JU Wen-zheng2
 , TAN Heng-shan3
, TAN Heng-shan3 2. Dept of Clinical Pharmacology, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China;
3. Dept of Clinical Pharmacology, General Hospital of Nanjing Military Area Command, Nanjing 210002, China
抑郁症(depression)是一种情感障碍性精神疾病,以明显而持久的心境低落为主要特征,常伴有焦虑、躯体不适感、睡眠障碍、食欲及性欲减退等症状[1]。抑郁症发病机制较为复杂,是与应激密切相关的一类精神疾病,单胺递质假说认为其发生可能与脑内单胺类神经递质功能失衡有关。近年来,此假说得到证实,去甲肾上腺素(NE)、五羟色胺(5-HT)、多巴胺(DA)被认为是与抑郁症的发生关系最为密切的单胺类神经递质。抑郁状态可导致中枢神经系统组织形态结构、神经递质及其受体功能产生明显改变[2, 3, 4, 5]。我们采用慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)模型作为实验动物模型[6],该模型是迄今为止较为理想的抑郁动物模型,很好地模拟了慢性不可预见性刺激诱发抑郁的过程及生理生化改变[7],行为学及代谢组学研究均显示CUMS造模较为成功。为了提升此类强极性神经递质在LC-MS / MS测定中的灵敏度和分离效率,本文采用柱前衍生化结合LC-MS / MS首次同时测定CUMS模型下大鼠血浆中的3种单胺类神经递质。
1 材料与方法 1.1 药品与试剂对照品盐酸五羟色胺、盐酸多巴胺均购自Sigma公司(批号分别为:1001528057、101280875);重酒石酸去甲肾上腺素、内标咖啡酸均购自中国药品生物制品检定所(批号分别为:100169-201103、110885-200102);苯甲酰氯购自成都科龙化工试剂厂(批号为:20120529,分析纯,98%);甲醇、乙腈为色谱纯,甲酸、乙酸铵等均为分析纯,实验用水为超纯水。
1.2 仪器Waters Quattro Micro液质联用仪(美国Waters公司),色谱工作站:Masslynx4.1;梅特勒-托利多AE240电子天平(上海梅特勒-托利多有限公司);Thermo Micro 17冷冻高速离心机(美国Thermo公司);Millipore Driet-Q5超纯水机(法国Millipore公司);WH-2微型旋涡混合仪(上海沪西分析仪器厂);离心浓缩仪(美国Labconco公司);游泳缸,自制敞箱;-80℃冰箱(海尔公司)。
1.3 动物及造模方法SD大鼠22只,♂,体质量(200±20)g,由南京中医药大学实验动物中心提供,合格证号:scxk-(苏)2014-0001。将大鼠随机分为对照组(10只)和模型组(12只),对照组5只/笼饲养,模型组每只单笼饲养,正常饮食、饮水。适应3 d后,开始实验。采用Katz法造模,使大鼠在21 d内接受以下9种刺激因子:① 潮湿垫料和倾斜45°;② 禁食24 h;③ 热刺激45℃环境(5 min);④ 夹尾(用塑料夹子夹住距大鼠尾尖1 cm处,持续5 min后取下夹子);⑤ 4℃冰水游泳(5 min);⑥ 束缚应激6 h;⑦ 禁水24 h;⑧ 触摸陌生异常物品(塑料杯、木勺、碎布片等);⑨ 昼夜颠倒24 h(于早9 ∶ 00时将大鼠的笼子盖上黑色塑料袋,不开灯使大鼠处于黑暗状态;至晚21 ∶ 00时将笼子上的黑色塑料袋去掉,置于开灯的房间,使动物处于光照状态,直至次日早9 ∶ 00时)。每日给予一种刺激,每种刺激累计使用2~3次,顺序随机,使动物不能预料刺激的发生,持续3周。造模前、后分别于大鼠眼眶静脉丛取血0.5 mL,置于肝素钠浸泡过的1.5 mL EP管,取血时间前后须一致,3 000 r·min-1离心10 min,取上清液置于干净的EP管中,整个过程避光,并置于-80 ℃冰箱保存待测。
1.4 行为学测定两组分别于造模前及造模21 d后进行行为学测定,包括体重变化、旷场实验、糖水消耗实验。
1.4.1 体重变化CUMS抑郁模型动物可出现食欲不振、体重降低等现象,因此体重变化可作为衡量模型动物抑郁程度的标准之一。
1.4.2 旷场实验将大鼠放入高40 cm,长宽均为50 cm,内壁涂黑,底面平均分为25个10 cm × 10 cm的小方格的箱内底面中心,同时进行摄像和计时,以5 min内大鼠穿越箱底面的方格数为水平得分(三爪以上跨入),穿越一格得1分;以双前肢抬起次数为垂直得分(两前肢离地1 cm以上),双前肢离地一次得1分。
1.4.3 糖水消耗d 1 : 给予每只大鼠两瓶1%蔗糖水,每瓶各200 mL;d 2: 给予每只大鼠一瓶装有1%蔗糖水,另一瓶装有纯净水,每瓶各200 mL;d 3 : 所有大鼠均禁食禁水;d 4: 给予每只大鼠一瓶1%蔗糖水,另一瓶纯净水,每瓶各200 mL,24 h后,取走两瓶并测量瓶中剩余液体体积,计算动物的糖水消耗量。
1.5 血样处理取血浆100 μL,加入内标20 μL(咖啡酸:5 mg·L-1),加入200 μL乙腈,涡旋5 min,12 000 r·min-1离心10 min,取上清液200 μL,转移至干净EP管中,加入50 μL苯甲酰氯(体积分数为0.02的苯甲酰氯溶解于乙腈溶液中)及50 μL四硼酸钠缓冲溶液,室温下涡旋5 min,12 000 r·min-1离心10 min,取200 μL上清液置于进样小瓶中,进样量:10 μL。
1.6 色谱条件色谱柱:Agilent Zorbax SB-C18(150 mm×2.1 mm,5 μm),美国Agilent公司;保护柱:Agilent Zorbax SB-C18(12.5 mm×2.1 mm,5 μm),美国Agilent公司;流动相: 0.1 %甲酸水溶液(含2.0 mmol·L-1乙酸铵) ∶ 乙腈=35 ∶ 65; 流速:0.2 mL·min-1; 柱温:35℃。
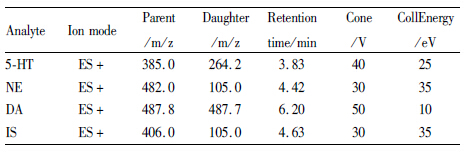
1.7 质谱条件离子化方式为电喷雾(ESI);多反应离子检测(MRM); 检测离子为正离子。5-HT为[M+H]+,母离子→子离子m/z ∶ 385.0→264.2;NE为[M+H]+,母离子→子离子m/z:482.0→105.0;DA为[M+Na]+,母离子→子离子m/z : 487.8→487.7;咖啡酸(IS)为[M+H]+,母离子→子离子m/z : 406.0→105.0。检测电压:3.0 kV;锥孔电压分别为:40V、30V、50V、30 V;离子源温度:120℃;脱溶剂温度:350℃;脱溶剂气体流速:450 mL·min-1,见Tab1。
利用SPSS 17.0统计软件进行分析处理,统计结果用 表示,组间比较采用单因素方差分析。
表示,组间比较采用单因素方差分析。
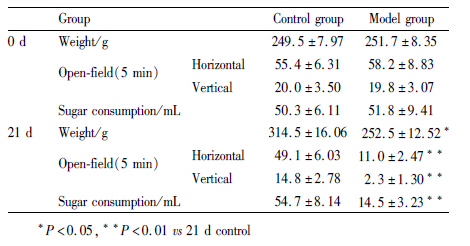
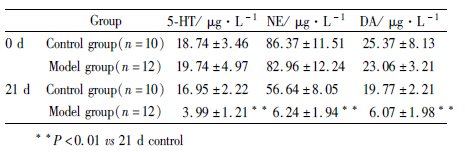
造模21 d后,模型组大鼠食欲减退,活动减少,反应迟钝,和对照组相比,模型组大鼠体重明显降低,水平得分、垂直得分、糖水消耗量均明显降低,见Tab2。
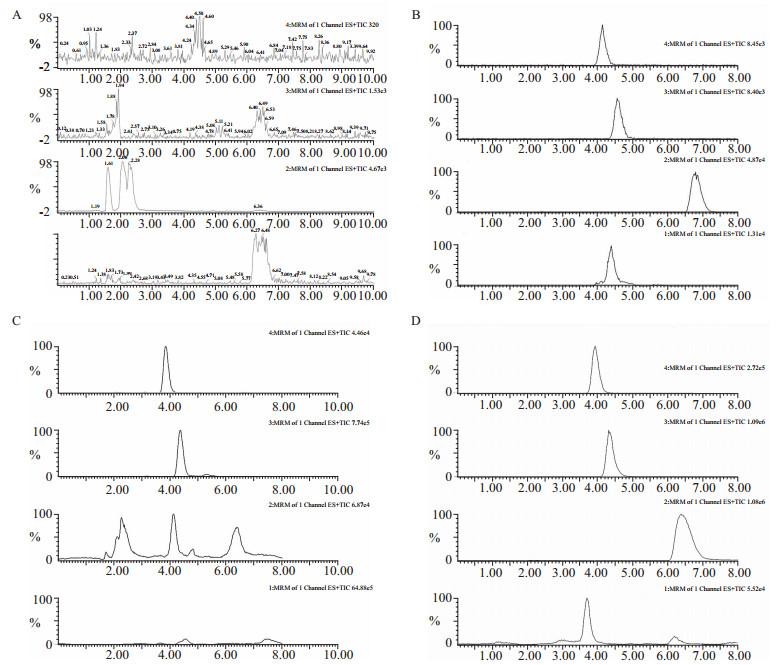
在本实验所采用的LC-MS/MS条 件下,5-HT、NE、DA和内标互不干扰,峰形良好,无杂峰干扰,基线平稳,保留时间分别为:3.83、4.42、6.20、4.63 min(Fig1)。本方法具有良好的特异性和分离度,能准确测定血浆中3种神经递质的浓度,重现性好。
|
| Fig 1 Representative MRM chromatograms of 5-HT,NE,DA and IS in rat plasma samples A: Derivatization reagent;B: Reference standards of 5-HT, NE, DA and IS dissolved in methanol;C: Blank plasma;D: Plasma added reference standards of 5-HT,NE,DA and IS. 1: IS;2: DA;3: NE;4: 5-HT |
取EP管数支,分别精密加入376、449、526.5 μg·L-1;94、112、131.5 μg·L-1;1.47、1.75、2.05 μg·L-1的5-HT、NE、DA质控标准溶液20 μL,再分别加入内标溶液(5 mg·L-1)20 μL,50 μL苯甲酰氯(体积分数为0.02的苯甲酰氯溶解于乙腈溶液中)及50 μL四硼酸钠缓冲液,涡旋5 min,12 000 r·min-1离心10 min,取80 μL进样分析,记录峰面积A1。
另按“血样处理”项下操作空白血浆数管,同上操作,记录峰面积A2。(A2/A1)×100%即为基质效应ME(%)。5-HE、NE、DA和内标基质效应分别在81.62 %~103.77 %、81.25 %~101.52 %、86.74 %~97.12 %、79.20%。
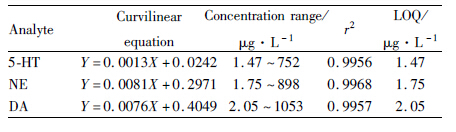
2.4 标准曲线和质控取EP管数支,加入100 μL空白血浆,20 μL的内标标液(5.0 mg·L-1),分别加入浓度分别为1.47、2.94、11.7、23.5、94、188、376、752 μg·L-1的5-HT标准溶液;1.75、3.5、14、28、112、224.5、449、898 μg·L-1的NE标准溶液;2.05、4.1、16.4、32.8、131.5、263.2、526.5、1 053 μg·L-1的DA标准溶液各20 μL,涡旋混匀,配成相应浓度的含药血浆,0点为空白血浆,按“血样处理”项下操作。由于空白血浆中本来就有此类内源性物质存在,故测定时要扣除空白血浆所含的量。以各浓度点对0点的差值与内标之比作为标准曲线的纵坐标,血浆药物浓度为横坐标。得3条回归方程,结果见Tab3。
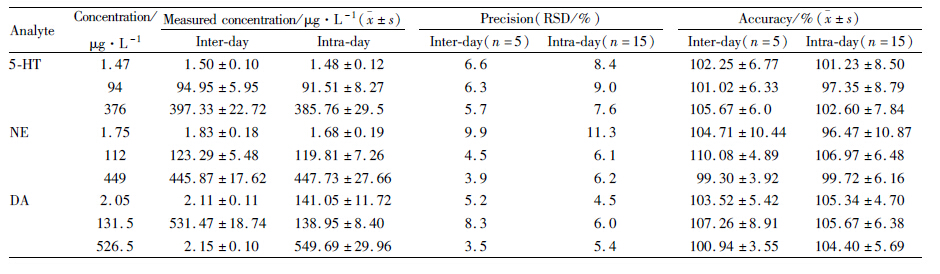
考察日内精密度与日间精密度(3 d)。按标准曲线配制方法制备含5-HT、NE、DA浓度分别为376、449、526.5 μg·L-1 ;94、112、131.5 μg·L-1;1.47、1.75、2.05 μg·L-1 含药血浆质控样品,按“血样处理”项下操作,根据随行标线测得实际浓度。实测浓度的RSD值即为精密度。实测浓度和加入浓度的比值即为准确度,结果见Tab4。
同上操作制备含5-HT、NE、DA分别为376、449、526.5 μg·L-1;94、112、131.5 μg·L-1;1.47、1.75、2.05 μg·L-1的含药血浆质控样品,按“血样处理”项下操作,记录峰面积A3。提取回收率R%=(A3/A1)×(17/10)×100%,结果如下,5-HT、NE、DA及内标的提取回收率分别为91.91%~106.75%(n=5)、74.34%~83.99%(n=5)、78.85%~86.81%(n=5)、106.54%(n=15)。
2.7 稳定性5-HT、NE、DA对照品储备液和内标溶液室温放置4 h,与立即测定相同中浓度标准溶液进行比较,以5-HT、NE、DA峰面积分别和内标峰面积的比值折算成实测浓度计算,比值变化在89.72%~103.50%之间;5-HT、NE、DA和内标储备液在4℃下放置30 d,以实测浓度计算,经与当天新配制的标液进行比较,5-HT、NE、DA和内标储备液的实测浓度分别为新配制的93.21%、94.36%、91.73%、92.32%,结果表明,5-HT、NE、DA和内标溶液室温放置4 h和4℃冷藏30 d稳定性良好。
分别考察了5-HT、NE、DA的各高、中、低浓度血浆质控样品在室温下放置4 h的稳定性,浓度变 化在85.19 %~105.57 %;经血样处理之后的分析物室温放置8 h,浓度变化在83.75 % ~110.38 %。24 h后浓度降低了37.40 %~77.50 %;反复冻融3次后,经实测浓度与加入浓度进行比较,浓度变化在91.01 %~109.47 %。结果表明,未处理的血浆样品室温下放置4 h内稳定,经血浆处理方法后,8 h内稳定,反复冻融3次均稳定,而血浆处理后样品室温放置24 h后有明显降解,故应当在8 h内完成测定。
2.8 样品测定于造模前和造模21 d后,对模型组和对照组大鼠进行眼眶取血,所得血浆按“血样处理”项下进行处理测定,与造模21d后的对照组相比,模型组大鼠血浆中5-HT、NE、DA含量均明显降低。结果见Tab5。
本文采用柱前衍生化法首次测定了CUMS模型下血浆中5-HT、NE、DA 3种神经递质的浓度,方法简便、专属性强、准确度高,可作为5-HT、NE、DA血浆含量测定方法。
实验中,采用最早由Katz提出的慢性不可预见性温和刺激对大鼠进行为期3周的造模,21 d后对动物进行行为学及糖水消耗实验,结果表明该造模方法造成的抑郁状态与临床上抑郁症的快感丧失、精神运动衰减等较为相似,该模型很好地模拟了慢性不可预见性刺激诱发抑郁的过程及生理生化改变,与经典的5-HT能神经低下假说相符[8, 9, 10, 11]。
5-HT、NE、DA均极性较强,在反相色谱柱上属于弱保留,且在电喷雾离子化过程中较低的表面活性导致质谱响应较差。为了改善此类高极性化合物的色谱行为,我们采用了柱前化学衍生化的方法以提高灵敏度和分离效率。之所以选择苯甲酰氯,是因为它可以与伯胺、仲胺等在温和条件下反应,并且产率较高,同时该试剂廉价易得。
此外,儿茶酚胺类的不稳定性在储存和前处理过程中应当引起注意。我们向流动相中加入适量甲酸以阻止其氧化。在相关文献[12]基础上,我们改用等度洗脱,调节流动相比例,对液相方法进行了反复优化,在0.1 %的甲酸水溶液中加入2 mmol·L-1乙酸铵后,发现峰形改善,同时比较了50 %、60 %、65 %、70 %、80 %的乙腈比例,选择了最佳流动相比例65 %的乙腈 ∶ 35 %的0.1 %甲酸水溶液(含2 mmol·L-1乙酸铵),使得3种待测物质的保留时间分别为3.83、4.42、6.20 min,将分析时间缩短在8 min内。同时省略了吹干步骤,直接于上清液中进行衍生化,简化了前处理步骤,使得前处理操作方便快捷。柱前衍生化将待测物5-HT、NE、DA的响应值提升1个数量级,定量下限可达1 μg·L-1。
该方法建立后,CUMS模型组和对照组之间的3种神经递质的差异性可以被准确定量,对造模成功与否提供实验依据。
| [1] | 张风霞, 张华, 姜林芳. 抑郁症临床研究进展[J].山东中医杂志, 2010, 29(1):61-2. Zhang F X, Zhang H, Jiang L F. Clinical study of depression[J]. Shandong J TCM, 2010, 29(1):61-2. |
| [2] | 王步军, 蓝长安. 2型糖尿病与抑郁症的相关性[J].中国临床康复, 2006, 10(46):149-51. Wang B J, Lan C A. Correlation between type 2 diabetes mellitus and depression[J]. Chin J Clin Rehabil, 2006, 10(46):149-51. |
| [3] | 郭丽丽, 史亚飞, 张彩霞. 肿瘤并发抑郁国内外研究现状[J].辽宁中医药大学学报, 2014, 16(1):112-5. Guo L L, Shi Y F, Zhang C X. Current research status of cancer happened with depression in the world[J]. Liaoning Univ TCM, 2014, 16(1):112-5. |
| [4] | 刘子修, 刘史佳, 居文政, 谈恒山. 黄葵胶囊对大鼠CYP450酶的影响[J].中国临床药理学与治疗学, 2010, 15(4):367-72. Liu Z X, Liu S J, Ju W Z, Tan H S. Effects of Huangkui capsule on CYP450 enzymes in rat[J]. Chin J Clin Pharmacol Therap, 2010, 15(4):367-72. |
| [5] | 陈姣, 楚世峰, 陈乃宏. 糖皮质激素与抑郁发病相关机制研究进展[J].中国药理学通报, 2013, 29(11):1493-5. Chen J, Chu S F, Chen N H. Research progress in glucocorticoid and pathophysiology of depression[J]. Chin Pharmacol Bull, 2013, 29(11):1493-5. |
| [6] | 董洪坦, 韩刚, 朱晓晨, 郭蓉娟. 肝郁脾虚抑郁症研究进展[J].环球中医药, 2014, 7(2):146-50. Dong H T, Han G, Zhu X C, Guo R J. Study of liver spleen depression[J]. Global Chin Med, 2014, 7(2):146-50. |
| [7] | 蒋亚萍. 抗抑郁中药的研究进展[J].云南中医中药杂志, 2010, 31(10):76-8. Jiang Y P. Study of antidepressant medicine[J]. Yunnan J Tradit Chin Med, 2010, 31(10):76-8. |
| [8] | Vitale G, Ruggieri V, Filaferro M, et al. Chronic treatment with the selective NOP receptor antagonist[Nphe 1, Arg 14, Lys 15] N/OFQ-NH 2(UFP-101)reverses the behavioural and biochemical effects of unpredictable chronic mild stress in rats[J]. Psychopharmacology(Berl), 2009, 207(2):173-89. |
| [9] | Farley S, Apazoglou K, Witkin J M, et al. Antidepressant-like effects of an AMPA receptor potentiator under a chronic mild stress paradigm[J]. Int J Neuropsychopharmacol, 2010, 13(9):1207-18. |
| [10] | Dai Y, Li Z, Xue L, et al. Metabolomics study on the anti-depression effect of xiaoyaosan on rat model of chronic unpredictable mild stress[J]. J Ethnopharmacol, 2010, 128(2):482-9. |
| [11] | Kamper E F, Chatzigeorgiou A, Tsimpoukidi O, et al. Sex differences in oxidant/antioxidant balance under a chronic mild stress regime[J]. Physiol Behav, 2009, 98(1-2):215-22. |
| [12] | Zheng X, Kang A, Dai C, et al. Quantitative analysis of neurochemical panel in rat brain and plasma by liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2012, 84(22):10044-51. |