2. 南华大学附属第一医院呼吸内科, 湖南 衡阳 421001
2. Dept of Respiration, the First Affiliated Hospital, University of South China, Hengyang Hunan 421001, China
肺纤维化(pulmonary fibrosis)是由各种肺内外致病因素所致的间质性肺疾病,以巨噬细胞、淋巴细胞等炎症细胞在肺间质浸润、纤维母细胞增生及纤维结缔组织沉积于肺间质为特征,它是一系列慢性肺部疾病的最终结局,对人类健康危害极大。肺纤维化是一个复杂的病理生理过程,尽管发病机制尚未完全阐明,但氧化应激和过度炎症反应在其发生发展中起重要作用[1]。近年来,肺纤维化的发病率呈上升趋势,临床上仍缺乏有效的治疗手段。因此,寻找对肺纤维化有效的治疗药物已成为当前医学的迫切需要。大黄素属于蒽醌类衍生物,是中药大黄的主要有效单体,具有明显的抗炎、免疫调节及抗氧化应激等药理作用[2]。新近研究表明,大黄素通过下调白介素(interleukin,IL)-7、转化生长因子-β1表达减轻博莱霉素所致的大鼠肺纤维化程度[3, 4]。然而,大黄素对肺纤维化的保护作用是否与抗炎和抗氧化应激有关,尚未见报道。为此,本研究采用博莱霉素气管内注射建立SD大鼠肺纤维化模型,观察大黄素对肺纤维化大鼠肺组织病理学改变、羟脯氨酸(hydroxyproline,HYP)含量、氧化应激和炎症介质的影响,探索大黄素对肺纤维化大鼠的保护作用及其相关机制,从而为其临床应用于肺纤维化的防治提供理论基础和实验依据。
1 材料与方法 1.1 实验动物与药品♂ SD大鼠60只,8~10周龄,体质量为250~300 g,清洁级,由南华大学实验动物学部提供,实验动物使用许可证号:SYKK(湘)2010-0006,予常规颗粒饲料喂养,并自由饮水。博莱霉素A5系太和制药有限公司产品。产品批号:070501。大黄素由国家药物和生物制品检定研究所(NICPBP)提供,浓度>98%,溶解于二甲基亚砜(美国 Sigma公司)后制成混悬液。醋酸泼尼松片购于天津太平洋制药有限公司,产品批号080201。
1.2 模型制备与分组给药将60只SD大鼠随机分为正常对照组、假手术组、模型组、大黄素低剂量干预组、大黄素高剂量干预组和泼尼松组,每组10只。后5组通过腹腔注射10%水合氯醛(3 mL·kg-1)麻醉大鼠后,从颈正中部位切开,暴露气管,其中模型组、低剂量干预组、高剂量干预组和泼尼松组向气管内一次性注入溶解了博莱霉素A5(5 mg·kg-1)的生理盐水0.2 mL,假手术组注入等量生理盐水,然后将大鼠直立并旋转,以使药液在肺内分布均匀。从次日开始,正常对照组、假手术组、模型组予2 mL生理盐水灌胃,低、高剂量干预组分别予20、80 mg·kg-1 大黄素混悬液2 mL灌胃,泼尼松组以5 mg·kg-1醋酸泼尼松(溶解于2 mL生理盐水中)灌胃,均为1次/日。d 28,大鼠麻醉后开胸,以心脏采血法采集血液3 mL,离心并提取血清,保存于-20℃冰箱,用于检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-17的水平,再颈动脉放血处死全部大鼠,截取右肺组织,迅速放入-70℃液氮中冻存,用于HYP、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione-peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)含量和Western blot检测,然后经主支气管向左肺内注入 10%中性福尔马林液,使胸膜展开后置于10%中性福尔马林中固定 24 h以上,石蜡包埋,切片,行苏木精-伊红(hematoxylin-eosin,HE) 染色及Masson 染色。
1.3 HE染色和Masson染色左肺石蜡切片行常规HE染色和Masson染色,光镜下观察肺组织病理学改变。参照 Szapiel等[5]的方法用HE染色评定肺组织肺泡炎症程度,0分:无肺组织炎;1分:轻度肺组织炎,炎性细胞浸润仅限于局部或近胸膜部,面积小于全肺的 20%;2分:中度肺组织炎,受累面积占全肺的 20%~50%;3分:重度肺组织炎,受累面积大于 50%。Masson染色评定肺组织纤维化程度,0分:无肺纤维化;1分:轻度肺纤维化,受累面积少于全肺 20%;2分:中度肺纤维化,受累面积占 20%~50%;3分:重度肺纤维化,受累面积大于 50%,肺泡结构紊乱。
1.4 肺组织HYP、MDA、SOD、GSH-Px、CAT含量的测定取适量右肺组织匀浆,离心,提取上清液,通过BCA蛋白检测试剂盒(上海碧云天生物技术有限公司)测定蛋白浓度。然后,采用商业试剂盒(南京建成生物工程研究所)测定HYP、MDA、SOD、GSH-Px、CAT的含量。
1.5 Western blot取适量右肺组织,分别按照细胞质/核蛋白提取试剂盒说明(美国ProMab公司)提取各组细胞胞质蛋白和核蛋白,并进行蛋白定量。常规制备SDS-PAGE胶,上样、电泳并移膜,此后,分别滴加1 ∶ 500兔抗大鼠 Kelch样ECH联合蛋白1(Kelch-like ECH-associated protein 1,Keap 1)、核内NF-E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)、核因子-κB(nuclear factor-κB,NF-κB)p65、β-actin一抗(美国Santa Cruz公司),并在4℃条件下孵育过夜,洗膜,加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶ 2 500),室温孵育1 h,ECL 显色、暗室曝光、扫描,得出灰度值,目的蛋白(Keap 1、Nrf2、NF-κB p65)相对表达水平=目的蛋白灰度值/β-actin灰度值。
1.6 血清TNF-α、IL-6、IL-17浓度检测通过双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定各组血清TNF-α、IL-6、IL-17浓度,试剂盒购于深圳晶美生物工程公司,严格按照生产厂商提供的试剂盒说明书进行操作。
1.7 统计学处理 实验数据以 表示,全部资料用SPSS 13.0统计软件进行分析,多组均数比较采用单因素方差分析,两两之间比较的q检验。
表示,全部资料用SPSS 13.0统计软件进行分析,多组均数比较采用单因素方差分析,两两之间比较的q检验。
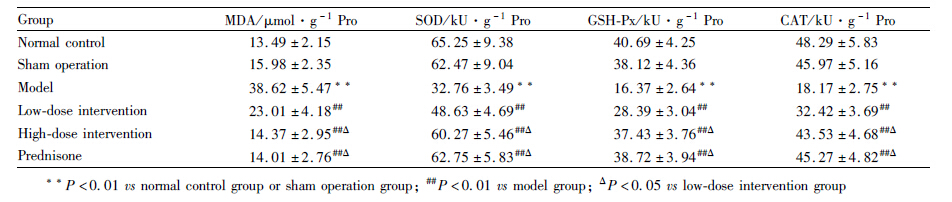
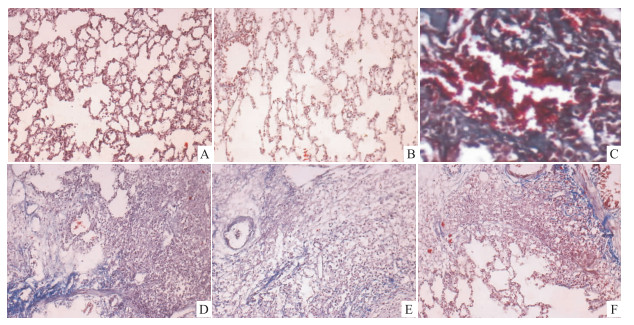
正常对照组、假手术组大鼠肺组织结构清晰,未见任何病理改变;模型组肺泡间隔明显增厚,多数肺泡壁结构紊乱,可见较多的炎症细胞浸润,纤维化明显;大黄素低、高剂量干预组和泼尼松组上述病变减轻,尤其以大黄素高剂量干预组和泼尼松组改善明显(Fig1、2)。由Tab1可知,与模型组比较,大黄素低、高剂量干预组和泼尼松组肺泡炎与肺纤维化评分及肺组织HYP含量明显降低,差异均有显著性(P < 0.05 or P<0.01),此外,大黄素高剂量干预组、泼尼松组上述指标低于大黄素低剂 量干预组(P < 0.05),但假手术组与正常对照组及 大黄素高剂量干预组与泼尼松组之间比较,差异无显著性(P > 0.05)。

|
| Fig 1 HE staining of pulmonary tissues among groups (×200) A: Normal control group; B: Sham operation group; C: Model group; D: Low-dose intervention group; E: High-dose intervention group; F: Prednisone group |
|
| Fig 2 Masson staining of pulmonary tissues among groups(Blue represents collagen fiber,×200) A: Normal control group; B: Sham operation group; C: Model group; D: Low-dose intervention group; E: High-dose intervention group; F: Prednisone group |
 |
如Tab2所示,假手术组肺组织匀浆液中MDA、SOD、GSH-Px和CAT含量与正常对照组无区别(P > 0.05),与正常对照组、假手术组比较,模型组MDA含量升高(P < 0.01),SOD、GSH-Px和CAT含量则降低(P < 0.01),采用低、高剂量大黄素及泼尼松处理后,MDA含量减少,而SOD、GSH-Px和CAT含量增加,与模型组比较,差异均有显著性(P < 0.01),此外,大黄素高剂量干预组、泼尼松组MDA含量较大黄素低剂量干预组降低(P < 0.05),但SOD、GSH-Px和CAT含量较大黄素低剂量干预组增加(P < 0.05),然而,大黄素高剂量干预组与泼尼松组比较,差异无显著性(P > 0.05)。
2.3 大黄素对肺纤维化大鼠肺组织中Keap 1/Nrf2信号通路的影响为了明确大黄素增强肺纤维化大鼠抗氧化能力的机制,利用Western blot检测各组肺组织中Keap 1、Nrf2表达,如Fig3所示,假手术组胞质Keap 1及胞核Nrf2表达水平与正常对照组无区别(P > 0.05),与正常对照组、假手术组比较,模型组胞质Keap 1表达水平减少(P < 0.01),而胞核Nrf2表达水平增加(P < 0.01),在大黄素、泼尼松处理后,胞质Keap 1表达水平进一步减少,胞核Nrf2表达水平进一步增加,与模型组相比,差异均有显著性(P< 0.01),高剂量大黄素干预组、泼尼松组胞质Keap 1表达水平较低剂量大黄素干预组降低(P < 0.05),但胞核Nrf2表达水平较大黄素低剂量干预组升高(P < 0.05),此外,大黄素高剂量干预组Keap 1、Nrf2表达水平与泼尼松组无明显差别(P > 0.05)。

|
| Fig 3 Expression of Keap 1 and Nrf2 in the pulmonary tissues among groups A: Normal control group; B: Sham operation group; C: Model group; D: Low-dose intervention group; E: High-dose intervention group; F: Prednisone group.**P<0.01 vs normal control group or sham operation group; ##P<0.01 vs model group; △P<0.05 vs low-dose intervention group |
采用双抗体夹心ELISA测定各组 大鼠血清TNF-α、IL-6、IL-17浓度,结果发现,假手术组血清TNF-α、IL-6、IL-17浓度与正常对照组比较,差异无显著性(P> 0.05),模型组血清TNF-α、IL-6、IL-17浓度明显高于正常对照组和假手术组(P< 0.01),与模型组比较,低、高剂量大黄素干预组和泼尼松组血清TNF-α、IL-6、IL-17浓度明显减少(P< 0.01),而且高剂量大黄素干预组、泼尼松组上述因子浓度低于低剂量大黄素干预组(P< 0.05),但高剂量大黄素干预组与泼尼松组相比,差异无显著性(P> 0.05),见Tab3。
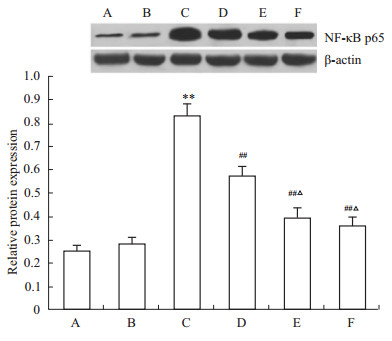
为了进一步探讨大黄素抑制肺纤维化大鼠炎症反应的机制,通过Western blot检测各组胞核NF-κB p65表达,发现假手术组胞核NF-κB p65表达水平与正常对照组比较,差异无显著性(P > 0.05),但模型组胞核NF-κB p65表达水平较正常对照组和假手术组升高(P < 0.01),经低、 高剂量大黄素及泼尼松治疗后,胞核NF-κB p65表达水平下调,与模型组比较,差异均有显著性(P < 0.01),而且高剂量大黄素干预组、泼尼松组胞核NF-κB p65表达水平较低剂量大黄素干预组减少(P < 0.05),此外,高剂量大黄素干预组胞核NF-κB p65表达水平与泼尼松组相比,差异无显著性(P > 0.05),见Fig4。
|
| Fig 4 Expression of NF-κB p65 in the nucleus among groups A: Normal control group; B: Sham operation group; C: Model group; D: Low-dose intervention group; E: High-dose intervention group; F: Prednisone group.**P<0.01 vs normal control group or sham operation group; ##P<0.01 vs model group; △P<0.05 vs low-dose intervention group |
肺纤维化是以弥漫性肺泡炎症和肺泡结构紊乱,最终形成肺间质纤维化为特征性病理改变的慢性进展性疾病,病因众多,无机或有机粉尘、吸入气体、感染、化学制剂、药物、放射线、胶原血管病等是目前已知的病因,但大部分病例的病因不清楚。针对肺纤维化的治疗以往以糖皮质激素和免疫抑制剂如环磷酰胺或细胞毒类药物如硫唑嘌呤以及抗纤维化制剂如N-乙酰半胱氨酸、秋水仙碱等为主,但疗效都不佳,且长期使用激素和免疫抑制剂可出现感染、耐药等副作用,限制了其临床应用[6]。近年来,从中药及天然植物中提取的毒副作用低的有效单体成分(如白藜芦醇)已成为纤维化疾病治疗的新途径[7]。大黄素化学名称为1,3,8-三羟基-6-甲基蒽醌,是从中药大黄的干燥根中分离出来的主要有效单体,具有利尿、抗炎、抗菌、抗病毒、抗肿瘤等多种药理活性,有较好的临床应用价值。体外实验发现,大黄素能够抑制肺成纤维细胞增殖[8]。HYP是脯氨酸羟化酶催化前α-肽链中脯氨酸残基而形成,主要存在于胶原中,其含量可以间接反映胶原的含量。本研究中,正常对照组、假手术组气管切开术后28 d均未发现肺泡炎症与纤维化,两组肺组织HYP含量无统计学意义,可以排除手术本身损伤以及气管内灌注生理盐水的影响;此外,大黄素低、高剂量干预组肺泡炎与肺纤维化评分及肺组织HYP含量较模型组降低,剂量越大,效果越明显,与文献报道相符[4]。而且泼尼松组上述指标低于模型组和低剂量大黄素干预组,但与高剂量大黄素干预组无区别,进一步提示大黄素对博莱霉素所致的肺纤维化大鼠有良好的治疗效果,并且80 mg·kg-1 大黄素与5 mg·kg-1醋酸泼尼松作用相当。
氧化应激是指机体内自由基如活性氧产生过多,超出了机体的清除能力,导致氧化/抗氧化失衡的一种状态。氧化应激在肺纤维化发生发展中的重要作用已得到了人们的共识[9]。MDA是脂质过氧化反应时产生的代谢产物,其含量可反映机体内脂质过氧化的程度。SOD、GSH-Px、CAT是内源性抗氧化酶,可清除自由基,保护细胞免受自由基的损伤,其活力的高低可反映机体清除氧自由基的能力。Keap 1/Nrf2信号通路是迄今为止发现的最重要的抗氧化应激通路,Nrf2属于CNC转录因子家族,在生理情况下,与Keap 1偶联,锚定于胞质中,处于失活状态,当受到活性氧或其它亲电子试剂攻击后,Keap 1与Nrf2解离,Nrf2被激活并进行核转位,与抗氧化反应元件结合,进而诱导SOD、GSH-Px和CAT基因转录,增强细胞的抗氧化应激能力[10]。本实验结果发现,与正常对照组、假手术组比较,模型组肺组织MDA含量、胞核Nrf2表达水平升高,但肺组织SOD、GSH-Px、CAT含量及胞质Keap 1表达水平降低,这些结果进一步证实氧化应激损伤在肺纤维化的形成过程中起重要作用,虽然Nrf2活化导致SOD、GSH-Px、CAT生成增多,但这些酶的消耗远超过生成,因而其活性降低。本研究发现,通过大黄素处理肺纤维化大鼠可降低肺组织MDA含量及下调胞质Keap 1表达,而增加肺组织SOD、GSH-Px、CAT含量及上调胞核Nrf2表达,并且大黄素高剂量干预组优于低剂量干预组,说明大黄素可能通过激活Keap 1/Nrf2信号通路增加肺纤维化大鼠体内抗氧化酶的活性,清除自由基,从而拮抗脂质过氧化引起的肺组织损害。众多研究证实[11, 12],大黄素能够激活Nrf2,从而发挥抗脂质过氧化损伤作用。由于大黄素给药后,可刺激胞质中Keap 1/Nrf2复合物的分离、Keap 1的降解及Nrf2核转位,因而,与模型组相比,大黄素低、高剂量干预组胞质Keap 1表达水平进一步减少,而胞核Nrf2表达水平进一步增加。
炎症细胞的浸润、活化所致细胞因子的异常分泌与肺纤维化的病理生理过程密切相关。TNF-α、IL-6、IL-17均为导致肺损伤的重要促炎介质,抑制这些介质的产生可明显缓解肺纤维化[13, 14]。本研究结果显示,利用大黄素干预治疗可明显降低肺纤维化大鼠血清TNF-α、IL-6、IL-17浓度,并且高剂量干预组血清TNF-α、IL-6、IL-17浓度低于低剂量干预组,说明抑制炎症反应可能是大黄素抗肺纤维化的重要机制之一。NF-κB主要是由p50、p65两个亚基组成的异二聚体,当NF-κB被激活后,由胞质转移至细胞核,与特异性κB 序列结合,能强烈诱导TNF-α、IL-6、IL-17等促炎介质的表达[15]。本组前期研究证实,抑制NF-κB激活对肺纤维化大鼠有保护作用[16]。为了进一步明确大黄素减少这些因子的产生是否和NF-κB有关,本研究通过Western blot检测肺组织中胞核NF-κB p65表达,结果显示,大黄素低、高剂量干预组胞核NF-κB p65表达水平较模型组下调,而且高剂量干预组效果强于低剂量干预组,表明大黄素通过阻碍NF-κB 核转位抑制肺纤维化大鼠促炎因子的分泌。
综上所述,本研究结果表明,大黄素可抑制肺纤维化的发生发展,其机制可能与增强抗氧化能力以及减轻炎症反应有关,这些作用机制的揭示为指导大黄素的开发及临床用药提供了可靠的药理学依据。
| [1] | Lee A S, Mira-Avendano I, Ryu J H, et al. The burden of idiopathic pulmonary fibrosis:An unmet public health need[J]. Respir Med, 2014, 108(7):955-67. |
| [2] | 刘 晗, 高 云.大黄素药理作用的分子机制研究进展[J]. 中国药理学通报, 2009, 25(12):1552-5. Liu H, Gao Y. Research progress in molecular mechanism of the pharmacological actions of emodin[J]. Chin Pharmacol Bull, 2009, 25(12):1552-5. |
| [3] | 李玉花, 许先荣, 李国平, 等. 大黄素抗大鼠肺纤维化实验及对 IL-7的影响[J]. 浙江中医杂志, 2009, 44(12):884-6. Li Y H, Xu X R, Li G P, et al. Anti-pulmonary fibrosis experiment of emodin and its effect on IL-17[J]. Zhejiang J Trad Chin, 2009, 44(12):884-6. |
| [4] | 李玉花, 许先荣, 潘 庆, 等. 大黄素对肺纤维化大鼠 TGF -β1及 smad3/7信号通路的影响[J]. 中华中医药学刊, 2010, 28(2):346-7. Li Y H, Xu X R, Pan Q, et al. The impact of emodin on transforming growth factor β1 (TGF-β1) and smad3/7 signaling pathway of pulmonary fibrosis in rats[J]. Chin Archs Trad Chin Med, 2010, 28(2):346-7. |
| [5] | Szapiel S V, Elson N A, Fulmer J D, et al. Bleomycin-induce dinterstitial pulmonary disease in the nude, athymic mouse[J]. Am Rev Respir Dis, 1979, 120(4):893-9. |
| [6] | Cottin V, Crestani B, Valeyre D, et al. Diagnosis and management of idiopathic pulmonary fibrosis:French practical guidelines[J]. Eur Respir Rev, 2014, 23(132):193-214. |
| [7] | 刘理静, 于小华, 张 平. 白藜芦醇通过TGF-β1/ADAMTS-1信号通路抑制肺纤维化[J]. 中国药理学通报, 2013, 29(3):425-31. Liu L J, Yu X H, Zhang P. Resveratrol inhibits pulmonary fibrosis through TGF-β1/ADAMTS-1 signaling pathway[J]. Chin Pharmacol Bull, 2013, 29(3):425-31. |
| [8] | 屈 云, 姚 平, 李廷谦. 大黄素对肺成纤维细胞增殖和细胞周期的影响[J]. 四川大学学报(医学版), 2004, 35 (1):74-6. Qu Y, Yao P, Li T Q. Effects of emodin on lung fibroblast proliferation and cell cycle in vitro[J]. J Sichuan Univ (Med Sci Edi), 2004, 35(1):74-6. |
| [9] | 钟长军, 李 琳, 李 俊, 高 建. 氧化应激在特发性肺纤维化中的作用及其机制研究进展[J]. 中国药理学通报, 2012, 28(2):169-73. Zhong C J, Li L, Li J, Gao J. The role and mechanisms of oxidative stress in idiopathic pulmonary fibrosis[J]. Chin Pharmacol Bull, 2012, 28(2):169-73. |
| [10] | 李小娟, 王海英. Nrf2/ARE通路对心肌缺血/再灌注损伤的保护作用[J]. 遵义医学院学报, 2012, 35(3):258-62. Li X J, Wang H Y. Protective effect of Nrf2/ARE pathway on myocardial ischemia/reperfusion injury[J]. Acta Acade Med Zunyi, 2012, 35(3):258-62. |
| [11] | Sharma R, Tiku A B. Emodin, an anthraquinone derivative, protects against gamma radiation-induced toxicity by inhibiting DNA damage and oxidative stress[J]. Int J Radiat Biol, 2014, 90(4):275-83. |
| [12] | Waly M I, Ali B H, Al-Lawati I, et al. Protective effects of emodin against cisplatin-induced oxidative stress in cultured human kidney (HEK 293) cells[J]. J Appl Toxicol, 2013, 33(7):626-30. |
| [13] | You H, Wei L, Sun W L, et al. The green tea extract epigallocatechin-3-gallate inhibits irradiation-induced pulmonary fibrosis in adult rats[J]. Int J Mol Med, 2014, 34(1):92-102. |
| [14] | 黄成亮, 李艳艳, 范贤明, 等. IL-17A 促进博来霉素诱导的肺纤维化大鼠肺组织的炎症形成[J]. 细胞与分子免疫学杂志, 2014, 30(4):366-70. Huang C L, Li Y Y, Fan X M, et al. IL-17A promotes pulmonary inflammation in rats with pulmonary fibrosis induced by bleomycin[J]. Chin J Cell Mol Immunol, 2014, 30(4):366-70. |
| [15] | 孙中仪, 田纪伟. NF-κB 信号通路与椎间盘退变的研究进展[J]. 中国矫形外科杂志, 2012, 20(23):2162-4. Sun Z Y, Tian J W. Research advance of NF-κB signaling pathway and degenerative intervertebral disc[J]. Ortho J Chin, 2012, 20(23):2162-4. |
| [16] | 王在岩, 张 平, 何平平, 等. 白藜芦醇对博来霉素致大鼠肺纤维化和NF-κB mRNA 的影响[J].临床肺科杂志, 2011, 16 (9):1315-7.Wang Z Y, Zhang P, He P P, et al. Effects of resveratrol on bleomycin-induced pulmonary fibrosis of the rat and expression of NF-κB[J]. Clin Lung J, 2011, 16 (9):1315-7. |