2. 皖南医学院药学院, 安徽 芜湖 241002;
3. 安徽省创新药物产业共性研究院, 安徽 合肥 230032;
4. 芜湖市第二人民医院药剂科, 安徽 芜湖 241001;
5. 安徽医科大学第二附属医院药剂科, 安徽 合肥 230601
 , HE Yong1, 3, XU Tao1, 3, HUANG Cheng1, 3, XIE Jia-li4, DENG Zi-yu5, LI Jun1, 3
, HE Yong1, 3, XU Tao1, 3, HUANG Cheng1, 3, XIE Jia-li4, DENG Zi-yu5, LI Jun1, 3

2. School of Pharmacy, Wannan Medical College, Wuhu Anhui 241002, China;
3. Anhui Institute of Innovative Drugs, Hefei 230032, China;
4. Dept of Pharmacy, Wuhu NO.2 People's Hospital, Wuhu Anhui 241001, China;
5. Dept of Pharmacy, the Second Affiliated Hospital of Anhui Medical University, Hefei 230601, China
肝纤维化(hepatic fibrosis,HF)是肝脏对慢性损伤的修复反应,肝星状细胞(hepatic stellate cell,HSC)激活是HF的中心环节,活化的HSC增生扩散,分泌细胞外基质(extracellular matrix,ECM)等多种物质,使ECM合成与降解失衡,在肝脏过度沉积,肝脏结构改变,导致肝纤维化[1]。夏枯草为一味传统中药,具有抗菌、抗炎、抗肿瘤功效[2],现代临床多用于治疗急性传染性肝炎等疾病。文献报道[3],夏枯草水提取物可抑制人肝癌细胞金属蛋白酶MMP-2和MMP-9活性。 MMP-2和MMP-9均可促进HSC增殖,上调肝脏TGF-β1表达,因此,夏枯草水提取物具有治疗HF的潜在作用。三萜类物质是夏枯草主要成分,与其药理作用明显相关 [4]。前期研究显示[5],夏枯草总三萜(total triterpenoid of Prunella vulgaris L.,TTP)对CCl4诱导的大鼠急性肝损伤模型具有保护作用。本实验在前期研究基础上,研究TTP对CCl4诱导肝纤维化大鼠的防治作用,观察TTP对肝纤维化胶原Procollagen Ⅰ分泌、HSC活化标志α-SMA的影响,并探讨TTP对p-ERK以及TGF-β1/Smad信号通路的影响,为防治肝纤维化提供实验和理论依据。
1 材料 1.1 药品与试剂夏枯草总三萜,购自西安小草科技股份有限公司,含量>75%; 秋水仙碱购于西双版纳药业有限公司,以5g·L-1羧甲基纤维素钠溶液配成相应浓度的混悬液使用。CCl4,购于汕头西陇化工厂,临用前用鲁花花生油1 ∶ 1稀释 。ALT、AST、SOD、MDA、GSH-Px、Hyp试剂盒购于南京建成生物工程研究所。HA、CⅣ、PCⅢ放射免疫试剂盒购于北京北方生物技术研究所。TRIzol Reagent试剂购自Invitrogen Life Technologies公司。逆转录试剂盒、PCR试剂盒购自Fermentas公司。α-SMA、Procollagen Ⅰ、Smad2、Smad3、Smad7、β-actin引物序列由上海生工工程技术服务有限公司合成。大鼠p-ERK抗体购于美国Santa Cruz公司;辣根过氧化物酶标记二抗购于北京中杉公司;ECL发光试剂盒购于Pierce公司。
1.2 实验动物♂ SD大鼠,体质量180~220 g,由安徽医科大学实验动物中心提供。大鼠饲养于透气笼中,每组10只,自由摄食饮水,温度18℃~22℃,正常光照。
2 方法 2.1 动物分组与处理大鼠适应性饲养1周后,随机分为正常组、模型组、TTP给药组(25、50、100 mg·kg-1)、阳性对照组(秋水仙碱0.1 mg·kg-1),每组10只。除正常组外,其余各组分别于大鼠背部皮下注射CCl4 0.1 ml·(100 g)-1,每周2次,连续12周。自造模第五周起开始给药,各给药组分别给予相应的药物,正常组、模型组给予等体积的溶媒,每天1次,至实验结束,每周称重1次,调整用药剂量。末次给药后,禁食8h处死动物,制备血清,取肝脏组织,检测相关指标。
2.2 血清学指标检测大鼠血样4℃、3 500 r·min-1离心15 min,取血清。检测血清中AST、ALT、HA、CⅣ、PCⅢ含量。
2.3 病理学指标检测肝组织脱水,石蜡包埋处理,HE、Masson染色切片,光镜下观察纤维化的有无及程度。
2.4 组织学指标检测取适量肝右叶组织,用冷生理盐水制成100 g·L-1肝匀浆,4℃、3 500 r·min-1离心15 min,取上清,进行MDA、SOD、GSH-Px 、Hyp含量测定。
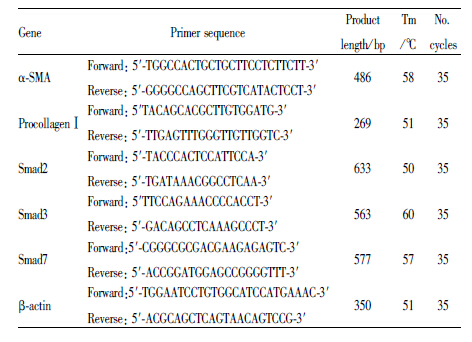
2.5 RT-PCR分析α-SMA、Procollagen Ⅰ、Smad2、Smad3、Smad7的mRNA水平取100 mg肝组织,按TRIzol试剂盒说明书提取肝组织总RNA,按RT-PCR试剂盒说明书,逆转录合成cDNA。各引物序列、产物大小及反应条件见Tab1。扩增产物进行凝胶电泳,拍照,以β-actin为内参,凝胶成像系统进行密度扫描,以目的基因与β-actin光密度比值表示目的基因的相对量。
取100 mg肝组织,加入1 mL RIPA 组织裂解液(每mL裂解液中加10 μL PMSF),冰上进行组织匀浆,12 000 r·min-1离心10 min,取上清。加上样缓冲液,100℃加热10 min使蛋白变性。每孔加入8 μL总蛋白,进行SDS-PAGE电泳。结束后,半干转将蛋白转移到PVDF膜上,电压15V,时间30 min。膜在室温下用50 g·L-1脱脂奶粉封闭,漂洗后加入一抗,4℃过夜孵育。再加入相匹配的二抗,放置1 h。ECL试剂盒显影,以ERK为内参,分析条带吸光度值。
2.7 统计学分析所有数据均以SPSS 13.0统计软件进行数据分析,各组数据以 表示,组间比较采用t检验。
表示,组间比较采用t检验。
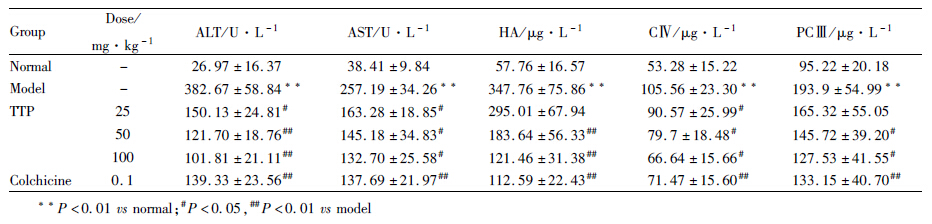
结果如Tab2所示,与正常组相比,模型组血清ALT、AST水平明显升高(P<0.01),TTP各剂量组可降低模型大鼠血清ALT、AST水平(P<0.05,P<0.01);模型组大鼠血清纤维化指标HA、CⅣ、PCⅢ与正常组相比明显增加(P<0.01),TTP各剂量组明显降低模型大鼠血清HA、CⅣ、PCⅢ含量(P<0.05,P<0.01),提示TTP具有肝脏保护作用。
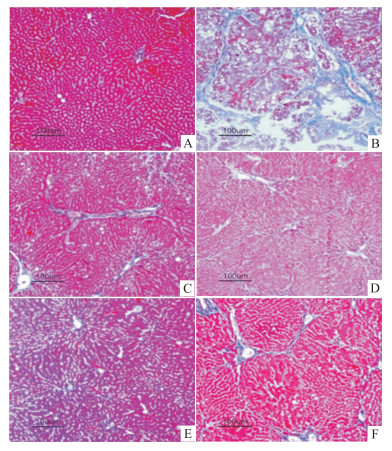
HE染色显示,正常组大鼠肝细胞完整,肝组织无异常纤维增生;模型组可见肝小叶结构破坏,成纤维细胞出现,假小叶形成,肝组织中有明显炎性细胞浸润;TTP低、中、高剂量组和秋水仙碱组可见汇管区纤维结缔组织增生减少,有少量炎性细胞浸润,未见假小叶形成,肝纤维化呈现好转的趋势(Fig1)。Masson染色结果显示,正常大鼠肝细胞完整,无纤维组织增生。模型组大鼠有较多的成纤维细胞出现,纤维结缔组织增生,肝索排列紊乱并伴有假小叶形成。TTP治疗组肝纤维化均有不同程度的改善,结缔组织增生减少,炎性浸润程度减轻,其中以TTP 100 mg·kg-1最为明显,脂肪变性基本消失,肝组织结构趋向正常(Fig2)。

|
| Fig 1 Photomicrographs of liver sections stained with HE's trichrome(×200) A:Normal; B:Model; C:TTP (25 mg·kg-1); D: TTP (50 mg·kg-1); E: TTP (100 mg·kg-1); F: Colchicine (0.1 mg·kg-1) |
|
| Fig 2 Photomicrographs of liver sections stained with Masson's trichrome(×100) A:Normal; B:Model; C:TTP (25 mg·kg-1); D: TTP (50 mg·kg-1); E: TTP (100 mg·kg-1); F: Colchicine (0.1 mg·kg-1) |
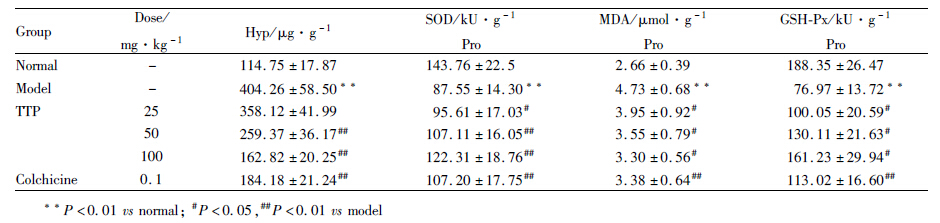
结果如Tab3所示,相比正常组,模型组大鼠肝组织MDA和Hyp水平明显上升(P<0.01),SOD和GSH-Px水平明显下降(P<0.01);与模型组相比,TTP和秋水仙碱组能明显降低MDA和Hyp水平(P<0.05,P<0.01),增加SOD含量,上调GSH-Px表达水平(P<0.05,P<0.01)。
如Fig3 所示,与正常组相比,模型组大鼠肝组织中α-SMA、Procollagen Ⅰ、Smad2、 Smad3 mRNA表达均明显升高(P<0.01),Smad7 mRNA表达降低(P<0.01);与模型组相比,TTP给药组可降低α-SMA、Procollagen Ⅰ、Smad2、Smad3 mRNA表达(P<0.05,P<0.01),升高Smad7 mRNA表达(P<0.05,P<0.01)。
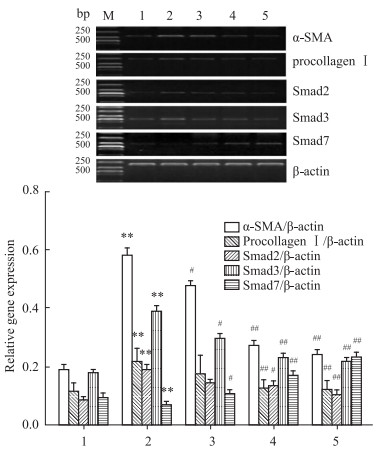
|
| Fig 3 Effect of TTP on α-SMA, procollagen I, Smad2, Smad3 and Smad7 expression in liver fibrosis rats[WTBZ][STBZ] ([AKx-]±s,n=3) 1:Normal; 2:Model; 3:TTP (25 mg·kg-1); 4: TTP (50 mg·kg-1); 5: TTP (100 mg·kg-1). **P<0.01 vs normal group; #P<0.05,##P<0.01 vs model group |
结果如Fig4所示,模型组大鼠肝组织中p-ERK蛋白表达水平高,与正常组相比,差异具有显著性(P<0.01)。与模型组相比较,TTP作用大鼠后,肝组织中p-ERK蛋白表达明显降低(P<0.01),并呈现剂量依赖性,表明TTP可以降低肝纤维化大鼠肝组织中p-ERK蛋白表达。
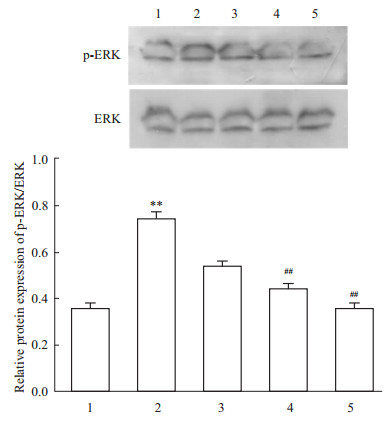
|
| Fig 4 Effect of TTP on p-ERK protein expression in liver fibrosis rats[WTBZ][STBZ]([AKx-]±s,n=3) 1:Normal; 2:Model; 3:TTP (25 mg·kg-1); 4: TTP (50 mg·kg-1); 5: TTP (100 mg·kg-1). **P<0.01 vs normal group;##P<0.01 vs model group |
临床实践表明,HA、CⅣ、PCⅢ水平与肝组织炎症和纤维化紧密相关[6, 7]。HA主要在肝脏内清除,肝脏损伤时其分解HA的功能遭到破坏,因此HA是反映肝功能和肝纤维化的良好指标。CⅣ随着肝脏炎症程度增加,其表达也逐步升高[8]。PCⅢ与肝纤维化程度呈正相关。肝纤维化以ECM过度沉积为病理学特征,ECM主要成分为胶原纤维,由胶原蛋白构成,Hyp常被认为是胶原蛋白特有成分,因此,肝组织Hyp含量可间接反映肝纤维化程度[9]。联合检测以上指标,对于诊断肝纤维化具有重要价值。本研究发现,CCl4诱导的肝纤维化大鼠血清中ALT、AST、HA、CⅣ、PCⅢ以及肝组织中Hyp含量明显升高,提示肝纤维化模型建立成功;TTP各 剂量组可明显降低肝纤维化大鼠ALT、AST、HA、CⅣ、PCⅢ、Hyp水平;病理学检测显示,TTP给药组明显减少肝组织中炎性细胞浸润与胶原组织增生;RT-PCR结果发现,TTP可明显降低Procollagen Ⅰ胶原的分泌。以上研究结果提示,TTP对于CCl4诱导的肝纤维化具有有效的保护作用。
氧自由基及其引起的脂质过氧化在肝纤维化发展过程中发挥着重要的作用,脂质过氧化产物可以直接激活HSC,介导HSC增殖、分化和胶原形成[10]。SOD是机体超氧自由基消除剂,常被作为抗氧化能力的敏感指标。MDA表达异常可导致炎症和肝细胞损伤,其含量与机体内脂质过氧化程度相平行。GSH-Px可保护细胞膜结构和功能的完整性,清除体内过多的脂质过氧化物。进一步研究发现,TTP各剂量组可明显降低MDA水平,增强SOD以及GSH-Px活性,这表明TTP具有减轻肝脏脂质过氧化损伤,调节脂质代谢,增强肝脏抗氧化能力作用。这可能是TTP作用机制之一。
HSC是肝脏分泌ECM的主要细胞,HSC激活是HF形成的中心环节。RT-PCR结果发现,肝纤维化大鼠HSC活化标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)与正常组比较明显增高。细胞因子网络调节对HSC活化起着重要的作用,转化生长因子-β1(transforming growth factor-β1,TGF-β1)是其中重要的细胞因子。TGF-β1通过库否细胞分泌产生,激活HSC,同时能促进HSC自分泌TGF-β1,激活临近HSC大量合成Ⅰ型前胶原、Ⅲ型胶原[11]。研究证实,TGF-β1可通过TGF-β1/Smad和ERK信号传导通路诱导HSC胶原生产。Smads蛋白家族是TGF-β1/Smad信号过程中最重要的胞内效应分子,Smad2、Smad3在HSC中被TGF-β1磷酸化,与 Smad4形成异源寡聚物,将TGF-β1信号从胞质向胞核转位聚集;Smad7是TGF-β1/Smad信号通路的抑制因子,阻止Smad2、Smad3的磷酸化,从而对TGF-β1/Smad信号通路发挥负性调控[12, 13]。HSC激活过程中,抑制ERK活性后能有效减少HSC自分泌TGF-β1,提示ERK信号通路参与调控HSC自分泌TGF-β1过程。本实验研究发现,在CCl4诱导的肝纤维化模型大鼠肝组织中,Smad2、Smad3 mRNA以及p-ERK蛋白表达增高,Smad7 mRNA表达降低;而TTP对模型大鼠α-SMA、Procollagen Ⅰ、Smad2、Smad3、p-ERK有明显的降低作用,对 Smad7 有升高作用。以上结果说明,TTP对肝纤维化的防治作用可能与下调p-ERK表达,抑制TGF-β1/Smad通路有关。
| [1] | 黄成, 李俊, 马陶陶.PI3K/Akt信号通路与肝纤维化[J].中国药理学通报, 2011, 27(8):1037-41. Huang C, Li J, Ma T T. PI3K/Akt signaling pathway and liver fibrosis[J]. Chin Pharmacol Bull, 2011, 27(8):1037-41. |
| [2] | 邓子煜, 徐先祥, 张小红, 等.夏枯草药理学研究进展[J].安徽医学, 2012, 33(7):937-9. Deng Z Y, Xu X X, Zhang X H, et al. Progress in pharmacological research of Prunella vulgaris L.[J]. Anhui Med J, 2012, 33(7):937-9. |
| [3] | Kim S H, Huang C Y, Tsai C Y, et al. The aqueous extract of Prunella vulgaris suppresses cell invasion and migration in human liver cancer cells by attenuating matrix metalloproteinases[J]. Am J Chin Med, 2012, 40(3):643-56. |
| [4] | Lamaison J L, Petitjean-Freytet C, Carnat A. Medicinal Lamiaceae with antioxidant properties, a potential source of rosmarinic acid[J]. Pharm Acta Helv, 1991, 66(7):185-8. |
| [5] | 章圣朋, 邓子煜, 黄成, 等.夏枯草总三萜对四氯化碳致急性肝损伤大鼠的保护作用[J].安徽医科大学学报, 2012, 47(9):1054-7. Zhang S P, Deng Z Y, Huang C, et al. Protective effects of total triterpenoids of Prunella vulgaris L. against carbon tetrachloride-induced acute liver injury in rats[J]. Acta Univ Med Anhui, 2012, 47(9):1054-7. |
| [6] | 施洪波, 傅君芬, 王春林, 等. 肝纤维化指标和血清铁蛋白在肥胖儿童非酒精性脂肪肝病中的临床意义[J].浙江大学学报(医学版), 2008, 37(3):245-9. Shi H B, Fu J F, Wang C L, et al. Clinical value of hepatic fibrosis parameters and serum ferritin in obese children with nonalcoholic fatty liver disease[J]. J Zhejiang Univ (Med Sci), 2008, 37(3):245-9. |
| [7] | Li G Y, Gao H Y, Huang J, et al. Hepatoprotective effect of Cichorium intybus L., a traditional Uighur medicine, against carbon tetrachloride-induced hepatic fibrosis in rats[J]. World J Gastroenterol, 2014, 20(16):4753-60. |
| [8] | Attallah A M, Mosa T E, Omran M M, et al. Immunodetection of collagen types Ⅰ, Ⅱ, Ⅲ, and Ⅳ for differentiation of liver fibrosis stages in patients with chronic HCV[J]. J Immunoassay Immunochem, 2007, 28(2):155-68. |
| [9] | 李映菊, 汪煜华, 刘玉美, 等.白屈菜红碱对肝纤维化大鼠肝脏病理学和肝脏羟脯氨酸含量的影响[J].实用肝脏病杂志, 2009, 12(3):167-70. Li Y J, Wang Y H, Liu Y M, et al. Effects of chelerythine on hepatic pathology and hydroxyproline level in rats with CCl4-induced hepatic fibrosis[J]. J Clin Hepatic, 2009, 12(3):167-70. |
| [10] | 年国侠, 黄正明, 杨新波, 等.水芹总酚酸抗四氯化碳所致肝纤维化作用的实验研究[J].解放军药学学报, 2010, 26(1):22-6. Nian G X, Huang Z M, Yang X B, et al. Effect of total phenolics acid of oenanthe javanica on hepatic fibrosis in rats[J]. Pharm J Chin PLA, 2010, 26(1):22-6. |
| [11] | 黄艳, 黄成, 李俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报, 2010, 26(1):9-13. Huang Y, Huang C, Li J. Effect of cytokines cecreted from Kupffer cell on HSC proliferation, apoptosis in hepatic fibrosis process[J]. Chin Pharmacol Bull, 2010, 26(1):9-13. |
| [12] | Moro T, Shimoyama Y, Kushida M, et al. Glycyrrhizin and its metabolite inhibit Smad3-mediated type I collagen gene transcription and suppress experimental murine liver fibrosis[J]. Life Sci, 2008, 83(15-16):531-9. |
| [13] | Liu X, Hu H, Yin J Q. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis[J]. Liver Int, 2006, 26(1):8-22. |