


2. 湖北大学教育学院心理学系, 湖北 武汉 430062
 , YAO Li-hua1, WANG Hui-ling1, LIU Zhong-chun1, WANG Xiao-ping1, XIAO Ling1, WANG Gao-hua1
, YAO Li-hua1, WANG Hui-ling1, LIU Zhong-chun1, WANG Xiao-ping1, XIAO Ling1, WANG Gao-hua1

2. Dept of Psychology, Faculty of Education, Hubei University, Wuhan 430062, China
当前,在临床广泛使用的抗抑郁药主要针对单胺能系统(5-羟色胺和去甲肾上腺素),但其发挥治疗效果的具体机制并不清楚[1]。研究发现,抗抑郁药使用后可立即升高突触间隙的5-羟色胺(5-HT)或去甲肾上腺素(NE)的浓度,然而其抗抑郁的临床疗效却需要数周才能显现。这种不一致显示除了单胺能系统以外可能还有其他机制涉及到临床抗抑郁活动当中。
越来越多的证据表明,突触间隙过高的谷氨酸造成的兴奋毒性损害神经元和神经胶质细胞是重型抑郁症(MDD)发生的重要原因,而降低突触间隙的谷氨酸的浓度是MDD治疗的关键[2, 3]。谷氨酸转运体EAAT2(啮齿类动物命名为GLT-1:谷氨酸转运体1,glutamate transporter 1)是海马和前额叶星形胶质细胞膜上一种非常重要的谷氨酸转运体[4],其负责细胞外大部分谷氨酸的摄取和转运[5]。来自MDD病人[6]和抑郁动物模型[7]的实验研究显示其脑内GLT-1表达水平与健康控制组比较是降低的。而研究发现上抬GLT-1表达水平的药物具有抗抑郁样效应[8]。
氟西汀(fluoxetine,FLX),一种选择性5-HT再摄取抑制剂,是临床最常见的一线抗抑郁药,然而,其潜在的抗抑郁作用机制仍然不清楚。最近有研究表明,氟西汀治疗可以诱导正常大鼠海马和皮层EAAT2(GLT-1)表达升高[9]。但是这种来自健康大鼠的研究证据不同于抗抑郁药作用于临床抑郁病人所引起的改变。因此,通过抑郁动物模型进一步探讨GLT-1与氟西汀抗抑郁作用的关系是必要的。本研究拟通过氟西汀对慢性不可预见性应激(chronic unpredictable stress,CUS)大鼠前额叶(prefrontal cortex,PFC)GLT-1表达的影响,进一步探讨氟西汀抗抑郁作用的新机制,为MDD发生和治疗的机制研究提供理论依据。
1 材料与方法 1.1 实验动物60只清洁级成年♀SD大鼠(由武汉大学医学院动物实验中心提供),饲养于二级动物实验室中,普通饲料喂养,自由进食与饮水。1周后,利用随机数字表将大鼠随机分为3组:(1)对照组:空白对照+生理盐水;(2)CUS组:CUS+生理盐水;(3)氟西汀组:CUS+氟西汀,每组20只。
1.2 药品和试剂氟西汀原药(金洹化工科技有限公司,上海);兔多克隆抗体anti- GLT-1(ab41621,Abcam,Cambridge,MA,USA);生物素标记二抗羊抗兔IgG(sc-3840,Santa Cruz Biotechnology,Santa Cruz,CA,USA); 兔多克隆抗体anti-GAPDH(ab9485,Abcam,Cambridge,MA,USA)。二抗辣根过氧化物酶标记的羊抗兔IgG(sc-2004,Santa Cruz Biotechnology,Santa Cruz,CA,USA);PVDF膜 (Millipore,USA)。
1.3 主要仪器动物行为自动跟踪系统(EthoVision 3.0,荷兰);奥林巴斯BX50显微镜(奥林巴斯,东京,日本);计算机辅助图像分析系统(JEDA801D,捷达科技有限公司,中国);凝胶扫描分析系统(Bio-Rad公司,美国)。
1.4 实验方法 1.4.1 慢性不可预知应激(CUS)基于前人的研究稍作修改建立CUS动物模型[10, 11]。对CUS组和氟西汀组大鼠进行连续35 d,每天2次应激刺激。本实验采用10种不同的应激刺激:鼠笼45°倾斜24 h,潮湿垫料24 h,行为限制2 h,4℃冰水游泳5 min,42℃热水游泳5 min,禁食24 h,禁水24 h,夹尾 1 min,鼠笼摇晃 15 min,24 h昼夜颠倒。将大鼠分别暴露于这些应激刺激下。同样的刺激不能出现在两个连续的阶段,对照组大鼠不遭受任何应激。
1.4.2 糖水偏好实验实验前动物已进行糖水适应性训练。禁水12 h后 (20 ∶ 00~8 ∶ 00),糖水实验在上午8 ∶ 00~9 ∶ 00进行。给予动物事先称量好的两瓶水,一瓶为质量浓度为10 g·L-1蔗糖水,一瓶为动物日常饮用水。1 h后,计算动物的糖水偏好,糖水偏好=糖水消耗/总液体消耗。
1.4.3 旷场实验旷场大小为120 cm×90 cm×35 cm,实验从早上9 ∶ 00开始进行,将大鼠置于旷场中心,使用动物行为自动跟踪系统记录并分析大鼠在旷场内10 min的行为活动,主要观测指标为总行程,平均移动速度,直立次数(垂直运动得分,两前爪腾空或攀附墙壁)。动物单独测试,两只动物之间将场地清理干净[11]。
1.4.4 氟西汀治疗治疗前,将氟西汀溶解在生理盐水中。连续28 d,每天向大鼠腹腔注射氟西汀(10 mg·kg-1)[11]或等体积的生理盐水。
1.4.5 免疫组织化学分析将大鼠断头处死,解剖分离出前额叶,石蜡包埋,厚5 μm的切片,在含有H2O2的甲醇中处理30 min,0.01 mmol·L-1的柠檬酸盐缓冲液(pH 7.2)中微波处理15 min。在正常山羊血清中预孵化30 min后,用兔多克隆抗体anti-GLT-1(1 ∶ 200)孵化切片,4℃过夜,0.1 mol·L-1磷酸盐缓冲盐水(PBS)洗涤,37℃下生物素标记二抗羊抗兔IgG(1 ∶ 100)孵育60 min。最后,PBS洗涤3次,DAB着色10 min。
通过免疫组化技术,阳性及强阳性的区域被染成黄褐色。使用奥林巴斯BX50显微镜,在200×放大下捕获前额叶GLT-1的阳性染色图像,采用计算机辅助图像分析系统对GLT-1免疫组织化学染色区域的总光密度(IOD)进行定量分析。随机选取10个切片用于每只大鼠的定量统计。
1.4.6 免疫印迹分析将分析样品从-80℃冰箱中取出,匀浆离心后,通过BCA法测定蛋白质浓度。经SDS聚丙烯酰胺凝胶电泳,转移至PVDF膜。分别加入GLT-1抗体(1 ∶ 300)及内标GAPDH抗体(1 ∶ 300),轻摇孵育过夜。洗膜后,加入辣根过氧化物酶标记的羊抗兔IgG(1 ∶ 5 000),室温轻摇1 h。充分洗膜后做化学发光(ECL),胶片曝光显影。胶 片用凝胶扫描分析系统进行灰度分析。GLT-1表达的相对含量变化用GLT-1条带灰度值与GAPDH条带的灰度值的比值(GLT-1/GAPDH)表示。
1.5 统计学处理应用SPSS 17.0软件统计包对数据进行处理,结果采用 表示。组间差异的比较采用单因素方差分析,均数间的两两比较采用Bonferroni检验。
表示。组间差异的比较采用单因素方差分析,均数间的两两比较采用Bonferroni检验。
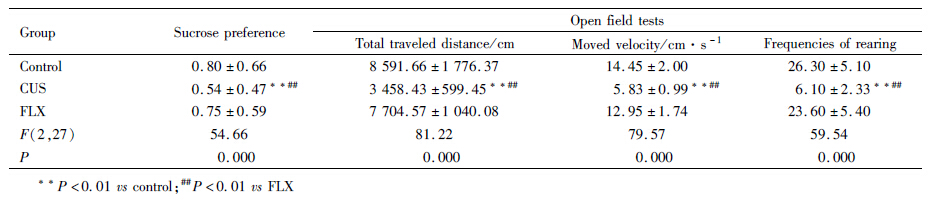
由Tab1可见,CUS组糖水偏好、总行程、平均移动速度和直立次数与对照组和氟西汀组比较明显减少,差异有统计学意义(P<0.01)。
 , n=20)
, n=20)
 |
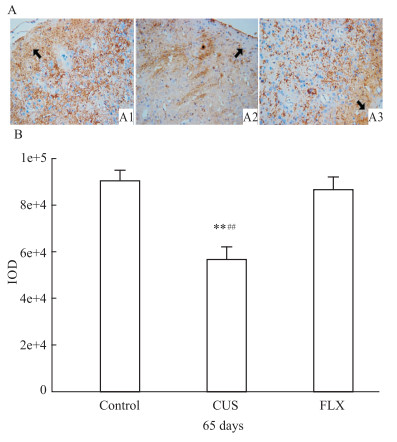
免疫组织化学分析显示,对照组大鼠前额叶GLT-1表达增加(Fig1 A:A1),CUS组大鼠的GLT-1表达下降(Fig1 A:A2)。而氟西汀组大鼠的GLT-1表达增加(Fig1 A:A3)。即经过氟西汀治疗后大鼠前额叶GLT-1表达明显多于CUS组。通过总光密度(IOD)对大鼠前额叶GLT-1表达水平进行量化分析,结果发现3组大鼠前额叶GLT-1的表达差异有着显著性[F(2,27)=112.82,P<0.01];均数间两两比较显示CUS组大鼠前额叶GLT-1的表达明显减少(与对照组对比,P<0.01;与氟西汀组比较,P<0.01),见Fig1 B。
|
Fig 1
GLT-1 expression in rat PFC as revealed by immunohistochemistry analysis
A: Immunostaining in the rat PFC (magnification, ×200), the control group (A1), the CUS group (A2), and the FLX group (A3) (GLT1-immunopositive indicated by the black arrows);B: Quantitative representation of the expression of GLT-1 by integrated optical density (IOD)( , n=10). **P<0.01 vs the control group;##P<0.01 vs the FLX group , n=10). **P<0.01 vs the control group;##P<0.01 vs the FLX group
|
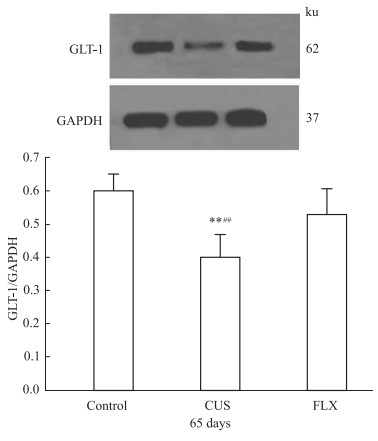
免疫印迹分析显示对照组、CUS组和氟西汀组大鼠前额叶GLT-1的表达结果见Fig2。单因素方差分析显示,3组大鼠前额叶GLT-1表达的灰度值差异有显著[F(2,27)=23.81,P<0.01]。均数间两两比较发现,CUS组大鼠前额叶GLT-1的表达明显减少(与对照组比较:P<0.01,与氟西汀组相比:P<0.01)。
|
Fig 2
GLT-1 expression in rat PFC as revealed by Western blot analysis( , n=10)
**P<0.01 vs the control group;##P<0.01 vs the FLX group , n=10)
**P<0.01 vs the control group;##P<0.01 vs the FLX group
|
目前研究发现,人类细胞外谷氨酸水平被5种亚型的谷氨酸转运体(EAAT)所调控:EAAT1(啮齿类动物命名为GLAST:谷氨酸转运体),EAAT2(啮 齿类动物命名为GLT-1:谷氨酸转运体1),EAAT3(啮齿类动物命名为EAAC1:兴奋性氨基酸载体1),以及EAAT4和EAAT5。其中,GLAST和GLT-1广泛表达于神经胶质细胞膜上,EAAC1和EAAT4主要分布在神经细胞膜上,EAAT5则主要存在于视网膜的神经细胞和神经胶质细胞膜上[12]。研究显示,GLT-1将突触间隙过高的谷氨酸转运到星形胶质细胞中,由谷氨酰胺合成酶(GS)将谷氨酸转化为无毒的谷氨酰胺,从而降低过高的谷氨酸对神经元和神经胶质细胞的损伤[13]。
来自临床MDD病人[6]和抑郁动物模型[7]的研究显示,GLT-1与MDD的发生和抗抑郁药治疗有 关。Choudary等[6] 用微阵列分析MDD病人死后的大脑皮层发现,SLC1A2 (用来编码EAAT1的基因)和SLC1A3 (用来编码EAAT2基因)明显下降。Zink等[7]在获得性无助动物模型中证实实验大鼠的海马和皮层EAAT2(GLT-1)表达是下降的。最近的研究表明,β-内酰胺类药物可明显激活GLT-1的启动子而增加脑组织GLT-1的表达[14],其中,β-内酰胺类抗生素头孢曲松的抗抑郁效应已在几种经典的抑郁动物模型中得到验证[8]。另外,利鲁唑,临床用来治疗肌萎缩侧索硬化症的神经保护剂,研究发现其通过选择性、强烈的上抬GLT-1的表达水平而发挥其神经保护作用[15]。近来的临床研究显示,在难治性抑郁和双相抑郁症患者中证实了利鲁唑的抗抑郁效应[16]。
在本研究中,我们通过免疫组织化学法和Western blot分析证实了慢性氟西汀治疗逆转了CUS诱导的前额叶GLT-1表达的下降,同时明显改善了CUS实验动物的行为学改变。提示GLT-1表达的上抬可能是氟西汀抗抑郁作用的机制之一,这一发现同时也支持了谷氨酸系统参与了抗抑郁药的活动机制的假说[2, 3]。最近一项研究提示,Zink 等[9]发现氟西汀具有诱导皮层和海马的谷氨酸转运体EAAT2(GLT1)的表达。我们的研究与Zink等的研究是一致的,Zink等用氟西汀治疗的是健康正常大鼠,而我们治疗的是应激大鼠。因此,我们的设计更接近于临床抑郁症的发病和治疗过程。
总之,我们的研究证实了谷氨酸转运体GLT-1可能参与了氟西汀的抗抑郁活动。然而,关于氟西汀调节谷氨酸转运体GLT-1表达的精确机制还必须进一步研究,特别是其中涉及到的第二信使系统还不明确,研究表明,氟西汀抗抑郁活动主要与CAMP信号系统有关[17],而谷氨酸转运体的调节主要在转录、翻译和翻译后的调节[18],这两者之间细胞内分子的交接可能为解决GLT-1参与氟西汀的抗抑郁活动精确机制,甚至为临床抗抑郁活动的延迟效应产生的机制提供了方向。
| [1] | Doris A, Ebmeier K, Shajahan P. Depressive illness[J]. Lancet, 1999;354(9187):1369-75. |
| [2] | 戴建国, 陈 琳, 赵玉男, 等. 基于星形胶质细胞靶点的抑郁症发病机制研究进展[J].中国药理学通报, 2010, 26(9):1132-5. Dai J G, Chen L, Zhao Y N, et al. Research advancement of depression pathogenesis on astrocyte targets[J]. Chin Pharmacol Bull, 2010, 26(9):1132-5. |
| [3] | 刘佳莉, 苑玉和, 陈乃宏. 抑郁症的治疗研究进展[J]. 中国药理学通报, 2011, 27(9):1193-6. Liu J L, Yuan Y H, Chen N H. Research progress in treatment of depression[J]. Chin Pharmacol Bull, 2011, 27(9):1193-6. |
| [4] | Lehre K P, Levy L M, Ottersen O P, et al. Differential expression of two glial glutamate transporters in the rats brain:quantitiative and immunocyochemical observations[J].J Neurosci, 1995, 15(3pt1):1835-53. |
| [5] | Rajkowska G, Miguel-Hidalgo J J. Gliogenesis and glial pathology in depression[J]. CNS Neurol Disord Drug Targets, 2007, 6(3):219-33. |
| [6] | Choudary P V, Molnar M, Evans S J, et al. Altered cortical glutamatergic and GABAergic signal transmission with glial involvement in depression[J]. PNAS, 2005, 102(43):15653-8. |
| [7] | Zink M, Vollmayr B, Gebicke-Haerter P J, et al. Reduced expression of glutamate transporters vGluT1, EAAT2 and EAAT4 in learned helpless rats, an animal model of depression[J]. Neuropharmacology, 2010, 58(2):465-73. |
| [8] | Mineur Y S, Picciotto M R, Sanacora G. Antidepressant-like effects of ceftriaxone in male C57BL/6J mice[J]. Biol Psychiatry, 2007, 61(2):250-2. |
| [9] | Zink M, Rapp S, Donev R, et al. Fluoxetine treatment induces EAAT2 expression in rat brain[J]. J Neural Transm, 2011, 118(6):849-55. |
| [10] | Banasr M, Valentine GW, Li X, et al. Chronic unpredictable stress decreases cell proliferation in the cerebral cortex of the adult rat[J]. Biol Psychiatry, 2007, 62(5):496-504. |
| [11] | Yang C, Wang G, Wang H, et al. Cytoskeletal alterations in rat hippocampus following chronic unpredictable mild stress and re-exposure to acute and chronic unpredictable mild stress[J]. Behavioural Brain Res, 2009, 205(2):518-24. |
| [12] | Kanai Y, Hediger M A. The glutamate/neutral amino acid transporter family SLC1:molecular, physiological and pharmacological aspects[J]. Pflugers Arch Eur J Physiol, 2004, 447(5):469-79. |
| [13] | Beart P M, O'Shea R D. Transporters for L-glutamate:An update on their molecular pharmacology and pathological involvement[J]. Br J Pharmacol, 2007, 150(1):5-17. |
| [14] | Rothstein J D, Patel S, Regan M R, et al. Beta-lactam antibiotics offer neuroprotection by increasing glutamate transporter expression[J]. Nature, 2005, 433(7021):73-7. |
| [15] | Carbone M, Duty S, Rattray M. Riluzole elevates GLT-1 activity and levels in striatal astrocytes[J]. Neurochem Int, 2012, 60(1):31-8. |
| [16] | Sanacora G, Kendell S F, Levin Y, et al. Preliminary evidence of riluzole efficacy antidepressant-treated patients with residual depressive symptoms[J]. Biol Psychiatry, 2007, 61(6):822-5. |
| [17] | Thome J, Sakai N, Shin K, et al. cAMP response element-mediated gene transcription is upregulated by chronic antidepressant treatment[J]. J Neurosci, 2000, 20(11):4030-6. |
| [18] | Danbolt N C. Glutamate uptake[J]. Prog Neurobiol, 2001, 65(1):1-105. |