肺癌是世界上发病率和死亡率最高的恶性肿瘤之一,全球每年有138万肺癌新增病例和超过100多万人死于肺癌,其中,非小细胞肺癌 (non-small cell lung cancer,NSCLC)占肺癌的80%~85%,其5年生存率不到15%[1]。NSCLC患者中,约30%的患者在诊断时就已发生远处转移,50%~60%的患者在治疗过程中发生远处转移,并且最终80%~90%的患者都死于肺癌的转移[2]。因此,抑制和预防肺癌细胞转移是治疗NSCLC和提高患者生存率的关键。肿瘤转移受多因素、多步骤调控,主要包括肿瘤细胞间黏附力降低,而与细胞外基质(extracellular matrix,ECM)黏附力增强、降解ECM和基底膜、肿瘤细胞迁移、侵袭能力的增强,从而进入血流或淋巴系统,最终到达靶器官形成新的肿瘤生长[3]。因此,抑制NSCLC细胞黏附、侵袭和迁移是抑制其转移的基础。中药桔梗在临床上常用于治疗肺部和呼吸系统疾病,桔梗皂苷-D(platycodin-D,PD)是从其中分离提取的一种三萜类单体,它是桔梗抗癌的主要有效成分。近年国内外的研究发现,PD对肺癌、胃癌、乳腺癌和人白血病等多种肿瘤细胞具有抑制增殖和诱导凋亡作用[4, 5]。此外,在PD抑制肿瘤转移方面,研究仅发现PD单独或联合蛇床子对乳腺癌侵袭和迁移具有抑制作用[5, 6],然而,其对NSCLC侵袭和迁移的研究尚未开展。本实验旨在探究PD对两种NSCLC细胞肺大细胞肺癌H460和肺腺癌细胞A549黏附、侵袭和迁移能力的影响及其作用机制,为PD抑制NSCLC转移提供实验基础和依据。
1 材料与方法 1.1 材料 1.1.1 药品与试剂桔梗皂苷-D,分子量1224.58,上海源叶生物科技有限公司,批号:20110402。该化合物最初溶于二甲亚砜(DMSO),为使用前的原液(DMSO的最终浓度小于0.01%)。RPMI 1640和DMEM/F12培养液:HyClone,USA;胎牛血清:Gibco,USA;磷酸缓冲盐(PBS):Solarbio;胰酶、Ⅰ型胶原蛋白(CollagenⅠ)、牛血清蛋白(BSA)、凝胶试剂盒:碧云天;聚偏二氟乙烯膜(PVDF):Millipore,Germany;Transwell小室:Corning,USA;抗体均为美国Cell Signaling公司;TRIzol: Invitrogen,America;cDNA第一链合成试剂盒:Fermentas,Lithuania;Realtime PCR Master Mix(SYBR Green) :Toyobo,Japan。
1.1.2 仪器CO2细胞培养箱 (日本SANYO公司);超净工作台(苏州净化设备有限公司);自动酶标仪、凝胶成像系统(美国Bio-Rad公司);倒置荧光相差显微镜、荧光显微镜、图像获取系统(日本Olympus公司);荧光定量PCR循环仪(中国中山达安);核酸电泳仪(中国北京六一);PCR循环仪、高速低温离心机(美国Labnet公司);流式细胞仪(美国Becton Dickinson公司)。
1.1.3 细胞株肺腺癌A549细胞和肺大细胞肺癌H460细胞,购自中国科学院上海生命科学院生物化学与细胞生物学研究所。
1.2 方法 1.2.1 细胞培养将A549细胞培养于含10%胎牛血清DMEM/F12培养液中;将H460细胞培养于含10%胎牛血清的DMEM培养液中。置37℃、体积分数为 5%的 CO2培养箱中培养。实验时取对数生长期细胞。
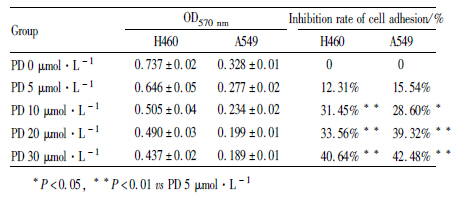
1.2.2 细胞黏附实验96孔培养板包被:每孔加入CollagenⅠ溶液50 μL,置37℃、5% CO2孵箱孵育1 h;PBS洗2次,加入3% BSA 0.2 mL,孵育2 h,PBS再洗2次,备用。分别取不同浓度PD(0、5、10、20、30 μmol·L-1)作用24 h后的H460和A549细胞,经洗涤、消化后用含10%胎牛血清DMEM液稀释,调整细胞浓度为8×108·L-1,分别加入到包被过的96孔板,每孔100 μL,每组设5个平行复孔,37℃、5% CO2条件下温育2 h。温育结束后弃去各孔培养液,PBS冲洗,除去未黏附细胞,每孔加50 μL MTT使用液(PBS溶解,1×103 mg·L-1),细胞培养箱温育3 h。吸弃MTT使用液,每孔加DMSO 150 μL,溶解结晶后,酶标仪测波长570 nm下各孔OD值。以PD(0 μmol·L-1)组为空白对照组,黏附抑制率=(1-实验组OD值 / 对照组OD值)×100%。
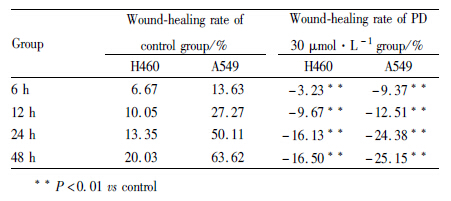
1.2.3 划痕实验取对数生长期的H460和A549细胞,按每孔 1×106个接种于6孔板中,待细胞贴壁长到 90%时,用20 μL移液器枪头在每孔的中间垂直划线。然后用PBS洗涤3次,去除掉落的细胞,加入PD (0、30 μmol·L-1)处理后,置37℃、5%的 CO2培养箱中继续培养。于镜下观察PD作用0、6、12、24、48 h后划痕宽度变化并拍照(×100),每组实验重复 3 次。分别计算3条平行划痕的平均宽度(每条划痕各取3个固定位置计算宽度)。划痕愈合率/%=(初始划痕宽度-指定时间的划痕宽度)/ 初始划痕宽度×100%。
1.2.4 Transwell小室侵袭实验Transwell小室含有基质,胶纤维膜孔径为8 μm,下室中加入600 μL含10%胎牛血清的培养液,上室加入100 μL不含胎牛血清的培养液,然后按照1×108·L-1在上室加入PD(0、10、 20、30 μmol·L-1)处理后的细胞悬液30 μL,置于37℃、5% CO2的培养箱中培养72 h,取出滤膜,甲醇固定,姬姆萨染色,显微镜下每张滤膜随机取5个视野(×200),计数穿膜细胞数,取平均数表示每种肿瘤细胞的侵袭能力。
1.2.5 RT-PCR采用TRIzol细胞裂解法提取组织RNA,测定样品RNA在波长260和280 nm处的吸光度比值,检测其纯度和浓度。设计并合成扩增引物序列及PCR产物大小:Human-GAPDH primer (132 bp),Sense primer: 5′-ATCGTGGAAGGACTCA-3′,Antisense primer: 5′-CCAGTAGAGGCAGGGATGAT-3′;Human-MMP2 primer (146 bp),Sense primer:5′-CTACTGAGTGGCCGTGTTTG-3′,Antisense primer: 5′-GGAAGCTCTGACCTTTCCAG-3′;Human-MMP9 primer (136 bp),Sense primer: 5′-TCTTCCAAGGCCAATCCTAC-3′,Antisense primer: 5′-ATCACCGTCGAGTCAGCTC-3′。cDNA合成条件:取2 μg提取RNA,加入20 μL的反应体系中,PCR扩增条件:逆转录产物用无核酸酶的水稀释10倍,取20 μL用于扩增,95℃ 5 min,94℃ 15 s,60℃ 20 s,72℃ 40 s,共40个循环;每秒升高0.1℃直至升高到95℃停止。取10 μL PCR产物经2%琼脂糖电泳鉴定,缓冲液冷却循环器凝胶图像分析系统摄片,并分析其光密度,结果以目的基因与内参基因(Human-GAPDH)吸光度的比值2-ΔΔCT表示。
1.2.6 Western blot 检测细胞内相关蛋白变化取对数生长期的细胞消化接种到6孔板中,细胞密度为5×108·L-1,药物处理一定时间后,收集细胞PBS洗涤2次,每孔加入细胞裂解液200 μL,1200 r·min-1离心20 min。蛋白定量:取蛋白,加入4×上样缓冲液,100℃下变性5 min。15%的聚丙烯酰胺SDS凝胶电泳后,转移至PVDF膜上,5%脱脂牛奶封闭后依次加入第一、二抗体,在室温下孵育2 h,TBST缓冲液洗涤3次,每次10 min,滴加ECL发光试剂,于凝胶成像系统曝光。
1.2.7 统计学方法应用SPSS 19.0统计软件对数据进行统计学处理。对计量资料,所得数据用 表示,样本均数比较采用Student′s t-test检验或单因素方差分析(one way ANOVA)。
表示,样本均数比较采用Student′s t-test检验或单因素方差分析(one way ANOVA)。
不同浓度的 PD(0、5、10、 20、30 μmol·L-1)分别作用 H460和A549细胞 24 h 后[PD(0 μmol·L-1)组为空白对照组],采用细胞黏附实验检测细胞黏附能力。结果表明,PD 作用后,H460和A549细胞黏附能力都逐渐减弱,即细胞黏附抑制率皆逐渐升高,并呈浓度依赖性(Tab1),与PD(5 μmol·L-1)组的细胞黏附抑制率相比,各组间差异有统计学意义(P<0.05)。
采用划痕实验检测PD对H460和A549细胞迁移能力的影响。如Fig1所示,PD(30 μmol·L-1)分别作用H460和A549细胞0、6、12、24、48 h后,划痕宽度逐渐增大,划痕两侧的细胞密度逐渐减少;相反,H460和A549细胞的空白对照组(Control)生长0、6、12、24、48 h后,划痕宽度逐渐减小,划痕两侧的细胞密度逐渐增大。同时,两种细胞的Control组划痕愈合率逐渐增大,PD(30 μmol·L-1)作用组逐渐减小,并且与同一作用时间的Control组相比,差异有统计学意义( P<0.01),见Tab2。

|
| Fig 1 Effects of PD on cell migration ability of H460 and A549 cells(n=3) |
Transwell小室侵袭实验检测PD对H460和A549细胞侵袭能力的改变,结果发现,PD(10、20、30 μmol·L-1)作用 24 h 后,H460和A549细胞的处理组穿过微孔滤膜的细胞数明显低于对照组(P<0.01),并呈浓度依赖性(Fig2)。
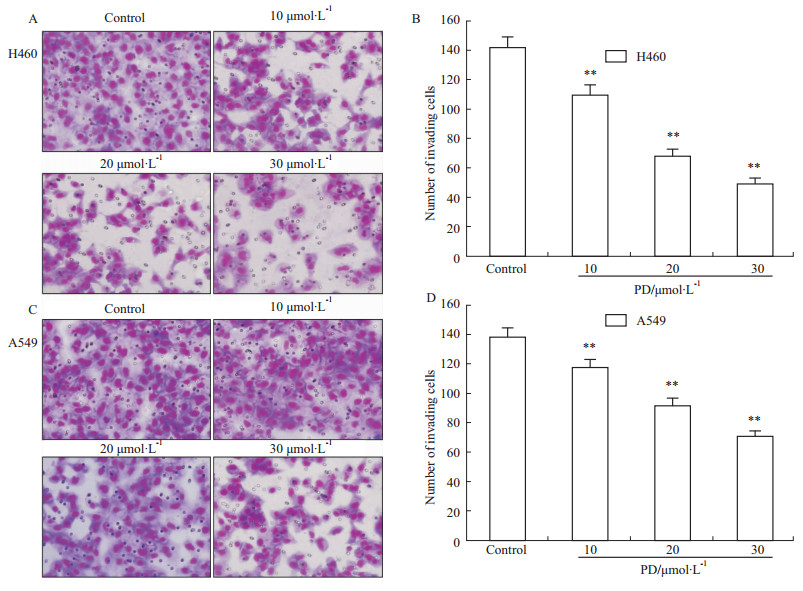
|
Fig 2
Effects of PD on cell invasion ability in H460 and A549 cells( , n=3)
**P<0.01 vs control , n=3)
**P<0.01 vs control
|
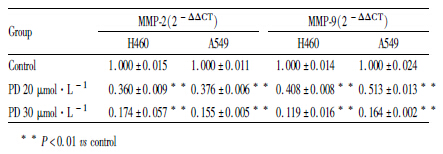
利用RT-PCR进一步研究PD对H460和A549细胞中与癌细胞黏附、侵袭和迁移密切相关的金属蛋白酶-2(MMP-2)和金属蛋白酶-9(MMP-9)mRNA水平的调控。如Tab3所示,PD有效抑制了H460和A549细胞中MMP-9 和 MMP-2 mRNA的表达,并随PD浓度增加抑制作用增强,与Control组相比差异有统计学意义(P<0.01)。
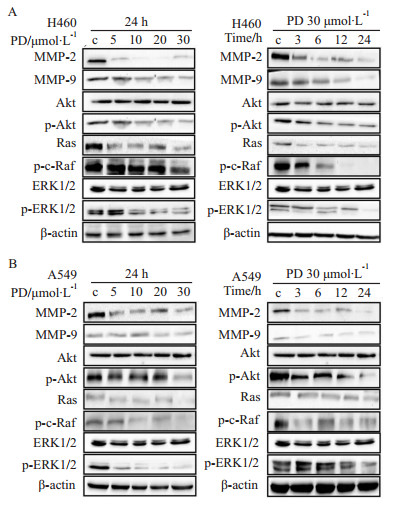
为进一步探究PD抑制H460和A549细胞黏附、迁移和侵袭的作用机制,本实验利用Western blot检测MMP-2和MMP-9蛋白表达。结果表明,与PD抑制了H460和A549细胞中MMP-9 和 MMP-2 mRNA的表达相一致,PD下调MMP-2和MMP-9蛋白表达,并且呈浓度和时间依赖性(Fig3)。同时,进一步探测PD抑制 MMP-2和MMP-9蛋白后,其上游ERK信号通路中Ras、p-c-Raf和p-ERK 1/2以及 p-Akt表达变化。如Fig3所示,PD分别作用H460和A549细胞后,细胞中Ras、p-c-Raf、p-ERK 1/2和 p-Akt蛋白表达水平降低,表明PD抑制ERK信号通路和p-Akt的表达,并且呈浓度和时间依赖性。
|
| Fig 3 Regulation of expression levels of MMP-2/9, upstream related proteins of ERK signaling pathway and p-Akt induced by PD in H460(A) and A549(B) cells(n=3) **P<0.01 vs control |
NSCLC占肺癌的80%~85%,具有低生存率、高转移率的特点,并且80%~90%的NSCLC患者死亡和复发是由转移引起的。桔梗入药始载于《神农本草经》,味苦、辛,性平,归肺经,临床上以桔梗为主药组成方剂治疗急性上呼吸道感染、肺脓疡、肺脓肿、肺癌和纵隔肿瘤等肺部疾病,均取得较好的疗效[7]。PD是从中药桔梗中分离提取的一种三萜类单体,是桔梗抗癌作用的有效成分,其对多种肿瘤细胞具有杀伤作用。在抑制肿瘤转移方面,现仅有文献报道PD具有抑制乳腺癌侵袭和迁移作用,PD对肺癌转移的影响及其机制研究尚未开展。
肿瘤转移是多基因、多因素、多步骤的生物学行为。降低癌细胞与ECM间黏附力是癌细胞转移的开始,本实验首先由细胞黏附实验探究PD作用后H460和A549细胞与ECM蛋白CollagenⅠ黏附能力的改变,结果表明PD降低两种细胞黏附能力,并呈浓度依赖性。癌细胞与ECM黏附后,侵袭ECM和基底膜,分泌多种蛋白水解酶,降解ECM和基底膜,使细胞穿越破损的基底膜脱离、迁离原发灶,进而随血液或淋巴循环发生肿瘤转移[8]。因此,降低癌细胞侵袭和迁移能力是抑制肿瘤转移的关键。本实验通过划痕实验和Transwell小室侵袭实验发现,PD有效抑制H460和A549细胞迁移和侵袭。
ECM和基底膜的改变是肿瘤浸润转移的重要环节。Ⅳ型胶原纤维是ECM和基底膜的重要组分之一,金属蛋白酶家族(matrix metalloproteinases,MMPs)中的MMP-2和MMP-9能有效地将其降解[9]。研究证实,MMP-2和MMP-9不仅可以降解ECM和基底膜,参与肿瘤黏附、侵袭和血管的侵入,而且与原发及转移瘤的生长、肿瘤的血管生成及肿瘤恶变有关[10]。此外,在多种具有侵袭性和高转移肿瘤中都发现有MMP-2和MMP-9的表达增高。目前,研究表明MMP-2和MMP-9的表达水平与肺癌的分期、转移和预后密切相关[11]。因此,抑制MMP-2和MMP-9的表达是抑制NSCLC侵袭和迁移的关键。采用RT-PCR 和Western blot研究发现,PD作用H460和A549细胞后,不仅在基因水平降低细胞中MMP-9 和 MMP-2 mRNA的表达,而且在蛋白质的水平下调H460和A549细胞中MMP-2和MMP-9蛋白的表达,并呈时间和浓度依赖性。因此,PD抑制NSCLC细胞黏附、侵袭和迁移与抑制MMP-2和MMP-9的表达有关。
大量研究证明,MMP-9和MMP-2的表达主要受上游丝氨酸/苏氨酸蛋白激酶家族(MAPKs)信号通路的调控。激活MAPKs通路可上调MMP-2和MMP-9的表达,促进肿瘤细胞的侵袭和迁移,反之,则抑制肿瘤侵袭转移[12] 。MAPKs信号通路主要包括细胞外信号调节激酶 (extracellular signal-regulated kinase,ERK)通路、p38 MAPK通路和c-Jun-N端激酶(JNK)通路。并且,ERK信号通路即Ras/Raf/ERK信号通路在许多肿瘤的增殖、分化、侵袭、迁移和凋亡过程中起主要作用[13]。本实验通过对Ras/Raf/ERK信号通路进一步研究发现,PD可下调H460和A549细胞中Ras、p-c-Raf和p-ERK 1/2的表达,并呈浓度和时间依赖性。因此,PD抑制MMP-9和MMP-2表达可能与抑制其上游ERK信号通路有关。
此外,Akt通过激活MMP-9和MMP-2促进肿瘤的侵袭和迁移[13, 14]。因此,抑制Akt的表达被作为抑制肿瘤转移的调控靶点。并且研究发现,Akt的激活即形成磷酸化的Akt(p-Akt)与NSCLC的转移密切相关,p-Akt的过表达可以提高NSCLC黏附、侵袭和转移能力[15]。本实验研究表明,PD抑制H460和A549细胞中p-Akt的表达,并且呈浓度和时间依赖性。
综上,本实验结果首次证明了PD抑制NSCLC细胞H460和A549细胞黏附、侵袭和迁移,其作用与下调MMP-2和MMP-9 mRNA和蛋白的表达及抑制其上游ERK信号通路和p-Akt表达有关。由此表明,PD具有较好的抗NSCLC转移作用,为PD的进一步药物研发和临床应用提供了实验基础和依据。然而,PD抑制MMP-2和MMP-9表达上游多个信号通路调控,和信号中的关键靶蛋白及其对应的靶基因,有待通过靶蛋白抑制剂和siRNA沉默干扰技术深入研究,并且亟需通过体内实验进一步验证PD抑制NSCLC转移的作用。
| [1] | Anderws J, Yeh P, Pao W, et al. Molecular predictors of response to chemotherapy in non-small cell lung cancer[J]. Cancer J, 2011, 17(2):104-13. |
| [2] | Berghmans T, Paesmans M, Sculier J P. Prognostic factors in stage Ⅲ non-small cell lung cancer:a review of conventional, metabolic and new biological variables[J]. Ther Adv Med Oncol, 2011, 3(3):127-38. |
| [3] | Fried P, Wolf K. Tumour cell invasion and migration:diversity and escape mechanisms[J].Nat Rev Cancer, 2003, 3(5):362-74. |
| [4] | Chun J, Ha I J, Kim Y S. Antiproliferative and apoptotic activities of triterpenoid saponins from the roots of Platycodon grandiflorum and their structure-activity relationships[J]. Planta Med, 2013, 79(8):639-45. |
| [5] | Chun J, Kim Y S. Platycodin D inhibits migration, invasion, and growth of MDA-MB-231 human breast cancer cells via suppression of EGFR-mediated Akt and MAPK pathways[J]. 2013, 205(3):212-21. |
| [6] | 韩向晖, 叶依依, 郭保凤, 等. 桔梗皂苷D配伍不同中药有效成分对乳腺癌4T1和MDA-MB-231细胞增殖及侵袭的影响[J]. 中西医结合学报, 2012, 10(1):67-75. Han X H, Ye Y Y, Guo B F, et al. Effectd of platycodin D in combination with different active ingredients of Chinese herbs on proliferation and invasion of 4T1 and MDA-MB-231 breast canser cell lines[J]. J Chin Integrat Med, 2012, 10(1):67-75. |
| [7] | 郭 丽, 张 村, 李 丽, 等. 中药桔梗的研究进展[J]. 中国中药杂志, 2007, 32(3):181-6. Guo L, Zhang C, Li L, et al.Advances in studies on Platycodon grandiflorum[J]. Chin J Chin Mater Med, 2007, 32(3):181-6. |
| [8] | Deryugina E I, Deryugina J.P, Quigley. Matrix metalloproteinases and tumor metastasis[J]. Cancer Metastasis Rev, 2006, 25(1):9-34. |
| [9] | Mumprecht V, Detmar M. Lymphangiogenesis and cancer metastasis[J]. J Cell Mol Med, 2009, 13(8A):1405-16. |
| [10] | Bourboulia D, Stetler-Stevenson W G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs):positive and negative regulators in tumor cell adhesion[J]. Semin Cancer Biol, 2010, 20(3):161-8. |
| [11] | 薛 洋, 周清华, 张尚福, 等.MMP-2、MMP-9在肺癌中的表达及其与肺癌转移和预后关系的研究[J].华西医学, 2008, 23(2):225-7. Xue Y, Zhou Q H, Zhang S F, et al. A study on the relationship between expression of MMP-2, MMP-9 and metastasis and prognosis in patients with lung cancer[J]. West China Med J, 2008, 23(2):225-7. |
| [12] | Lu K H, Yang H W, Su C W, et al. Phyllanthus urinaria suppresses human osteosarcoma cell invasion and migration by transcriptionally inhibiting u-PA via ERK and Akt signaling pathways[J]. Food Chem Toxicol, 2013, 52(1):193-9. |
| [13] | Lu Z, Lu N, Li C, et al. Oroxylin A inhibits matrix metalloproteinase-2/9 expression and activation by up-regulating tissue inhibitor of metalloproteinase-2 and suppressing the ERK1/2 signaling pathway[J]. Toxicol Lett, 2012, 209(3):211-20. |
| [14] | Bauvois B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:outside-in signaling and relationship to tumor progression[J]. Biochim Biophys Acta, 2012, 1825(1):29-36. |
| [15] | 熊 飞, 詹 瑧, 张 旭, 等.PI3K/Akt信号转导通路在非小细胞肺癌中的作用[J]. 中国药理学通报, 2010, 26(10):1264-7. Xiong F, Zhan Z, Zhang X, et al. The effect of PI3K/Akt signal transduction pathway in non-small cell lung cancer[J]. Chin Pharmacol Bull, 2010, 26(10):1264-7. |