


胸腺肽-β4在自然界中广泛存在。最初被推测具有胸腺激素的功能[1],随后的研究发现,他们可以阻隔G-肌动蛋白的聚合,调节G-肌动蛋白形成细胞骨架。此外,胸腺肽-β4在加快伤口愈合、促进心血管生成、保护心脏、治疗肿瘤、延缓内皮细胞衰老、促进头发毛囊发育、抗微生物和抗炎等多方面都有作用[2, 3]。因此,它们是很有应用潜力的一类多肽。目前,相关多肽已进入治疗慢性损伤和急性心肌梗死的一期临床评估[4]。
两栖动物在适应水陆两种类型生存环境的过程中,在皮肤中进化形成了许多具有药理活性的防御分子,如抗菌肽、胰岛素释放肽、类鸦片活性肽、亲肌肉肽和胸腺肽-β4等,但作为重要的防御分子的胸腺肽-β4目前仅在棕点湍蛙和蟾蜍被报到[5, 6]。在本研究中,我们报道了双团棘胸蛙皮肤胸腺肽-β4的基因和促血管生成作用。这为治疗伤口愈合和缺氧性相关疾病提供了新的候选药物分子,并为研究物种进化提供证据。现将结果报道如下:
1 材料与方法 1.1 材料体重35~72 g的成年双团棘胸蛙(Nanorana yunnanensis)采自云南昆明;10 日龄受精鸡胚购自华南农业大学;TRIzol溶液为美国Invitrogen公司产品;cDNA文库构建试剂盒来自CLONTECH公司;pMD-18T载体克隆试剂盒、Taq酶及相关试剂为TaKaRa产品;胶回收试剂盒来自PROMEGA公司;重组人碱性成纤维细胞生长因子(rh-bFGF)来自北京双鹭药业股份有限公司(批号:20041212);定性滤纸为英国Whatman公司产品(批号:002090);RPMI 1640培养基、胰酶、小牛血清均来自Gibco公司;BD BiocoatTM血管生长板来自BD Biosciences公司;MTT检测试剂盒来自建成生物工程研究所;其他试剂均为国产分析纯。
1.2 方法 1.2.1 目标片段扩增以棕点湍蛙和哺乳动物胸腺肽-β4的cDNA序列为参考设计引物TP1和TP2,并分别与建库时的5′ PCR primer引物和CDS III/3′ PCR primer的修饰引物TP3配对,扩增双团棘胸蛙皮肤胸腺肽-β4的cDNA的5′端和3′端,引物序列对如下:5′端cDNA扩增引物对:5′ PCR primer:5′-AAGCAGTGGTATCAACGCAGAGT-3′,反向引物TP1:5′-TTCATGCACGGTCTTTCATGCCACC-3′;3′端cDNA扩增引物对:正向引物TP2:5′-GGCCTTCTAAAGAAACAATTGAACAAG-3′,反向引物TP3:5′-ATTCTAGAGGCCGAGGCGGCCGACATG-3′。TRIzol提取皮肤总RNA后,cDNA文库构建试剂盒扩增总cDNA,以100倍稀释的总cDNA为模板扩增目标片段。PCR反应程序为: ①95℃,4 min;②35个循环:94℃,30 s;56℃,30 min;72℃,55 s;③72℃,10 min。取5 μL PCR产物作1%琼脂糖凝胶电泳检测,用胶回收试剂盒回收PCR产物克隆到载体后测序。
1.2.2 序列分析及系统进化树的构建根据相似性拼接测序结果,并在NCBI非冗余序列数据库(nr)中进行同源性搜索;用Clustal W 1.83软件进行同源性分析及多重序列比较;用Mega 3.0软件进行系统发育分析;用邻接法构建系统进化树,自展检验估计NJ法所构建系统树的可靠性,重复次数为1 000。
1.2.3 促血管生成活性的检测双团棘胸蛙胸腺肽pTβ4-1和pTβ4-2由本实验室采用Fmoc法合成;鸡胚绒毛尿囊膜(CAM)实验和人脐静脉内皮细胞(HUVEC)增殖、小管形成实验依据我们以前报道的方法进行[7]。内皮细胞小管生成和增殖率计算公式: 增长百分率/%=(试验组平均值-生理盐水对照组平均值)/生理盐水对照组平均值×100%。
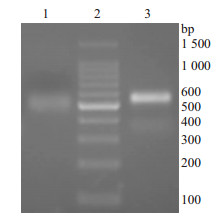
2 结果 2.1 双团棘胸蛙皮肤胸腺肽-β4的扩增结果如Fig1所示,我们利用四对引物扩增到了两个片段,他们的大小在500 bp左右,与棕点湍蛙相应片段的大小很相似。
|
| Fig 1 PCR of the genes of thymosin-β4 from Nanorana yunnanensis skins 1: The PCR product of antisense TP1 and 5’ PCR primer; 2: DL 1 500 marker; 3: The product of sense TP2 and TP3 primer. |
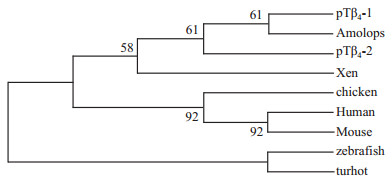
根据测序结果进行拼接,我们得到pTβ4-1和pTβ4-2的cDNA序列。它们的cDNA序列及推导氨基酸序列如Fig2所示。pTβ4-1和pTβ4-2的cDNA和蛋白序列间的相似性分别为90.3%和93.2%。含44个氨基酸的成熟蛋白的编码区都有2个连在一起的终止密码;3′-端的非翻译区都包含一个26 bp或28 bp碱基的Ploy(A)尾巴和一个加尾识别信号(AATAAA);pTβ4-1及pTβ4-2的推导蛋白包含有胸腺肽β4保守的两端α-螺旋区和中间的G-肌动蛋白结合区。与其他动物来源的胸腺肽-β4氨基酸序列比较(Fig3),他们的变异发生在16位点和40位后的氨基酸,因此pTβ4-1及pTβ4-2的核酸和蛋白序列都具有胸腺肽-β4的典型结构特征[2, 3, 6]。此外,从Fig4来看,pTβ4-1和pTβ4-2在进化树上和棕点湍蛙的最近,和鱼类最远。

|
| Fig 2 Nucleotide and deduced amino acid sequences of thymosin-β4 from Nanorana yunnanensis skin The nucleotide sequences are from 5 to 3 terminal and the responding amino acid sequences are shown below. * is stop code at 3’ terminal and _ is stop code at 5’ terminal.__are polyA recongination signal. A:The sequence of pTβ4-1; B:The sequence of pTβ4-2. |

|
| Fig 3 Multiple amino acid sequence alignment between the deduced amino acid sequence of Nanorana yunnanensis skin thymosin-β4 and other known thymosins-β4 The common amino acids are marked with ﹡. The pTβ4-1 and pTβ4-2 are deduced amino acid sequences of thymosin-β4 from Nanorana yunnanensis skin and other thymosins-β4 genes are from GenBank. |
|
| Fig 4 Phylogenetic tree of thymosin-β4 amino acid sequences from 8 species Scientific name of 8 species and GenBank accession referred to Fig 4;Numbers at node are bootstrap values (1 000 replicates). |
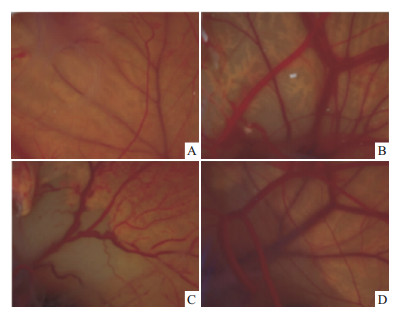
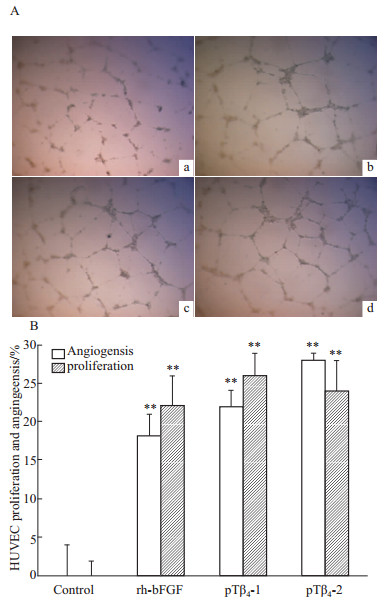
鸡胚绒毛尿囊膜血管生成实验结果如Fig5所示,生理盐水对照和药物处理组的CAM血管均生长良 好,颜色鲜红,血管分支适中,网络清晰;但是 rh-bFGF、pTβ4-1和pTβ4-2处理组比生理盐水对照组的周边血管生长更旺盛,密度明显增大,管径粗且分支多。HUVEC增殖和血管形成结果如Fig6A所示,细胞被处理16 h后,生理盐水对照组与药物处理组均有血管环形成,内皮细胞聚集发生。但是,接种双团棘胸蛙皮肤胸腺肽pTβ4-1及pTβ4-2到HUVECs细胞16 h后明显增加了内皮细胞网的面积、网管长度、网管数目和支点数目,它的效果和50 mg·L-1 rh-bFGF相接近。根据统计学分析,相对于生理盐水对照组,50 mg·L-1 rh-bFGF、20 mg·L-1 pTβ4-1和20 mg·L-1 pTβ4-2处理组的血管内皮细胞增殖增长率为(22.2±4.1)%、(26.3±3.4)%、(24.1±4.2)%,而小管形成增长率为(18.2±3.1)%、(22.4±2.0)%、(28.1±4.2)%(Fig6B)。因此,rh-bFGF、Tβ4-1和Tβ4-2均能促进内皮细胞小管形成和增殖,以及鸡胚绒毛尿囊膜血管生长。
|
| Fig 5 Pro-angiogenic effect of thymosin-β4 from Nanorana yunnanensis in CAM A: Control; B: 20 μg rh-bFGF; C: 5 μg pTβ4-1; D: 5 μg pTβ4-2 |
|
| Fig 6 Effects of thymosin-β4 from Nanorana yunnanensis on proliferation and tube formation of HUVECs A: Classic figures of proliferation and tube formation of HUVECs treated by normal saline (a), 50 mg·L-1 rh-bFGF (b), 20 mg·L-1 pTβ4-1 (c) and 20 mg·L-1 pTβ4-2 (d); B: Statistical analysis of proliferation and tube formation of HUVEC treated by 50 mg·L-1 rh-bFGF, 20 mg·L-1 pTβ4-1 and pTβ4-2. **P<0.01 vs control group |
胸腺肽-β4是广泛存在的蛋白家族。它有数个活性位点,N末端的SDKP通常抑制炎症和降低纤维化,另外一个活性位点是包含了SDKP的N末端15个氨基酸,它能促进细胞生存和抑制凋亡,第三个活性位点LKKTETQ是激动蛋白结合域,其与血管生成、伤口治疗、细胞迁移、肥大细胞脱颗粒等密切相关。这些活性位点的序列在所有胸腺肽-β4内几乎100%相似[2, 3]。本研究首次报道了来源于双团棘胸蛙皮肤胸腺肽-β4的序列和促血管生成作用。他们与来源于人类、家鼠、家鸡、爪蟾、斑马鱼、大比目鱼和棕点湍蛙的胸腺肽-β4氨基酸序列有77%~93%的相似性。双团棘胸蛙皮肤胸腺肽-β4的一级结构与已报道四足动物和人的胸腺肽-β4在两端的α-螺旋区(4~15、30~40位点)及G-肌动蛋白结合区(17~25位点)氨基酸序列完全相同,氨基酸残基有变化的位点为16位点及C-末端的40以后的几个位点。这些特点符合胸腺肽-β4的典型特征,也能解释其促血管活性。
人类及家鼠研究表明,胸腺肽-β4属于多基因家族[8, 9]。在同一组织或细胞,尤其在处于发育及分化不同阶段的组织或细胞中有多个不同胸腺肽-β4 mRNA表达以满足发育及分化的时空性需求。因此,这些胸腺肽-β4在同一组织或细胞中可能有不同的功能[8, 9]。我们利用保守序列克隆得到Tβ4-1和Tβ4-2的cDNA。Tβ4-1和Tβ4-2有三个氨基酸的差异,但有完全相同的功能区氨基酸和类似的促进血管生长作用。这种多样性的存在可能与他们分别有其他功能或者两个蛋白出现的时空差异有关。
在人类及其他哺乳动物皮肤仅有少量的胸腺肽-β4,两栖动物中只在非洲爪蟾的卵和棕点湍蛙皮肤证实有mRNA的表达,但其功能却有待明确。胸腺肽-β4有多种多样的功能和作用,如促进血管生成、加速伤口愈合、促进毛发再生及抗微生物等[2, 3]。鉴于两栖类动物皮肤分泌物丰富,该类动物易于养殖,我们对双团棘胸蛙皮肤胸腺肽-β4的研究结果将促进该类动物的资源利用。最新研究表明,胸腺肽-β4可以在大肠杆菌里实现高纯度表达。此外,合成的胸腺肽-β4也具有很高的活性[10, 11]。这将意味着双团棘胸蛙皮肤胸腺肽-β4可能成为高价值和前景的药物,继而在临床上推广使用。
| [1] | Goldstein A L, Guha A, Zatz M M, et al. Purification and biological activity of thymosin, a hormone of the thymus gland[J]. Proc Natl Acad Sci USA, 1972, 69(7):1800-3. |
| [2] | Sosne G, Qiu P, Goldstein A L, et al. Biological activities of thymosin beta4 defined by active sites in short peptide sequences[J]. FASEB J, 2010, 24(7):2144-51. |
| [3] | Philp D, Goldstein A L, Kleinman H K. Thymosin beta4 promotes angiogenesis, wound healing, and hair follicle development[J]. Mech Ageing Dev, 2004, 125(2):113-5. |
| [4] | Crockford D. Development of thymosin beta4 for treatment of patients with ischemic heart disease[J]. Ann N Y Acad Sci, 2007, 1112(3):385-95. |
| [5] | 梁建国.棕点湍蛙皮肤分泌液中活性肽分离纯化、分子克隆以及结构与功能的研究[D].南京:南京农业大学, 2006. Liang J G. Research on the structure and function relation, purification and molecular cloning of bioactive peptides from Amolops loloensis skin secretions[D]. Nanjing:Nanjing Agricultral Univerisity, 2006. |
| [6] | Yamamoto M, Shoda A, Minamino N, et al. Expression of thymosin beta 4 gene during Xenopus laevis embryogenesis[J]. Biochem Biophys Res Commun, 1992, 184(1):93-9. |
| [7] | 刘文君, 徐学清.大胡蜂肥大细胞脱粒肽对血管生成的抑制作用[J].中国药理学通报, 2014, 30(5):715-8. Liu W J, Xu X Q. Inhibitory effect of mastoparan-like peptide from wasp (Vespa magnifica) venom on angiogenesis[J]. Chin Pharmacol Bull, 2014, 30(5):715-8. |
| [8] | Clauss I M, Wathelet M G, Szpirer J, et al. Human thymosin-beta 4/6-26 gene is part of a multigene family composed of seven members located on seven different chromosomes[J].Genomics, 1991, 9(1):174-80. |
| [9] | Varghese S, Kronenberg H M. Rat thymosin beta 4 gene. Intron-containing gene and multiple retroposons[J]. J Biol Chem, 1991, 266(22):14256-61. |
| [10] | Li T, Ma S Y, Tang X C, et al. Production and characterization of highly purified recombinant thymosin beta 4 in Escherichia coli[J]. Protein Expr Purif, 2013, 90(2):90-5. |
| [11] | Dettin M, Ghezzo F, Conconi M T, et al. In vitro and in vivo pro-angiogenic effects of thymosin-b4-derived peptides[J]. Cell Immunol, 2011, 271(2):299-307. |

