


2. 河南牧业经济学院质量检测与管理系, 河南 郑州 450011;
3. 郑州大学药学院, 河南 郑州 450001
 , SU Nan2, QIN Yu-hua1, ZHAO Hong-wei1, ZHANG Wei1, ZHAO Ning-min1, LI Qiao-yan1, DUAN Hong-fei1, LIU Hong-min3
, SU Nan2, QIN Yu-hua1, ZHAO Hong-wei1, ZHANG Wei1, ZHAO Ning-min1, LI Qiao-yan1, DUAN Hong-fei1, LIU Hong-min3

2. Dept of Quality Detection and Management, Henan University of Animal Husbandry and Economy, Zhengzhou 450011, China;
3. School of Pharmaceutical Sciences, Zhengzhou University, Zhengzhou 450001, China
胃癌恶性程度高,发现时多已是中、晚期,预后极差[1]。以化疗贯穿始终的综合治疗是目前临床最主要的治疗模式,但化疗药物毒性大,且易产生耐药性,患者因难以耐受药物毒性而被迫终止治疗的现象屡见不鲜,化疗效果往往较差[2]。2014年初,全国肿瘤登记中心发布的最新《中国肿瘤登记年报》也显示,胃癌的发病率及死亡率均位列前三,由此可见,继续研发新的高效,低毒的抗胃癌药物仍十分迫切。中药作为中华文明的传统瑰宝,因其确切的疗效、较低的毒性、独特的作用机制,已得到国际社会的认可[3, 4],从中药中寻找高效低毒的先导化合物依旧是医药研发领域的研究热点。Jaridonin属于对映贝壳杉烷型二萜化合物,是我们课题组首次从河南济源产冬凌草中提取的新天然化合物,其分子结构如Fig1所示。本课题组前期研究发现Jaridonin可以明显抑制多种肿瘤细胞的生长[5],并诱导细胞凋亡,但Jaridonin是否具有肿瘤选择性以及选择性作用机制尚不清楚。本实验则重点研究该化合物的肿瘤选择性,以胃癌细胞株MGC-803和正常胃黏膜细胞GES-1为模型,从增殖抑制、细胞形态、细胞凋亡及蛋白表达等多方面来研究Jaridonin对胃癌细胞的选择性杀伤作用,并探讨其可能机制。
1 材料 1.1 细胞株人胃癌细胞株MGC-803购自中国科学院典型培养物保藏委员会细胞库,由本实验室传代冻存;人胃粘膜上皮细胞株GES-1购自上海复祥生物科技有限公司。
1.2 主要试剂四氮唑蓝(MTT)、Hoechst 33258购自美国Sigma公司;FITC-Annexin Ⅴ/PI 细胞凋亡检测试剂盒购自美国Biovision公司;细胞线粒体分离试剂盒、免疫染色固定液、荧光染料DCFH-DA及JC-1荧光探针均购自江苏碧云天生物技术研究所;细胞色素C、Bax、caspase-3抗体购自美国Santa Cruz公司;GAPDH抗体购自杭州贤至生物科技公司;辣根过氧化酶标记的二抗购自北京中杉金桥生物技术公司;NC膜购自美国Pall公司;化学发光检测试剂购自美国Pierce公司;细胞培养液RPMI 1640购自美国Gibco公司;胎牛血清(FBS)购自杭州四季青公司;化合物Jaridonin(纯度99%以上)由郑州大学新药研发中心研制,结构经IR,NMR,MS及X-ray光谱确证。Jaridonin用DMSO配成160 mmol·L-1的储备液,使用前用培养基稀释至所需浓度,同时确保培养基中DMSO终含量不超过0.1%(已知该浓度DMSO对细胞生长没有影响)。
2 方法 2.1 细胞培养细胞于含10%胎牛血清,1×108 U·L-1 青霉素和100 g·L-1 链霉素的RPMI 1640 培养液中,在37℃,5% CO2 细胞培养箱内培养。
2.2 MTT法测定细胞生存率根据文献所述[5],在使用或不使用GSH预孵育细胞后,加入终浓度为2.5、5、10、20、40、80 μmol·L-1的Jaridonin,作用24 h,计算细胞生存率(survival rate)及IC50值。
2.3 细胞形态学研究将MGC-803于6孔培养板中做成细胞爬片,使用0、15、30 μmol·L-1的Jaridonin分别作用细胞24h,去除培养基,PBS漂洗1次,使用免疫染色固定液室温固定10 min,加入适量体积的5 mg·L-1 Hoechst 33258 染液进行室温避光染色30 min。吸除Hoechst 33258 染液,PBS轻漂2次,荧光显微镜观察细胞形态,并保存图像。
2.4 细胞早期凋亡检测使用不同浓度的Jaridonin作用细胞24h后,胰酶消化,离心收集细胞,按照凋亡检测试剂盒说明处理待检细胞,利用流式细胞仪(Accuri C6,BD)分析凋亡情况。
2.5 线粒体膜电位检测使用0、15、30 μmol·L-1的Jaridonin作用MGC-803细胞24 h后,JC-1染色,使用荧光显微镜观察线粒体膜电位变化,并记录图像以作分析,具体方法参见文献[5]。
2.6 Western blot提取细胞总蛋白、测定蛋白浓度、聚丙烯酰胺凝胶电泳、电转、免疫杂交、 ECL发光以及胶片曝光,扫描保存结果;此外,线粒体的分离及蛋白提取均按照文献[5]所述进行具体操作。
2.7 ROS检测使用氧化还原敏感探针DCFH-DA检测胞内ROS的水平。细胞处理后,胰酶消化离心收集细胞,PBS洗2次,使用无血清配制的10 μmol·L-1 DCFH-DA 37℃孵育30 min。再使用无血清培养基洗细胞3次,以去除未结合的游离探针,流式检测荧光值以量化ROS的变化情况。
2.8 统计学分析所有数据以 的形式表示,t检验检测各组间的差异。
的形式表示,t检验检测各组间的差异。
如Fig1B结果所示,Jaridonin对胃癌细胞MGC-803有明显的抑制作用,且呈浓度依赖性(P<0.01);而在0~80 μmol·L-1浓度范围内,Jaridonin对人胃粘膜细胞GES-1的生存影响均远没有对MGC-803影响明显,差异具有显著性(P<0.01);即使在高浓度80 μmol·L-1时,GES-1生存率下降至31.17%±8.90%,但对比MGC-803生存率2.79%±1.22%,差异仍有显著性(P<0.01);此外,Jaridonin对MGC-803及GES-1的IC50分别为14.13 μmol·L-1和41.60 μmol·L-1。可见,Jaridonin对癌细胞具有杀伤选择性。
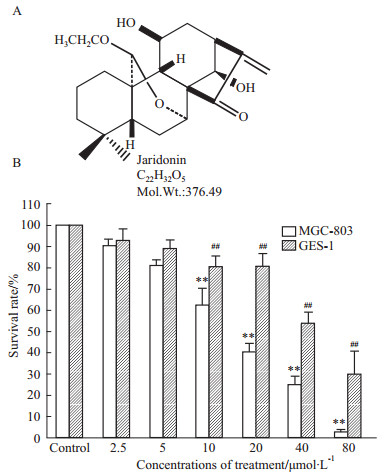
|
Fig 1
Effect of Jaridonin on MGC-803 and GES-1 cell proliferation( , n=6)
A: Molecular structural formula of Jaridonin; B: Effect of Jaridonin on cell proliferation. ##P<0.01 vs control; **P<0.01 GES-1 vs MGC-803 , n=6)
A: Molecular structural formula of Jaridonin; B: Effect of Jaridonin on cell proliferation. ##P<0.01 vs control; **P<0.01 GES-1 vs MGC-803
|
不同浓度的Jaridonin作用MGC-803细胞24 h后,可见15 μmol·L-1的浓度可导致染色质浓缩、边缘化,随着药物浓度增加至30 μmol·L-1则出现核膜裂解,染色质碎裂成块状,形成凋亡小体等典型凋亡状态(Fig2A);此外,Jaridonin引起了MGC-803细胞线粒体膜电位的变化,正常细胞线粒体呈现强的橙色荧光,线 粒体膜电位较高;在15 μmol·L-1的Jaridonin作用下,橙色荧光减弱并呈现了一定量的绿色荧光,提示线粒体膜电位较对照组有所下降;当药物浓度升至30 μmol·L-1时,橙色荧光完全消失,而呈现强的绿色荧光,证明此浓度下线粒体膜电位完全丧失,此时细胞调亡不可逆转(Fig2B)。
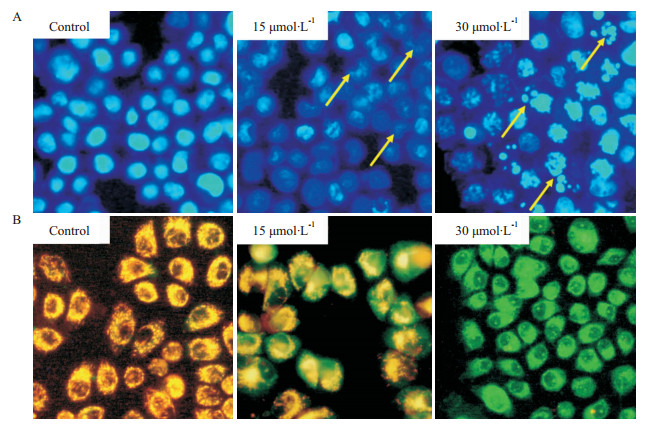
|
| Fig 2 Jaridonin induces MGC-803 cell apoptosis A: Hoechst 33258 fluorescent staining (200×), apoptotic morphology was observed by fluorescence microscopy;B: JC-1 fluorescent staining, the drop of mitochondrial membrane potential (Δψm) of MGC-803 cells was observed by fluorescence microscopy (200×) |
细胞色素C的释放是线粒体膜电位下降的直接后果之一,我们进一步检测了细胞色素C的释放情况。Jaridonin作用MGC-803细胞24 h后,分离线粒体,提取线粒体总蛋白,并作定量,Western blot检测发现,随着Jaridonin浓度增加,线粒体中细胞色素C的含量降低明显(P<0.01),而细胞质中的含量则明显增多(P<0.01)(Fig3A),证明Jaridonin可诱导细胞色素C由线粒体释放至细胞质。同时,caspase-3酶原蛋白被剪切活化,cleaved-caspase-3蛋白随着药物的作用逐渐出现并明显增多(Fig3B)。此外,与对照组相比,Jaridonin诱导了Bax表达明显上调(Fig3B),说明Jaridonin诱导的线粒体膜电位下降亦可能与此有关。以上结果表明,Jaridonin可以强烈诱导MGC-803细胞凋亡,且线粒体信号通路参与了该凋亡过程。
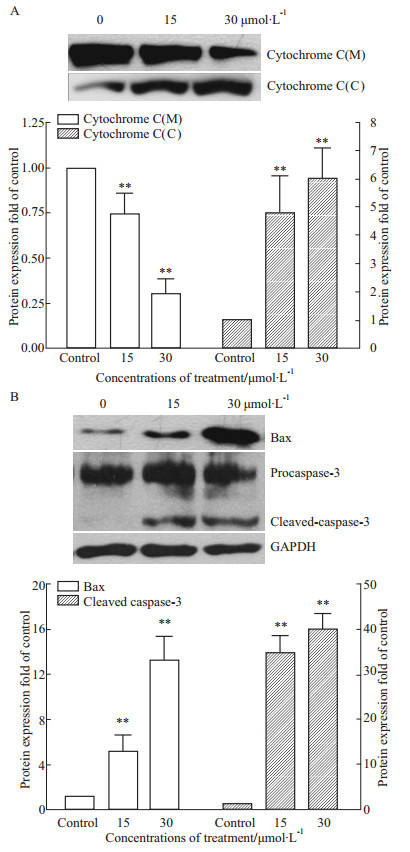
|
Fig 3
Effects of Jaridonin on cytochrome C, Bax and caspase-3 in MGC-803( , n=3)
A: cytochrome C (M=mitochondria, C=cytoplasm); B: Bax, procaspase-3 and cleaved- caspase-3; **P<0.01 vs control , n=3)
A: cytochrome C (M=mitochondria, C=cytoplasm); B: Bax, procaspase-3 and cleaved- caspase-3; **P<0.01 vs control
|
药物分别作用MGC-803和GES-1细胞24 h后,流式细胞术检测发现,Jaridonin明显诱导了MGC-803的凋亡(P<0.01),且凋亡率随着药物浓度增加而升高,但对胃粘膜上皮细胞GES-1凋亡影响则较弱,与MGC-803相比,其差异具有显著性(P<0.01),见Fig4。
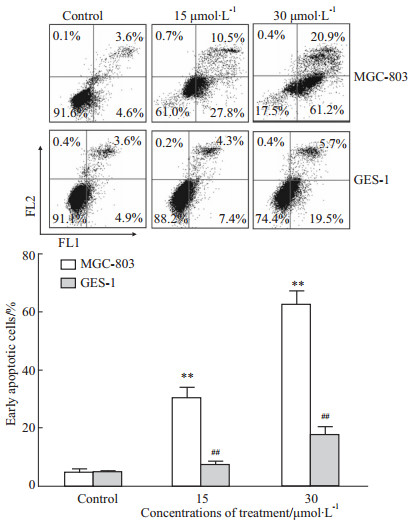
|
Fig 4
Effect of Jaridonin on apoptosis in MGC-803 and GES-1 cell( , n=3)
**P<0.01 vs control;##P<0.01, GES-1 vs MGC-803 , n=3)
**P<0.01 vs control;##P<0.01, GES-1 vs MGC-803
|
15 μmol·L-1 Jaridonin分别处理MGC-803和GES-1细胞3、6 h后,装载DCFH-DA探针,流式细胞仪检测发现,MGC-803和GES-1细胞内ROS水平均明显增加。随着药物作用时间延长,MGC-803内ROS一直维持较高水平(Fig5A);而GES-1细胞ROS水平逐渐降低,6 h后检测发现几乎下降至基础水平(Fig5B)。上述实验结果表明了,Jaridonin可以诱导细胞内ROS水平升高,但癌细胞和正常组织细胞对此反应不一。
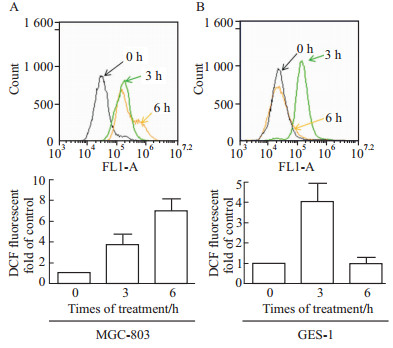
|
Fig 5
Effect of Jaridonin on the level of ROS in MGC-803 and GES-1 cell lines( , n=3)
A: Change of ROS in MGC-803;B: Change of ROS in GES-1 , n=3)
A: Change of ROS in MGC-803;B: Change of ROS in GES-1
|
为了证实ROS在Jaridonin选择性抑制过程中的重要角色,我们使用3 mmol·L-1 GSH预处理MGC-803 2h,再次检测了Jaridonin诱导ROS变化及细胞增殖抑制的作用。结果表明,GSH完全阻断15 μmol·L-1 Jaridonin诱导的ROS升高(Fig6A),以及各个浓度Jaridonin作用24 h所致使的细胞死亡,且差异具有显著性(Fig6B)。这些结果提示我们,Jaridonin通过作用于细胞内氧化还原系统,导致ROS积累,从而选择性杀死癌细胞。
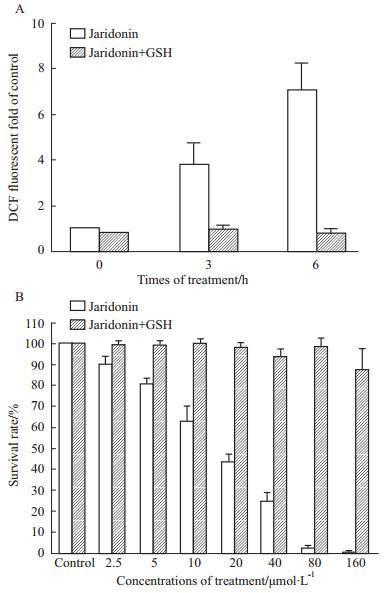
|
Fig 6
Effect of Jaridonin on MGC-803 is reversed by GSH( , n=3)
A: The increase of Jaridonin-induced ROS was reversed by GSH. B: The effect of Jaridonin on MGC-803 cell proliferation was reversed by GSH. , n=3)
A: The increase of Jaridonin-induced ROS was reversed by GSH. B: The effect of Jaridonin on MGC-803 cell proliferation was reversed by GSH.
|
传统中草药冬凌草曾被收入1977年版《中国药典》,其富含对映贝壳杉烷类二萜化合物[6],民间广泛用于抗菌消炎、抗肿瘤。从上世纪七十年代发现冬凌草甲素以来,国内外学者已经对其开展了化学成分、构效关系、衍生物合成、抗肿瘤作用与机制以及临床应用与产品开发等各方面的广泛研究,并取得了较多令人振奋的研究成果[7, 8, 9]。Jaridonin是本课题组从河南济源地区产冬凌草中提取得到的新单 体化合物,其纯度高,结构稳定,生物活性好,含量亦高,且提取纯化工艺简便,具备较好的开发前景。本研究证明了其不但具有确切的抗胃癌活性,而且具有明显的肿瘤选择性,该独特的选择性作用机制可能与其诱导细胞ROS水平升高直接相关。
ROS压力的增加一直被认为是肿瘤细胞发生发展的不利因素,但近些年来,越来越多的证据表明,促使ROS产生和积累可以选择性杀伤癌细胞[10, 11]。肿瘤细胞异常的细胞周期和旺盛的代谢导致细胞中ROS水平远远高于正常细胞,此外,肿瘤细胞多基因突变导致胞内超氧化物歧化酶、过氧化氢酶水平往往较正常细胞低,在此情况下,抑制肿瘤细胞的抗氧化系统则可以明显增加ROS水平引起细胞死亡,而对正常细胞来说,则不会出现上述现象。肿瘤细胞与正常细胞在生化方面的不同为开发高效低毒的新抗肿瘤药物提供了理论基础和研发策略[12]。一些药物也正是基于这一理论而起到抗肿瘤作用的,例如阿霉素、三氧化二砷以及二甲基雌二醇等皆通过增加胞内ROS而诱导肿瘤细胞凋亡[13]。更有趣的是,处于Ⅲ期临床实验的小分子化合物elesclomol通过一系列效应选择性引发癌细胞凋亡,而这些效应也正起始于ROS的增加,随后引起细胞色素C 释放,导致线粒体凋亡通路被激活,最终导致caspase依赖的细胞凋亡,而对正常细胞无影响或只有较小影响[14];临床研究显示,其还可提高多种抗肿瘤药物的疗效,包括紫杉醇和多西他赛、吉西他滨等[15]。本研究结果也同样表明了,Jaridonin明显增加胞内ROS,诱导Bax表达上调,激活了线粒体途径介导的胃癌细胞凋亡,而对胃黏膜上皮细胞无明显影响;此外,课题组前期研究也证明了Jaridonin诱导ROS增加与其消耗GSH有关[16]。但是,Jaridonin引起ROS增多是否与NADPH氧化酶亦有关,以及其诱导的线粒体膜电位下降是否为Bax依赖性还需进一步研究;目前,课题组就Jaridonin与紫杉醇、五氟尿嘧啶以及顺铂等化疗药物的联用效果研究正在进行中,初步的结果表明,Jaridonin可以减低紫杉醇一半的用量,且能达到同样的肿瘤抑制效果,且对比单用紫杉醇组,实验动物(裸鼠)状态更好。但是,该化合物体内代谢情况仍不清楚,需要进一步研究。
一个理想的抗肿瘤药物应该是仅仅对肿瘤组织细胞具有明显毒性,而对正常组织细胞无毒性或者毒性较小,但从目前临床应用的化疗药物来看,此类的药物数目还非常有限。所以,探索肿瘤细胞与正常细胞之间的生物学差异,研发高效低毒的肿瘤选择性药物仍是当前医药工作者非常重要且富于挑战的任务。总之,天然二萜化合物Jaridonin已然是一个具有潜力的新的抗肿瘤化合物,同时,通过对该化合物的研究也为更为稳定,活性更高,毒性更低的衍生物的设计合成提供了实验依据和理论支持。
| [1] | 丁士刚, 王丽. 应重视胃癌发病机制的规范研究[J]. 中华医学杂志, 2013, 93(16):1201-2. Ding S G, Wang L. Standardize research of gastric cancer pathogenesis should be attached importance[J]. Natl Med J China, 2013, 93(16):1201-2. |
| [2] | Moehler M, Galle P R, Goekel I, et al. The multidisciplinary management of gastrointestinal cancer. Multimodal treatment of gastric caneer[J]. Best Pract Res Clin Gastroent, 2007, 21(6):965-81. |
| [3] | Uzuner H, Fan T P, Dias A, et al. Establishing an EU-China consortium on traditional Chinese medicine research[J]. Chin Med, 2010, 5:42. |
| [4] | Normlie D. Asian medicine:the new face of traditional Chinese medicine[J]. Science, 2003, 299(5604):188-90. |
| [5] | 马永成, 苏楠, 石晓静, 等. 新型对映-贝壳杉烷二萜化合物Jaridonin体外抗肿瘤活性及其作用机制探讨[J].中国药学杂志, 2013, 48(15):1266-70. Ma Y C, Su N, Shi X J, et al. Bioactivity and mechanism of jaridonin, a novel ent-kaurene diterpenoid compound, on tumor cells growth in vitro[J]. Chin Pharm J, 2013, 48(15):1266-70. |
| [6] | Han Q B, Wei S X, Sun H D, et al. New ent-kaurane diterpenoids from Isodon rubescens[J]. Chin J Organic Chem, 2003, 23(3):270-3. |
| [7] | Zhou G B, Kang H, Wang L, et al. Oridonin, a diterpenoid extracted from medicinal herbs, targets AML1-ETO fusion protein and shows potent antitumor activity with low adverse effects on t(8;21) leukemia in vitro and in vivo[J]. Blood, 2007, 109(8):3441-50. |
| [8] | Zhen T, Wu C F, Liu P, et al. Targeting of AML1-ETO in t(8;21) leukemia by oridonin generates a tumor suppressor-like protein[J]. Sci Translat Med, 2012, 4(127):1-9. |
| [9] | 王天晓, 刘迎滑, 时小燕. 冬凌草甲素下调STAT3-HKⅡ通路诱导HepG2细胞凋亡的研究[J].中国药理学通报, 2014, 30(3):397-402. Wang T X, Liu Y H, Shi X Y. Oridonin induces apoptosis of HepG2 cells via downregulating STAT3-HKⅡpathway[J]. Chin Pharmacol Bull, 2014, 30(3):397-402. |
| [10] | Trachootham D, Zhou Y, Zhang H, et al. Selective killing of oncogenically transformed cells through a ROS mediated mechanism by β-phenylethyl isothiocyanate[J]. Cancer Cell, 2006, 10(3):241-52. |
| [11] | Shawa A T, Winslowa M M, Magendantza M, et al. Selective killing of K-ras mutant cancer cells by small molecule inducers of oxidative stress[J]. PNAS, 2011, 108(21):8773-8. |
| [12] | Luo J, Solimini N L, Elledge S J. Principles of cancer therapy:oncogene and non-oncogene addiction[J]. Cell, 2009, 136(5):823-37. |
| [13] | Wang J, Yi J. Cancer cell killing via ROS:to increase or decrease, that is the question[J]. Cancer Biol Ther, 2008, 7(12):1875-84. |
| [14] | Kirshner J R, He S Q, Balasubramanyam V, et al. Elesclomol induces cancer cell apoptosis through oxidative stress[J]. Mol Cancer Ther, 2008, 7(8):2319-27. |
| [15] | 新药介绍. 新型癌症治疗药物--细胞凋亡诱导剂Elesclomol[J]. 药学进展, 2009, 33(5):229-30. New drugs. New cancer drugs-cell apoptosis inducer Elesclomol[J]. Prog Pharm Sci, 2009, 33(5):229-30. |
| [16] | 马永成, 苏楠, 赵宁民, 等. Jaridonin通过耗竭GSH诱导DNA损伤致食管癌细胞凋亡[J].中华肿瘤杂志, 2015, 37(1):11-7. Ma Y C, Su N, Zhao N M, et al. Jaridonin induces apoptosis in human esophageal cancer cells by depleting GSH and inducing DNA damage[J]. Chin J Oncol, 2015, 37(1):11-7. |