


2. 中山大学药学院, 广东 广州 510006
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China
血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)通过调节血管收缩在高血压、心肌肥厚和心室重构等病理过程中起关键作用。近年来,研究发现[1, 2],Ang Ⅱ对衰竭心脏的心肌能量代谢调节也产生了不利影响,通过降低心肌能量代谢的效率,减弱心脏收缩功能,从而加剧衰竭心脏左室重构的进展。然而,当前研究对于Ang Ⅱ影响心肌能量代谢的机制并不明确。受体相互作用蛋白140(receptor-interacting protein 140,RIP140)和过氧化物酶体增殖物受体γ共激活因子1α(PPARγ coactivator-1α,PGC-1α)是调控心肌能量代谢的重要转录辅助因子,本文以乳鼠心肌细胞为研究对象,探讨RIP140与PGC-1α 在AngⅡ调节线粒体产能中的作用,为确定RIP140与PGC-1α作为调控心肌能量代谢新靶点提供理论依据。
1 材料与方法 1.1 仪器与试剂超净工作台(苏州净化设备有限公司);CO2细胞培养箱(美国Thermo公司);蛋白电泳仪、电转仪、GEL DOC 2000成像系统、蛋白定量酶标仪(美国BioRad公司);RNA提取试剂盒、逆转录试剂盒、荧光定量分析试剂盒(日本TaKaRa);发光液、核蛋白提取试剂盒、蛋白定量试剂盒(美国Pierce公司);胎牛血清(美国Hyclone公司);DMEM培养基(美国Gibco公司);RIP140抗体(英国Abcam公司);Ang Ⅱ、胰蛋白酶、histone(美国Sigma);PGC-1α抗体(Calbiochem);RIPA蛋白裂解液(南京碧云天生物技术有限公司);ATP含量测定试剂盒(上海杰美基因医药有限公司)。
1.2 乳鼠心肌细胞的培养取出生后1~2 d SD大鼠,开胸取出心脏,用PBS冲洗后将心脏剪成1 mm3左右小块。瞬时离心后弃去上清,加入15 mL 0.08%的胰蛋白酶于37℃水浴消化5 min。收集上清至等量含15%胎牛血清的DMEM细胞培养基中,1 000 r·min-1离心5 min,弃去上清。沉淀用含1~2 mL胎牛血清的DMEM培养基重悬细胞。剩余未消化的组织块继续加入胰酶消化,如此重复5~6次直至组织块呈白色为止。最后,离心收集总的细胞沉淀,重悬,接种细胞于培养瓶中。置于37℃、5% CO2的培养箱中孵育1 h,收集培养瓶中富集心肌细胞的悬液,计数种板,并在培养基中加入0.1 mol·L-1的BrdU抑制成纤维细胞的生长。
1.3 Western blot分析利用核蛋白试剂盒提取心肌细胞核蛋白,考马斯亮蓝定量后分装50 μg蛋白留作上样。配置8%的分离胶和5%的浓缩胶,70 V下分离30 min,于120 V电压下继续电泳至溴酚蓝到达分离胶底部。220 mA恒流电转90 min,用5%牛奶室温封闭1 h,然后加入RIP140(1 ∶ 1 000稀释)、PGC-1α(1 ∶ 800稀释)等抗体,4℃孵育过夜。二抗(1 ∶ 10 000)室温孵育1 h,洗膜后于暗室下加入生物发光液显影、定影。采用GEL DOC 2000成像系统、Quantity one软件对条带进行灰度分析,以组蛋白histone为内参蛋白作为对照。
1.4 心肌细胞线粒体ATP浓度测定萤火虫荧光素酶能催化ATP依赖性荧光素的氧化,经过电子转移,将化学能转化为氧化型荧光素的光能,利用生物发光仪(检测波长560 nm)进行检测,所测得的荧光RLU值与ATP的含量呈线性正相关。将试剂盒中的ATP标准溶液稀释为0.5、2、10、50和100 μmol·L-1五个浓度梯度,以纵坐标为ATP浓度,横坐标为荧光RLU值绘制ATP浓度标准曲线。取待测的细胞,按照线粒体分离试剂盒的分离方法,提取细胞活性线粒体,根据测得的荧光RLU值,按ATP浓度标准曲线对其进行定量。
1.5 统计学分析采用SPSS 13.0统计软件对数据进行统计分析,结果用 表示。两均数比较用t检验,多组均数比较采用One-way ANOVA检验。
表示。两均数比较用t检验,多组均数比较采用One-way ANOVA检验。
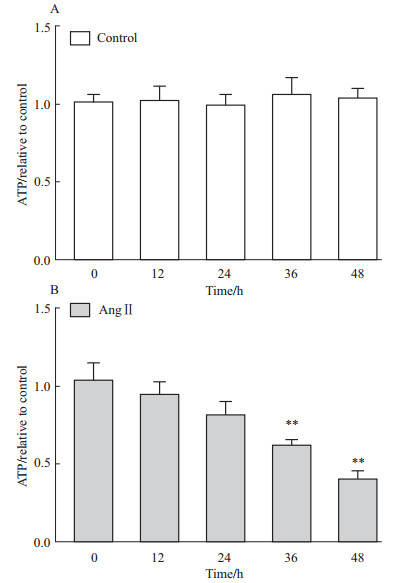
原代培养的乳鼠心肌细胞给予Ang Ⅱ处理12、24、36或48 h后,分别提取活细胞线粒体并测定ATP浓度,观察Ang Ⅱ对线粒体能量生成的影响。100 nmol·L-1 Ang Ⅱ刺激心肌细胞12、24 h后,线粒体ATP浓度均未发生改变。刺激36 h后,线粒体ATP的水平较对照组明显下降(P<0.01),刺激48 h后ATP含量有进一步下降的趋势(P<0.01)(Fig1B)。未给予Ang Ⅱ处理的心肌细胞,连续培养12、24、36或48 h,线粒体ATP的浓度均未发生改变(Fig1A)。以上结果表明,100 nmol·L-1 Ang Ⅱ能明显抑制心肌细胞线粒体产生ATP,且ATP含量的变化呈时间依赖性下降。
|
| Fig 1 Changes of mitochondrial ATP contents in cardiomyocytes **P<0.01 vs 0 h control group |
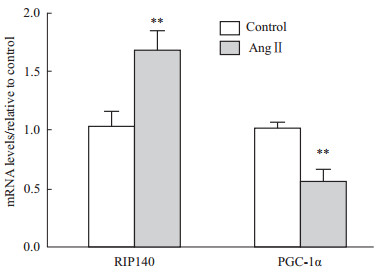
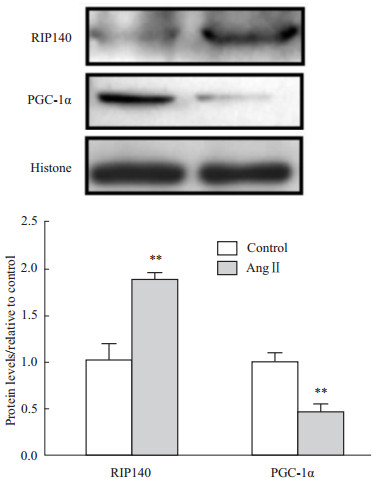
RIP140与PGC-1α是调控线粒体产能的重要辅助因子,两者在心肌细胞中均有表达,有共同的下游靶基因,但执行相反的转录功能。两者通过与核受体或转录因子结合(比如PPARs、ERRs、NRFs家族等),调控脂肪酸、葡萄糖代谢过程中相关酶的表达,在维持线粒体能量平衡中扮演重要角色。为进一步明确Ang Ⅱ介导的心肌产能下降是否与RIP140、PGC-1α相关,我们观察了Ang Ⅱ对RIP140、PGC-1α基因的mRNA、蛋白水平的影响。 心肌细胞给予100 nmol·L-1 Ang Ⅱ处理36 h后,RIP140的mRNA水平明显升高(P<0.01),而PGC-1α的水平明显下降(P<0.01)(Fig2)。利用Western blot测定两者的蛋白水平变化,发现Ang Ⅱ处理组的RIP140蛋白水平较对照组升高了87%(P<0.01),而PGC-1α的水平则降低了54%(P<0.01)(Fig3),RIP140、PGC-1α的蛋白变化与各自的mRNA水平变化一致。上述结果表明,Ang Ⅱ诱导RIP140表达升高的同时抑制PGC-1α的表达。
|
| Fig 2 mRNA levels of RIP140 and PGC-1α after Ang Ⅱ treatment **P<0.01 vs control group |
|
| Fig 3 Protein levels of RIP140 and PGC-1α after Ang Ⅱ treatment **P<0.01 vs control group |
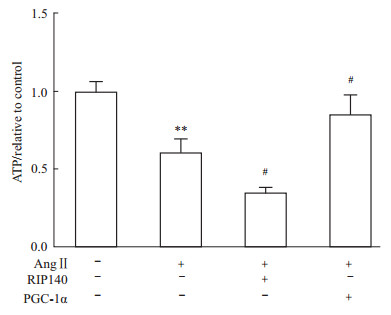
为验证RIP140与PGC-1α基因是否参与了Ang Ⅱ对心肌能量代谢的抑制作用,借助腺病毒系统,使乳鼠心肌细胞外源性过表达RIP140(腺病毒感染滴度MOI=100)或PGC-1α蛋白(腺病毒感染滴度MOI=100),观察各处理组线粒体ATP含量的变化。如Fig4所示,与对照组相比,100 nmol·L-1 Ang Ⅱ刺激心肌细胞36 h后,线粒体ATP的含量下降40%(P<0.01)。心肌细胞给予100 nmol·L-1 Ang Ⅱ处理的同时再过表达RIP140,线粒体ATP含量较仅给予Ang Ⅱ处理组有 进一步下降,差异有统计学意义(P<0.05)。而给予Ang Ⅱ处理同时过表达PGC-1α的心肌细胞,线粒体ATP含量较仅给予Ang Ⅱ处理组相比明显升高,但仍低于对照组水平(P<0.05)。说明心肌细胞过表达RIP140促进Ang Ⅱ介导的心肌线粒体产能进一步下降,过表达PGC-1α则减轻了Ang Ⅱ对心肌线粒体产能的抑制作用。RIP140与PGC-1α共同参与了Ang Ⅱ对心肌细胞线粒体产能的影响。
|
| Fig 4 Change of ATP contents in Ang Ⅱ treated cardiomyocytes after overexpressing RIP140 or PGC-1α **P<0.01 vs control group; #P<0.05 vs Ang Ⅱ group |
RIP140与PGC-1α是调控机体能量贮存和利 用、线粒体生成的重要的转录辅抑制因子和转录辅激活因子[3]。二者在调控心脏能量代谢平衡,维持心脏正常的形态和功能方面发挥着重要的作用。PGC-1α作为转录辅激活因子,促进核受体/转录因子介导的代谢相关基因的转录及线粒体生成,可以激活与脂肪酸的摄取、氧化和氧化磷酸化紧密相关的多种代谢基因,被认为是纠正衰竭心脏能量紊乱的新靶点[4]。心肌细胞过表达PGC-1α,可诱导与脂肪酸转运、利用及β氧化过程密切相关基因的表达,同时线粒体的耗氧速率也明显增加[5]。受体相互作用蛋白RIP140为转录辅抑制因子,与PGC-1α的功能恰恰相反,能明显抑制脂肪[6]、骨骼肌[7]、心脏[8, 9]等代谢组织的分解代谢。其与核受体结合后能够负向调节多种代谢组织中靶基因的转录。RIP140与PGC-1α表达的失衡可能是导致心肌能量代谢紊乱,进而加剧心力衰竭病程的重要因素。
本研究发现RIP140与PGC-1α在AngⅡ抑制心肌产能过程中扮演重要角色。AngⅡ诱导乳鼠心肌细胞线粒体生成ATP的能力下降,促进转录辅抑制因子RIP140的表达,而抑制转录辅激活因子PGC-1α表达。借助腺病毒过表达载体,在AngⅡ处理的同时进一步过表达RIP140或PGC-1α,结果发现,过表达RIP140后促进AngⅡ对线粒体ATP的抑制作用,而过表达PGC-1α则能改善AngⅡ对心肌细胞线粒体产能的影响。说明AngⅡ对ATP生成的变化影响受RIP140和PGC-1α的共同调节,同时也进一步验证了RIP140与PGC-1α在维持心肌能量代谢平衡调节上的作用是相反的。此外,本研究借助腺病毒载体外源性过表达RIP140和PGC-1α蛋白,克服了原代培养的心肌细胞存在过表达效率低等问题,确保了研究结果的可信度。
心脏能量代谢是心肌肥大、心力衰竭等心血管疾病的研究热点,纠正心肌能量代谢重构有望成为开辟心力衰竭等疾病的治疗的新向导[10, 11] 。笔者推测心脏能量代谢平衡的调控很可能取决于这些转录辅助因子的相对表达水平和活性,RIP140与PGC-1α表达的失衡很可能是心肌能量代谢紊乱的重要影响因素。但是,心肌能量代谢的过程是错综复杂的,多种核受体、转录因子调控的代谢基因参与心肌能量代谢过程,该研究明确了AngⅡ诱导RIP140表达升高与PGC-1α表达下调,从而影响线粒体ATP生成,这一发现目前国内外尚无文献报道。而对于AngⅡ在调控RIP140与PGC-1α表达变化后是通过何种核受体或转录因子调控还有待进一步深入研究。通过阐明RIP140和PGC-1α在AngⅡ介导心肌能量代谢影响的作用研究,将AngⅡ调节的RAS系统与心肌能量代谢紊乱联系起来,这对了解高血压、心肌肥厚等心血管疾病的发生、发展机制具有重要的意义,为了解心肌能量代谢紊乱发生、发展机制提供了理论依据,也为进一步找寻调控心肌能量代谢的靶点开拓了思路。
| [1] | Mori J, Zhang L, Oudit G Y, Lopaschuk G D. Impact of the renin-angiotensin system on cardiac energy metabolism in heart failure[J]. J Mol Cell Cardiol, 2013, 63:98-106. |
| [2] | Stanley W C, Recchia F A, Lopaschuk G D. Myocardial substrate metabolism in the normal and failing heart[J]. Physiol Rev, 2005, 85(3):1093-129. |
| [3] | 陈艳芳, 汪煜华, 刘培庆. 转录辅抑制因子RIP140在代谢组织中的作用及机制研究[J]. 中国药理学通报, 2010, 26 (6):70-4. Chen Y F, Wang Y H, Liu P Q. Role and molecular mechanism of transcriptional co-repressor RIP140 in metabolism tissue[J]. Chin Pharmacol Bull, 2010, 26 (6):70-4. |
| [4] | Schilling J, Kelly D P. The PGC-1 cascade as a therapeutic target for heart failure[J]. J Mol Cell Cardiol, 2011, 51(4):578-83. |
| [5] | Banke N H, Wende A R, Leone T C, et al. Preferential oxidation of triacylglyceride-derived fatty acids in heart is augmented by the nuclear receptor PPARalpha[J]. Circ Res, 2010, 107(2):233-41. |
| [6] | Kiskinis E, Chatzeli L, Curry E, et al. RIP140 represses the "brown-in-white" adipocyte program including a futile cycle of triacylglycerol breakdown and synthesis[J]. Mol Endocrinol, 2014, 28(3):344-56. |
| [7] | Fritah A, Steel J H, Nichol D, et al. Elevated expression of the metabolic regulator receptor-interacting protein 140 results in cardiac hypertrophy and impaired cardiac function[J]. Cardiovasc Res, 2010, 86(3):443-51. |
| [8] | Fritah A, Steel J H, Parker N, et al. Absence of RIP140 reveals a pathway regulating glut4-dependent glucose uptake in oxidative skeletal muscle through UCP1-mediated activation of AMPK[J]. PloS One, 2012, 7(2):e32520. |
| [9] | Chen Y, Wang Y, Chen J, et al. Roles of transcriptional corepressor RIP140 and coactivator PGC-1alpha in energy state of chronically infarcted rat hearts and mitochondrial function of cardiomyocytes[J]. Mol Cell Endocrinol, 2012, 362(1-2):11-8. |
| [10] | Ardehali H, Sabbah H N, Burke M A, et al. Targeting myocardial substrate metabolism in heart failure:potential for new therapies[J]. Eur J Heart Fail, 2012, 14(2):120-9. |
| [11] | Bayeva M, Gheorghiade M, Ardehali H. Mitochondria as a therapeutic target in heart failure[J]. J Am Coll Cardiol, 2013, 61(6):599-610. |

