


Cecropins是Boman等[1, 2]首次从惜古比天蚕(hyatophora cecropia)中提取出来的一类抗菌肽家族,目前已发现的cecropins达20多种。这类家族具有形成特定两亲性α-螺旋的能力,使得它们可针对非极性脂质的细胞膜并在微摩尔浓度下对革兰阳性菌和革兰阴性菌均有强烈的抗菌活性。已有文献证明,cecropins可抑制多种肿瘤细胞系如白血病[3]、肝癌[4]、膀胱癌[5]和胃癌[6]的增殖,但不损伤正常细胞,这一特点使得抗菌肽有望成为新一代的抗肿瘤药物。
就目前研究结果显示,cecropins的毒性机制很保守,除了通过细胞膜裂解机制诱导肿瘤细胞快速死亡,还可以进入细胞激活细胞内凋亡信号通路,引起细胞程序性死亡[7]。 Paredes-Gamero等[8]报道,低浓度的抗菌肽可能是通过增加细胞内Ca2+和自由基,激活caspase-3的信号通路促进K562细胞的凋亡,而高浓度的抗菌肽通过裂解细胞膜直接促使细胞死亡。
新疆家蚕抗菌肽(cecropinXJ)是一种含有33个氨基酸的小分子阳离子抗菌肽,所编码的氨基酸序列与已报道的cecropin B序列同源性达到98%[9]。通过RT-PCR克隆到cecropinXJ 基因,连接到pYES2/CT/α载体转至酿酒酵母进行诱导并大量表达。实验研究表明,cecropinXJ可以抑制多种肿瘤细胞的增殖,并且能够促进肿瘤细胞的凋亡[10],然而其抗肿瘤机制尚不清楚。在本文中旨在探讨的是cecropinXJ体外对AGS细胞的抑制增殖和诱导凋亡作用。结果显示,cecropinXJ可有效抑制AGS细胞增殖并诱导其凋亡,这为开发cecropinXJ成为抗肿瘤药物提供了理论基础和实验依据。
1 材料 1.1 细胞株人胃癌细胞系AGS和人正常胃上皮细胞GES-1由北京大学肿瘤医院肿瘤分子生物学实验室提供。
1.2 药品与试剂cecropinXJ:由本实验室诱导表达和纯化,储存在-80℃备用;DMEM培养基:美国Hyclone公司;胎牛血清:美国Gibco公司;二甲基亚砜(DMSO):北京Solarbio公司;噻唑蓝(MTT)、Hoechst 33258、2,7′-二氯双氢荧光素二乙酸酯(H2DCF-DA)、3,3′-二己基含氧碳菁碘代物[DiOC6(3)]:美国Sigma公司;Bax、Bcl-2、caspase-3、细胞色素C单克隆抗体(1 ∶ 2 000):美国Cell Signaling Technology公司;GAPDH单克隆抗体、HRP-goat anti-mouse IgG:美国Proteintech公司;TRIzol Reagent:美国Invitrogen公司;caspase-3抑制剂Ac-DEVE-fmk、caspase-8抑制剂Ac-IETD-fmk、caspase-9抑制剂Ac-LEHD-fmk:瑞士Enzo Life Sciences公司;caspase-3检测试剂盒:上海贝博生物有限公司;SYBR® Premix Ex TaqTM II(Tli RNaseH Plus):日本TaKaRa公司;超敏ECL化学发光试剂盒:北京康为世纪生物科技有限公司。
1.3 仪器CO2细胞培养箱:德国Heraeus公司;7500 system荧光定量PCR仪:美国ABI公司;ImageQuant LAS 4000 min超灵敏化学发光成像仪、酶标仪:美国Bio-Rad公司;倒置显微镜、荧光显微镜:德国Leica公司;流式细胞仪:美国BD公司。
2 方法 2.1 细胞培养人胃癌细胞系AGS和人胃上皮细胞GES-1在含有10%胎牛血清、105 U·L-1青霉素和链霉素双抗的DMEM培养基中,于5% CO2、37℃恒温培养箱中培养。
2.2 细胞存活实验为了检测cecropinXJ对AGS细胞和GES-1细胞增殖的影响,通过MTT法检测细胞的存活率。将处于对数生长期的AGS细胞和GES-1细胞以每孔4×104个细胞的密度接种于96孔板中,培养过夜。选择浓度范围在0~1 000 mg·L-1 cecropinXJ处理24 h,不加cecropinXJ为阴性对照,每组设6个复孔。处理过后,弃去培养基,每孔加入20 μL MTT (5 g·L-1)溶液于37℃避光孵育4 h。然后,每孔加入100 μL DMSO溶液,于酶标仪检测540 nm/655 nm波长处吸光度值(A值),计算细胞存活率。计算公式:细胞存活率/%=[(A处理组-A空白组)/(A对照组-A空白组)]×100%。实验重复3次。
2.3 透射电镜观察细胞超微结构变化收集0、50、100 mg·L-1 cecropinXJ处理24 h的AGS细胞,用2.5%戊二醛溶液4℃固定过夜。0.1 mol·L-1磷酸缓冲溶液(PBS)冲洗2 h,加入800 μl 1%锇酸进行双固定。通过分级乙醇、丙酮梯度逐级脱水,环氧树脂包埋后制备超薄切片,醋酸铀和枸橼酸铅染色,透射电镜观察细胞超微结构。
2.4 Hoechst 33258观察细胞凋亡情况收集对数生长期的AGS细胞1×108·L-1,接种于铺有无菌盖玻片的6孔板内,5% CO2、37℃恒温箱培养过夜。加入浓度分别为0、20、50、80、100 mg·L-1 cecropinXJ处理24 h,弃去培养液,PBS洗涤后用95%乙醇4℃固定10 min。去固定液,用PBS洗2次后,加入终浓度为0.5 g·L-1的Hoechst 33258染色液,于4℃避光染色10 min。PBS洗涤后,50%甘油封片剂封片,荧光显微镜观察拍照。镜下随机计数10个视野,按以下公式计算:细胞凋亡率/%=(凋亡细胞数/总细胞数)×100%。
2.5 流式细胞仪检测细胞内活性氧的水平通过流式细胞仪测定H2DCF-DA荧光强度测定细胞内活性氧的含量。收集对数生长期的AGS细胞1×108·L-1,接种于6孔板内,5% CO2、37℃恒温箱培养过夜。加入浓度分别为0、20、50、100 mg·L-1 cecropinXJ处理24 h,弃去培养液,PBS洗涤后加入终浓度为10 μmol·L-1的H2DCF-DA荧光探针,于37℃避光孵育30 min。吸去H2DCF-DA荧光探针,用PBS洗2遍后,胰酶消化重悬于1 mL PBS中,上流式细胞仪进行检测。
2.6 流式细胞仪检测线粒体膜电位的变化线粒体膜电位在细胞凋亡过程中的变化通过 DiOC6(3)进行测定。收集对数生长期的AGS细胞1×108·L-1,接种于6孔板内,5% CO2、37℃恒温箱培养过夜。加入浓度分别为0、20、50、100 mg·L-1 cecropinXJ处理24 h,弃去培养液,PBS洗涤后加入终浓度为40 nmol·L-1的DiOC6(3)染料,于37℃避光孵育30 min。吸去染料,用PBS洗2遍后,胰酶消化重悬于1 mL PBS中,上流式细胞仪进行检测。
2.7 实时荧光定量PCR(qRT-PCR)检测Bax、Bcl-2、caspase-3、细胞色素C mRNA的表达培养AGS细胞大约至80%时,用不同浓度cecropinXJ 即0、20、50、100 mg·L-1处理24 h。收集细胞,TRIzol法提取细胞的总RNA,将RNA反转成cDNA。qRT-PCR引物为caspase-3:5′-AGACATACTCCTTCCATCAA-3′(上游),5′-TCATAGCACAGCATCACT-3′(下游);细胞色素C:5′-TGGATACTCTTACACAGCCG-3′(上游),5′-AAGTCTGCCCTTTCTTCCTT-3′(下游);Bax:5′-GATGATTGCCGCCGTGGAC-3′(上游),5′-GGGTGAGGAGGCTTGAGGAG-3′(下游);Bcl-2:5′-GAACTGGGGGAGGATTGTGG-3′(上游),5′-GGATCCAGGTGTGCAGGTGC-3′(下游);GAPDH:5′-ACACCCACTCCTCCACCTTT-3′(上游),5′-ACCCTGTTGCTGTAGCCAA-3′ (下游)。SYBR® Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒检测mRNA的表达变化,GAPDH作为内参。25 μL反应体系包括:12.5 μL Premix Ex TaqTM II (Tli RNaseH Plus),1 μL上游引物和下游引物(2.5 μmol·L-1),0.5 μL ROX Refrence Dye II (50×)和100 ng cDNA。通过95℃ 30 s的预热激活DNA聚合酶,PCR扩增条件为95℃ 30 s,56℃ 30 s,72℃ 45 s,共40个循环。实验结果使用2-ΔΔCt法进行统计分析。
2.8 Western blot检测Bax、Bcl-2、caspase-3、细胞色素C蛋白的表达培养AGS细胞于100 mm培养皿中,加入浓度分别为0、20、50、80、100 mg·L-1 cecropinXJ处理24 h,收集5×106个细胞。用冷PBS洗涤细胞2次,加入100 μL冷的细胞裂解液,高速涡旋振荡15 s,置冰上裂解15 min。14 000 r·min-1 离心15 min,取上清,BCA法测定蛋白浓度。取40 μg总蛋白的裂解上清,进行12% SDS聚丙烯酰胺凝胶电泳。转至NC膜,5%脱脂奶粉室温封闭2 h,TBS/T洗涤膜3次,然后分别与Bax、Bcl-2、caspase-3、细胞色素C、GAPDH 单克隆抗体(1 ∶ 2 000) 4℃孵育过夜。TBS/T洗膜后加入HRP标记的山羊抗鼠IgG二抗(1 ∶ 2 000)室温孵育2 h,用超敏ECL化学发光试剂盒于ImageQuant LAS 4000 min超灵敏化学发光成像仪上曝光,GAPDH作为内参。
2.9 Caspase-3活性的检测培养AGS细胞于100 mm培养皿中,加入浓度分别为0、20、50、80、100 mg·L-1 cecropinXJ处理24 h,收集5×106个细胞。用冷PBS洗涤细胞2次,按试剂盒说明书方法重悬于100 μL冷的裂解缓冲液中,高速涡旋振荡15 s,置冰上裂解15 min。14 000 r·min-1 离心15 min,取上清,Bradford法测定蛋白浓度。取50 μg总蛋白的裂解上清,加入90 μL检测缓冲液,加入10 μL Ac-DEVD-pNA,在37℃避光反应2 h或过夜。测定405 nm下的吸光度值(A值)。根据处理组细胞的吸光度值与空白对照细胞的吸光度值的比值计算caspase-3的相对活性。caspase-3的相对活性=A处理组/A对照组。
2.10 Caspase抑制剂对cecropinXJ介导的AGS细胞死亡的影响为了确定cecropinXJ诱导细胞凋亡可能有caspase相关的信号通路参与,将caspase-3抑制剂(Ac-DEVD-fmk)、caspase-8抑制剂(Ac-IETD-fmk)、caspase-9抑制剂(Ac-LEHD-fmk)与AGS细胞共孵育1 h,加入浓度分别为0、60 mg·L-1 cecropinXJ进行处理,cecropinXJ单独处理作为对照。通过MTT法检测caspase抑制剂对cecropinXJ介导的AGS细胞死亡的影响。
2.11 统计学处理采用GraphPrism 5统计软件进行分析。实验均重复3次,所得数据以 表示,组间两两比较采用单因素方差分析(one-way ANOVA)。
表示,组间两两比较采用单因素方差分析(one-way ANOVA)。
通过MTT法检测浓度范围在0.01~1 000 mg·L-1 cecropinXJ对AGS细胞和GES-1细胞增殖的影响,Fig1结果显示,经cecropinXJ处理24 h后,与对照组相比,cecropinXJ从浓度0.5 mg·L-1开始能明显抑制AGS细胞的增殖(P<0.05),并具有浓度依赖性。其半数有效抑制浓度IC50=61.19 mg·L-1。但cecropinXJ对GES-1细胞作用24 h后,在作用浓度为200 mg·L-1以内时,对GES-1细胞的生长增殖几乎没有影响,而当cecropinXJ作用浓度达到500 mg·L-1时,对GES-1的生长才具有明显抑制作用(P<0.05)。由此可知,cecropinXJ对于非肿瘤细胞系在一定浓度范围内不具有增殖抑制作用,而当cecropinXJ浓度大于500 mg·L-1时,对非肿瘤细胞系具有增殖抑制作用,而该抑制作用可能与细胞毒性相关。
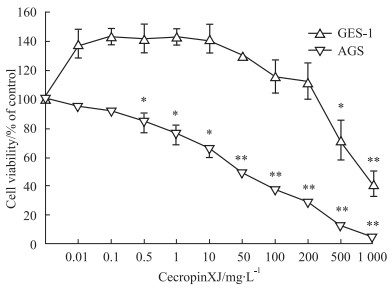
|
| Fig 1 Effects of cecropinXJ on the proliferation of AGS cells and GES-1 cells *P<0.05, **P<0.01 vs 0 mg·L-1 cecropinXJ group |
如Fig2所示,正常的AGS细胞表面有丰富的微绒毛,胞质内线粒体嵴结构完整,并可见大量的粗面内质网及游离核糖体。细胞核内染色体分布均匀,核仁清晰。而用50 mg·L-1 cecropinXJ处理的AGS细胞微绒毛结构被破坏,核内染色质浓缩,并集聚于核膜周围。核膜、胞膜、各细胞器膜均完整。100 mg·L-1 cecropinXJ处理的AGS细胞大多为坏死的细胞,这些细胞的染色质呈不规则的团块状,但不像凋亡细胞那样集中于核周边。细胞膜、核膜和细胞器的结构被破坏,线粒体空泡化,细胞崩解,胞质及其内容物外泄。
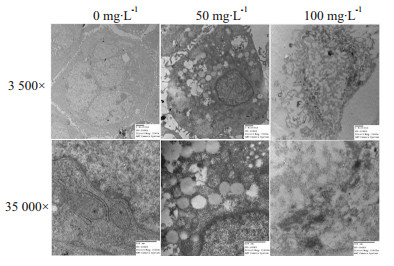
|
| Fig 2 Effects of cecropinXJ on morphology of AGS cells by transmission electron microscopy |
通过Hoechst 33258染色观察细胞核的形态,检 测细胞凋亡情况。Hoechst 33258荧光染色图片显示,对照组的细胞核呈圆形,染色质分布均匀,细胞核为蓝色均匀淡染。而不同浓度cecropinXJ处理24 h后的AGS细胞核固缩,染色质致密深染并片段化,表现为典型的细胞凋亡形态学特征。如Fig3所示,随着cecropinXJ浓度的增加,这种致密深染的细胞的数量也随之增加,至80 mg·L-1时AGS细胞总凋亡率已达到了(45.73±1.94)%。依据这些形态学的变化说明cecropinXJ能够引起AGS细胞的凋亡。
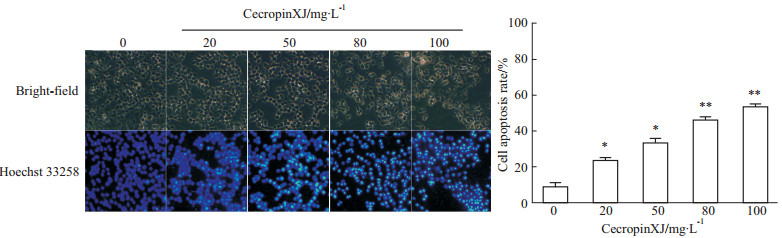
|
| Fig 3 Changes in apoptotic nuclear morphology of cecropinXJ-treated AGS cells by Hoechst 33258 staining(magnification:10×) *P<0.05,**P<0.01 vs 0 mg·L-1 cecropin XJ group |
细胞内活性氧自由基的含量变化对于细胞内环境稳态具有重要作用。为了探讨cecropinXJ诱导的细胞凋亡是否与细胞内活性氧含量变化相关,我们用H2DCF-DA荧光探针检测不同浓度cecropinXJ处理24 h后AGS细胞内活性氧含量的变化,其中DCF的荧光强度反映了活性氧的水平。Fig4结果显示,经20 mg·L-1和50 mg·L-1 cecropinXJ处理后AGS细胞内活性氧含量增加,但无显著性差异,而100 mg·L-1 cecropinXJ处理后,AGS细胞内活性氧含量明显增加(P<0.01)。结果表明,cecropinXJ可促进AGS细胞活性氧产生,并具有浓度依赖性。
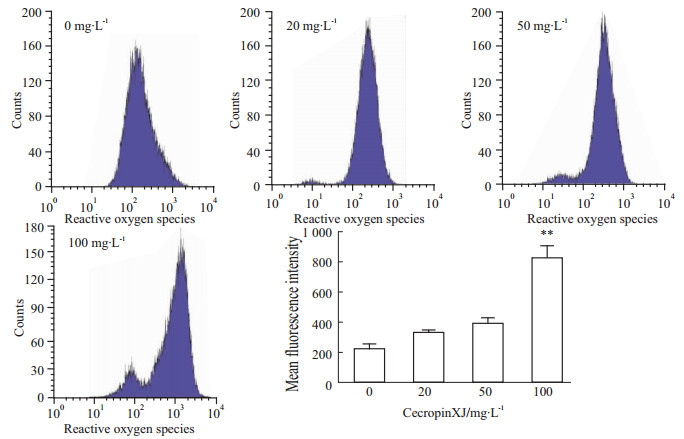
|
| Fig 4 CecropinXJ promotes ROS production of AGS cells **P<0.01 vs 0 mg·L-1 cecropinXJ group |
为了验证cecropinXJ处理后能否诱导细胞线粒体膜电位的改变,采用流式细胞仪检测DiOC6(3)荧光染料的荧光强度,荧光强度下降说明线粒体膜遭到破坏,导致线粒体膜电位下降。Fig5结果显示,与对照组相比,20、50、100 mg·L-1 cecropinXJ处理后荧光强度从(1 188.32±5.50)减弱到(985.89±42.31)、(643.96±94.91) 和(533.56±36.58),具有浓度依赖性。此结果表明,cecropinXJ可改变线粒体膜的通透性从而降低线粒体膜电位。
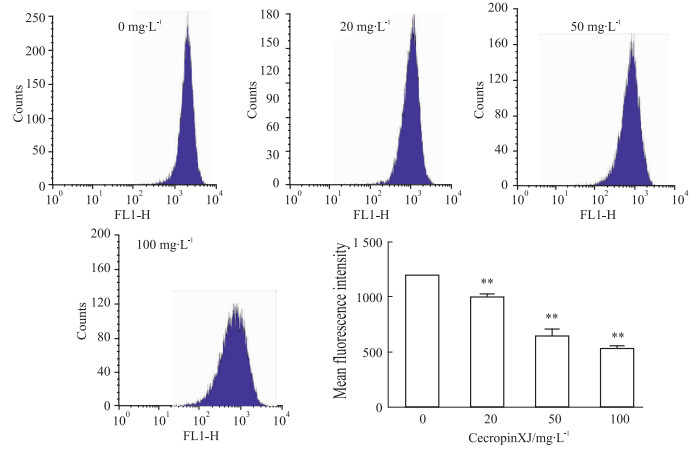
|
| Fig 5 CecropinXJ decreases mitochondrial membrane potential in AGS cells **P<0.01 vs 0 mg·L-1 cecropinXJ group |
caspase家族和Bcl-2家族在细胞的凋亡过程中扮演举足轻重的作用,在本实验中,选取了caspase家族中的caspase-3以及Bcl-2家族中的促凋亡蛋白Bax和抗凋亡蛋白Bcl-2,通过qRT-PCR和Western blot的方法进一步验证caspase家族和Bcl-2家族成员是否参与了cecropinXJ诱导的细胞凋亡过程。如Fig6所示,经cecropinXJ处理之后,caspase-3被剪切,Bcl-2表达下调,Bax和细胞色素C表达均上调,并具有浓度依赖性。研究表明,当Bcl-2/Bax表达比率发生变化时,可改变线粒体膜的通透性,促进细胞色素C的释放,进而激活caspase-3,使细胞凋亡[11]。
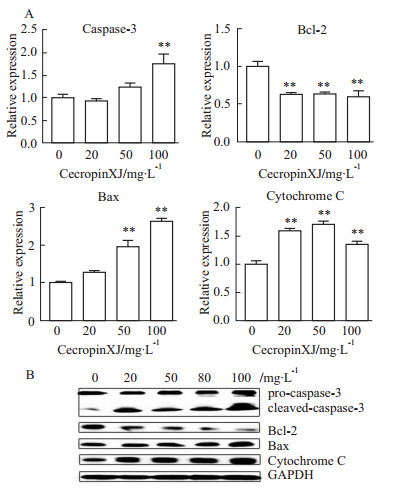
|
| Fig 6 Effects of cecropinXJ on expression of caspase-3,Bcl-2, Bax and cytochrome C in AGS cells A: The relative expression of caspase-3, Bcl-2, Bax and cytochrome C by qRT-PCR; B: The protein expression of caspase-3, Bcl-2, Bax and cytochrome C by Western blot. GAPDH was used as reference. **P<0.01 vs 0 mg·L-1 cecropinXJ group |
细胞凋亡的过程涉及一系列蛋白酶活性的变化,其中绝大多数为caspase酶。为了进一步确定cecropinXJ激活的凋亡信号途径,通过检测细胞内caspase-3的活性以及用caspase-3抑制剂Ac-DEVE-fmk、caspase-8抑制剂Ac-IETD-fmk、caspase-9抑制剂Ac-LEHD-fmk处理后对cecropinXJ诱导的细胞死亡的影响。如Fig7所示,50 mg·L-1 cecropinXJ处理24 h后,caspase-3的活性较对照组相比具有明显的增加(P<0.05),是对照组的1.4倍,而100 mg·L-1 cecropinXJ处理后,caspase-3的活性是对照组的2.39倍,说明cecropinXJ可激活caspase-3的活性并具有浓度依赖性。在AGS细胞中,caspase-3抑制剂Ac-DEVE-fmk和caspase-9抑制剂Ac-LEHD-fmk均能明显地降低cecropinXJ诱导的AGS细胞死亡率,分别可使细胞的死亡率从(51.70±7.19)%减少到(23.93±6.66)%和(31.6±9.61)%,而caspase-8抑制剂Ac-IETD-fmk对细胞死亡率无影响。表明caspase-3和caspase-9参与cecropinXJ激活的凋亡信号途径,caspase-8与此通路无关。
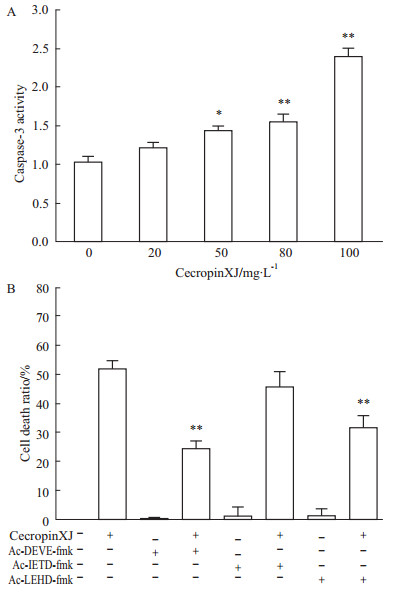
|
| Fig 7 CecropinXJ regulates caspase activity A: AGS cells were treated with various concentration of cecropinXJ (0, 20, 50, 80, 100 mg·L-1) for 24 h and detected caspase-3 activity by caspase activity detection kit. *P<0.05, **P<0.01 vs 0 mg·L-1 cecropinXJ group; B: MTT assays detected the cell death ratio induced by cecropinXJ after addition of caspase-3 inhibitor (Ac-DEVE-fmk), caspase-8 inhibitor (Ac-IETD-fmk) and caspase-9 inhibitor (Ac-LEHD-fmk). **P<0.01 vs cecropin XJ group. |
目前发现许多抗菌肽具有抗肿瘤活性,并且已经成为人们研究的热点。自Moore等[12]首次发现 Cecropin B对哺乳动物的肿瘤细胞具有抗肿瘤活性以来,许多文献相继报道了Cecropin家族的抗菌肽对胃癌、膀胱癌、肝癌等多种肿瘤细胞均具有杀伤作用[13],并且由于其结构本身能形成特定的两亲α-螺旋,可针对非极性脂质的细胞膜,当在膜上定位时,它们在膜上形成离子渗透通道,随后进入细胞导致细胞去极化,发生不可逆的细胞破裂,最后死亡。Zhang等[14]研究证明来自于中国柞蚕的cecropin对大鼠大肠癌细胞具有明显的抗肿瘤作用,但对人正常胃上皮细胞毒性低,表明cecropins能特异性地杀伤肿瘤细胞,但对正常的真核细胞影响甚微。Hui等[15]通过检测cecropin A 对白血病细胞的IC50显示,cecropin A 可裂解白血病细胞,但对淋巴细胞无毒副作用,而传统的化疗药物如5-氟脲嘧啶(5-FU)、阿糖胞苷(Ara-C)对正常细胞和肿瘤细胞无选择性。通过 MTT检测显示,cecropinXJ在500 mg·L-1作用浓度范围内对正常胃上皮细胞系GES-1的增殖几乎没有影响,并且能明显抑制AGS细胞增殖,随着浓度的增高,抑制效果增强,在一定浓度范围内呈浓度依赖性,其IC50=61.19 mg·L-1,此结果表明cecropinXJ同其他的cecropins一样具有对肿瘤细胞选择性杀伤作用。形态学的改变是判断凋亡的基础,主要特点有染色质固缩、DNA片段化、线粒体肿胀或是出现凋亡小体[16, 17]。透射电镜和Hoechst 33258荧光染色结果显示,cecropinXJ处理的AGS细胞具有明显的凋亡现象,且随着浓度的增加凋亡的细胞数明显呈增多的趋势。
大多数的抗肿瘤药物抑制肿瘤细胞的增殖是通过促进肿瘤细胞凋亡达到的,细胞凋亡的途径主要为Fas死亡受体途径和线粒体内途径。据报道,引起肿瘤细胞凋亡主要的途径是线粒体内途径[18]。Risso等[19]研究发现,抗菌肽可增加细胞膜通透性随之进入胞内,由于线粒体膜带有大量负电荷分子,阳离子的抗菌肽通过静电作用与线粒体膜作用,使线粒体膜电位下降,随后细胞产生大量的活性氧作为强烈的凋亡诱导信号,过量的活性氧增加线粒体膜通透性,凋亡启动因子细胞色素C被释放并激活半胱氨酸水解酶诱导细胞凋亡。体外研究抗菌肽或cecropins诱导肿瘤细胞凋亡的文献很多,如Cerón等[20]报道cecropin A可诱导人早幼粒白血病细胞凋亡,其机制可能是由于cecropin A促进细胞内活性氧增加,导致磷脂酰丝氨酸外翻和DNA片段化,最终导致细胞凋亡,但此过程不引起caspase酶的激活。而另外一种抗菌肽蜂毒肽 (melittin),在蜂毒中发现的一种含有26个氨基酸的抗菌肽,通过增加细胞内活性氧、激活caspase诱导肿瘤细胞凋亡[21]。在本研究中发现,经cecropinXJ处理以后活性氧在AGS细胞内迅速积累,并且线粒体膜电位下降,这表明cecropinXJ参与AGS细胞凋亡的诱导。为了进一步确认cecropinXJ是否是通过caspase依赖的途径,通过qRT-PCR、Western blot以及酶活性的检测确定cecropinXJ对caspase-3表达的影响。结果表明,cecropinXJ在mRNA和蛋白水平上均可上调caspase-3的表达,而且caspase-3的活性随着cecropinXJ浓度的增加而逐渐增加,在使用caspase-3和caspase-9抑制剂之后降低了cecropinXJ诱导的细胞死亡率,但是caspase-8抑制剂无此效果,说明caspase-8不参与cecropinXJ诱导的细胞凋亡过程。综上结果显示cecropinXJ诱导细胞凋亡可能是依赖caspase的途径。
Bcl-2是细胞死亡的负调控因子,主要定位在核膜的胞质面、内质网及线粒体外膜上,在细胞凋亡过程中发挥重要的调节功能,包括促凋亡(如Bax)和抗凋亡(如Bcl-2)两类家族,其中Bax和Bcl-2往往成比例存在,Bax的表达上调能够拮抗Bcl-2的抑凋亡效应。当Bax/Bcl-2比例上升时,线粒体膜电位发生变化,可导致线粒体膜通透性增加,使细胞凋亡的启动因子(如细胞色素C)从线粒体内释放出来,激活caspase-3诱导细胞发生凋亡[22]。通过cecropinXJ处理之后,AGS细胞内Bax表达上调,而Bcl-2表达下调,使Bax/Bcl-2比例明显增高,促进细胞色素C的释放。说明cecropinXJ对线粒体膜的影响是显著的,这与线粒体膜电位的结果相一致。
综上所述,cecropinXJ对AGS细胞的增殖有抑制作用,其抗肿瘤活性可能与诱导细胞凋亡有关。其凋亡的相关机制可能为cecropinXJ处理之后引起AGS细胞内活性氧含量的升高,Bax/Bcl-2比例上升,从而使线粒体膜电位下降,增加线粒体膜的通透性,促进细胞色素C从线粒体释放并激活caspase-3,进而诱导细胞凋亡。因此,cecropinXJ可能是通过线粒体内途径的机制诱导AGS细胞凋亡,为进一步开发cecropinXJ成为抗肿瘤药物奠定了理论基础。
| [1] | Boman H G, Nilsson-Faye I, Paul K, et al. Characteristics of an inducible cell-free antibacterial reaction in hemolymph of Samia cynthia pupae[J]. Infect Immun, 1974, 10(1):136-45. |
| [2] | Steiner H, Hultmark D, Engström A, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. J Immunol, , 2009, 182(11):6635-7. |
| [3] | Chen H M, Wang W, Smith D, Chan S C. Effects of the anti-bacterial peptide cecropin B and its analogs, cecropins B-1 and B-2, on liposomes, bacteria, and cancer cells[J]. Biochim Biophys Acta, 1997, 1336(2):171-9. |
| [4] | Jin X, Mei H, Li X, et al. Apoptosis-inducing activity of the antimicrobial peptide cecropin of Musca domestica in human hepatocellular carcinoma cell line BEL-7402 and the possible mechanism[J]. Acta Biochim Biophys Sin, 2010, 42(4):259-65. |
| [5] | Suttmann H, Retz M, Paulsen F, et al. Antimicrobial peptides of the Cecropin-family show potent antitumor activity against bladder cancer cells[J]. BMC Urol, 2008, 8(5):1-7. |
| [6] | Pan W R, Chen P W, Chen Y L, et al. Bovine lactoferricin B induces apoptosis of human gastric cancer cell line AGS by inhibition of autophagy at a late stage[J]. J Dairy Sci, 2013, 96(12):7511-20. |
| [7] | Ausbacher D, Svineng G, Hansen T, Strøm M B. Anticancer mechanisms of action of two small amphipathic β(2, 2)-amino acid derivatives derived from antimicrobial peptides[J]. Biochim Biophys Acta, 2012, 1818(11):2917-25. |
| [8] | Paredes-Gamero E J, Martins M N, Cappabianco F A, et al. Characterization of dual effects induced by antimicrobial peptides:regulated cell death or membrane disruption[J]. Biochim Biophys Acta, 2012, 1820(7):1062-72. |
| [9] | 李金耀, 张富春, 马正海. 家蚕抗菌肽cDNA原核表达及抗菌活性检测[J]. 昆虫学报, 2004, 47(3):407-11. Li J Y, Zhang F C, Ma Z H. Prokaryotic expression of cecropin gene isolated from the silkworm Bombyx mori Xinjiang race and antibacterial activity of fusion cecropin[J]. Acta Entomol Sin, 2004, 47(3):407-11. |
| [10] | Xia L, Liu Z, Ma J, et al. Expression, purification and characterization of cecropin antibacterial peptide from Bombyx mori in Saccharomyces cerevisiae[J]. Protein Expr Purif, 2013, 90(1):47-54. |
| [11] | Das A, Banik N L, Patel S J, Ray S K. Dexamethasone protected human glioblastoma U87MG cells from temozolomide induced apoptosis by maintaining Bax:Bcl-2 ratio and preventing proteolytic activities[J]. Mol Cancer, 2004, 3(1):1-10. |
| [12] | Moore A J, Devine D A, Bibby M C. Preliminary experimental anticancer activity of cecropins[J]. Pept Res, 1994, 7(5):265-9. |
| [13] | Chernysh S, Kim S I, Bekker G, et al. Antiviral and antitumor peptides from insects[J]. PNAS, 2002, 99(20):12628-32. |
| [14] | 张卫民, 赖卓胜, 何美蓉, 等. 柞蚕抗菌肽对大鼠大肠癌的防治研究[J]. 第一军医大学学报, 2003, 23(10):1066-8. Zhang W M, Lai Z S, He M R, et al. Effects of the antibacterial peptide cecropins from Chinese oak silkworm, Antheraea pernyi on 1, 2-dimethylhydrazine-induced colon carcinogenesis in rats[J]. Acad J First Med Coll PLA, 2003, 23(10):1066-8. |
| [15] | Hui L, Leung K, Chen H M. The combined effects of antibacterial peptide cecropin A and anti-cancer agents on leukemia cells[J]. Anticancer Res, 2002, 22(5):2811-6. |
| [16] | Mahassni S H, Al-Reemi R M. Apoptosis and necrosis of human breast cancer cells by an aqueous extract of garden cress (Lepidium sativum) seeds[J]. Saudi J Biol Sci, 2013, 20(2):131-9. |
| [17] | 刘跃亮, 罗进勇, 张 彦, 等. 双氢青蒿素对人骨肉瘤细胞株143B 增殖和凋亡的作用[J]. 中国药理学通报, 2012, 28(12):1717-23. Liu Y L, Luo J Y, Zhang Y, et al. Role of dihydroartemisinin (DHA) in proliferation and apotosis of human osteosarcoma 143B cells[J]. Chin Pharmacol Bull, 2012, 28(12):1717-23. |
| [18] | Huang T C, Lee J F, Chen J Y. Pardaxin, an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 cells[J]. Mar Drugs, 2011, 9(10):1995-2009. |
| [19] | Risso A, Braidot E, Sordan M C, et al. BMAP-28, an antibiotic peptide of innate immunity, induces cell death through opening of the mitochondrial permeability transition pore[J]. Mol Cell Biol, 2002, 22(6):1926-35. |
| [20] | Cerón J M, Contreras-Moreno J, Puertollano E, et al. The antimicrobial peptide cecropin A induces caspase-independent cell death in human promyelocytic leukemia cells[J]. Peptides, 2010, 31(8):1494-503. |
| [21] | Gajski G, Garaj-Vrhovac V. Melittin:a lytic peptide with anticancer properties[J]. Environ Toxicol Pharmacol, 2013, 36(2):697-705. |
| [22] | Du L, Mei H F, Yin X, Xing Y Q. Delayed growth of glioma by a polysaccharide from Aster tataricus involve upregulation of Bax/Bcl-2 ratio, activation of caspase-3/8/9, and downregulation of the Akt[J]. Tumour Biol, 2014, 35(3):1819-25. |

