再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)信号通路是抗心肌缺血/再灌注损伤的主要机制,该信号通路主要包括促生存激酶磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)和细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2),两者均为丝氨酸/苏氨酸激酶。很多实验已表明PI3K和ERK1/2磷酸化参与缺血预适应及药物介导的抗心肌缺血/再灌注损伤过程[1, 2]。前者激活后能够促进下游靶蛋白内皮一氧化氮合酶(endothelial NO synthase,eNOS)、p70S6K、GSK-3β的磷酸化,从而抑制mPTP的开放而发挥保护作用[3]; ERK1/2信号通路激活能够抑制蛋白酶caspase-3的激活,从而抑制心肌细胞凋亡。两条信号通路的激活均能够抑制促凋亡蛋白Bim、Bax、Bad的表达,从而使缺血心肌细胞免于坏死或凋亡[4]。1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是细胞神经鞘磷脂代谢产物之一[5]。本实验室前期研究发现,S1P后适应抑制炎症反应、拮抗氧化应激、保护线粒体结构功能,减轻大鼠心肌缺血/再灌注损伤,亦可缓解心肌细胞缺氧/复氧损伤[6, 7]。上述作用是否与RISK通路有关,需进一步的实验加以验证。本实验拟观察S1P后适应对RISK通路中关键成分Akt和ERK1/2磷酸化的影响,以及PI3K/Akt抑制剂LY294002、ERK1/2抑制剂PD98059对S1P后适应保护作用的影响,以明确S1P后适应保护作用与RISK通路的相关性。
1 材料H9c2 心肌细胞株(中国协和医科大学基础医学研究所细胞中心);S1P(批号:032M4103V)、PI3K/Akt抑制剂(LY294002,LY)(批号:092M4616V)、ERK1/2抑制剂(PD98059,PD)(批号:MFCD00671789)均购自美国Sigma公司;Fura-3/AM(江苏碧云天生物技术研究所,批号:20140113);Annexin V-FITC细胞凋亡检测试剂盒(北京嘉美生物公司,批号:4AD271211F);anti-p-Akt(ser473)(美国Santa Cruz Biotechnology公司,批号:20131210);anti-Akt(美国Cell Signaling Technology公司,批号:20120319);辣根过氧化物酶标记山羊抗兔抗体(批号:970380)、辣根过氧化物酶标记山羊抗小鼠抗体(批号:107724)均购自北京中衫金桥生物技术有限公司; Olympus CK2 型倒置显微镜(日本Olympus公司);Model 680 型酶标仪(美国BIO-RAD 公司);缺氧箱(美国Billups-rothenberg 公司);FACS Calibur型流式细胞仪(美国BD 公司);FV1000型激光共聚焦显微镜(日本Olympus公司)。
2 方法 2.1 细胞分组将培养的大鼠H9c2细胞随机分为7组,即(1)正常(C)组:细胞在5% CO2、37℃培养箱中培养;(2)缺氧/复氧(H/R)组:细胞缺氧16 h后换用无血清的DMEM复氧培养4 h;(3)S1P组:缺氧处理16 h后,复氧前加入终浓度为4 μmol·L-1的S1P;(4)S1P+LY294002(S1P+LY)组:在复氧前加入终浓度为10 μmol·L-1的LY,处理30 min后加入S1P;(5)LY294002(LY)组:复氧前加入终浓度为10 μmol·L-1的LY;(6)S1P+PD98059(S1P+PD)组:在复氧前加入终浓度为50 μmol·L-1的PD,处理30 min后加入S1P;(7)PD98059(PD)组:复氧前加入终浓度为50 μmol·L-1的PD。
2.2 模型的建立将H9c2 心肌细胞用模拟缺氧液置换正常培养液,用95% N2+5% CO2 的混合气于37℃培养箱缺氧培养16 h;再换用含药DMEM低糖培养基在95% O2+5% CO2的正常培养条件下培养4 h,建立H/R损伤模型。
2.3 测定指标 2.3.1 细胞存活率正常组正常培养,其他组细胞经缺氧16 h 以及复氧4 h处理后,利用MTT法测定490 nm波长下每孔光吸收度值(OD 值),并按下述公式计算各组细胞存活率:细胞存活率/%=(各实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)×100 %。
2.3.2 MDA 含量、SOD 活性的检测造模给药处理后收集上清液,按MDA、SOD 试剂盒说明操作,比色法测定各组细胞培养液MDA 含量及SOD 活性。
2.3.3 心肌细胞内钙离子测定造模给药处理后弃培养液,用PBS 冲洗2遍。加入500 μL含5 μmol·L-1 Fluo-3 AM的PBS,37℃避光下负载40 min。PBS洗涤细胞后,避光孵育20 min。激光共聚焦显微镜下测定各组的荧光强度(激发波长:488 nm,发射波长:525 nm),用Image Pro Plus软件处理分析、计算各组的荧光强度。
2.3.4 流式细胞仪检测心肌细胞凋亡百分率经处理后消化法收集细胞,采用Annexin V/PI 双染法对凋亡细胞进行染色,流式细胞仪测定荧光强度,并以Expo32软件处理分析、计算凋亡率。
2.3.5 心肌细胞Western blot 检测经处理后裂解细胞,BCA 法蛋白定量,将蛋白样本进行SDS-PAGE 凝胶电泳,电转膜法将胶中蛋白转移至硝酸纤维素膜,封闭液室温封闭1 h,分别加入p-Akt、t-Akt、p-ERK 1/2、t- ERK 1/2一抗,4℃孵育过夜,二抗室温孵育1 h,加入ECL发光液1 min 显色。经显影、定影后测定特异性条带光密度值,并计算磷酸化蛋白与总蛋白的比值。
2.4 统计学处理计量资料以 表示,采用SPSS 16.0软件对数据进行处理,各组间比较采用单因素方差分析(one-way ANOVA)检验。方差齐时,多组间比较用LSD法、SNK法;方差不齐时,采用Dunnett T3法。
表示,采用SPSS 16.0软件对数据进行处理,各组间比较采用单因素方差分析(one-way ANOVA)检验。方差齐时,多组间比较用LSD法、SNK法;方差不齐时,采用Dunnett T3法。
H/R组细胞存活率明显低于正常对照组(P<0.01)。经S1P后处理后,S1P组细胞存活率明显高于H/R组(P<0.01)。与S1P组相比,加入LY294002 或PD98059以后细胞存活率明显降低,且与H/R组相比差异无显著性,见Tab1。
 , n=6)
, n=6)
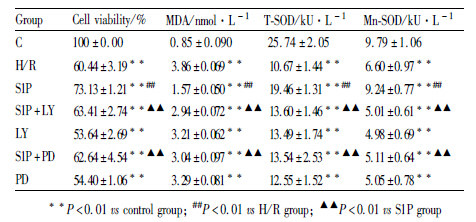 |
与正常对照组相比,H/R组MDA含量明显升高(P<0.01),T-SOD、Mn-SOD活力明显降低(P<0.01);经S1P后处理后,S1P组的MDA含量明显降低(P<0.01),T-SOD、Mn-SOD活力明显提高(P<0.01);与S1P组相比,加入LY294002或PD98059以后,MDA含量明显增加(P<0.01),T-SOD、 Mn-SOD活力明显降低(P<0.01),且与H/R组相比差异无显著性,见Tab1。
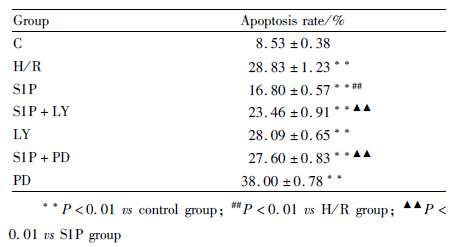
3.3 细胞内游离钙离子的测定结果显示,经过H/R损伤后,细胞内钙离子的荧光强度明显增强,与正常对照组相比,差异有显著性(P<0.01);经过S1P处理后,细胞内钙离子的荧光强度明显降低,且与H/R组相比,差异有显著性(P<0.01);加入LY294002以后,细胞内钙离子的荧光强度明显增强,且与S1P组相比,差异有显著性(P<0.01)。加入PD98059以后,细胞内钙离子的荧光强度明显增强,且与S1P组相比,差异有显著性(P<0.01),见Tab2及Fig1。
 , n=3)
, n=3)
 |

|
| Fig 1 Effect of S1P, LY and PD on fluorescence intensity of intracellurar Ca2+ of H/R injury H9c2 cells by laser scanning confocal microscope A: Control group; B: H/R group; C: S1P group; D: S1P+LY group; E: LY group; F: S1P+PD group; G: PD group |
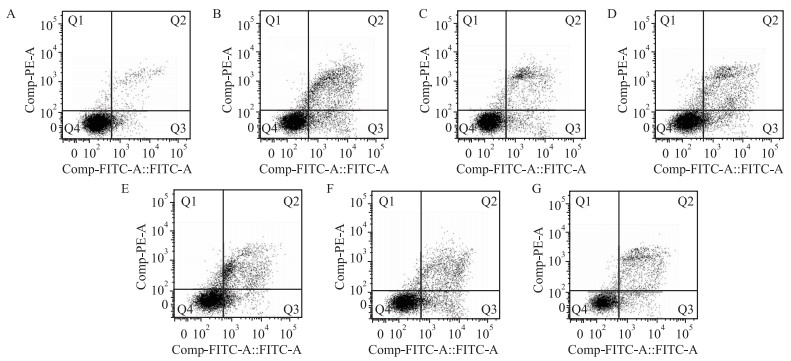
测定结果表明,正常对照组细胞凋亡比较少,与正常对照组相比,H/R组细胞凋亡明显增加(P<0.01);经过S1P处理后的细胞凋亡率与H/R组相比明显下降(P<0.01);与S1P组相比,加入LY294002以后,细胞凋亡率明显升高(P<0.01),加入PD985059以后,细胞凋亡率明显升高(P<0.01),见Tab3及Fig2。
|
| Fig 2 Effect of S1P, LY and PD on the apoptotic rate of H9c2 cells after H/R injury(n=3) A: Control group; B: H/R group; C: S1P group; D: S1P+LY group; E: LY group; F: S1P+PD group; G: PD group |
Western blot结果显示,各组之间t-Akt蛋白、t-ERK1/2蛋白表达差异无显著性。与正常对照组相比,H/R处理能使p-Akt蛋白、p-ERK1/2蛋白表达明显增加(P<0.01);与H/R组相比,S1P组能明显增加p-Akt蛋白、p-ERK1/2蛋白表达(P<0.01);与S1P组相比,加入LY294002以后,p-Akt蛋白的表达明显降低(P<0.01),加入PD90589以后p-ERK1/2蛋白的表达明显降低(P<0.01),且与正常对照组相比均无明显变化。见Fig3、4。

|
| Fig 3 Effect of S1P and LY on the expression of p-Akt/t-Akt after H/R in H9c2 cells(n=6) **P<0.01 vs control group; ##P<0.01 vs H/R group; ▲▲P<0.01 vs S1P group |

|
| Fig 4 Effect of S1P and PD on the expression of p-ERK1/2/t- ERK1/2 after H/R in H9c2 cells(n=6) *P<0.05,**P<0.01 vs control group; ##P<0.01 vs H/R group; ▲▲P<0.01 vs S1P group |
有研究表明,心肌缺血/再灌注损伤涉及多方面因素,如氧自由基生成增多、细胞内钙离子超载、线粒体损伤等[8]。当氧自由基的生成超过了机体内源性抗氧化系统的清除能力时,过多的氧自由基可引起脂质过氧化反应,并刺激线粒体细胞色素C的释放,后者可进一步激活caspase-9,诱导细胞凋亡。SOD是机体重要的内源性自由基清除剂,主要包括分布于线粒体的Mn-SOD以及分布于胞质的Cu/Zn-SOD,其活性的高低可间接反映机体消除ROS的能力 [9]。MDA是脂质过氧化的产物,测试MDA的含量不仅可以反映心肌细胞膜结构的脂质过氧化程度,而且可间接反映氧自由基水平及氧化应激损伤的程度[10]。本实验发现,H/R组氧自由基增多,抗氧化能力减弱,细胞内钙离子增加,细胞凋亡率提高;而给予S1P能减轻细胞脂质过氧化损伤、提高细胞的抗氧化能力、减轻细胞内钙离子超载、抑制细胞凋亡。
RISK信号通路主要包括PI3K/Akt及ERK通路。PI3K/Akt通路广泛存在于细胞中,是参与细胞生长、增殖、分化调节的信号转导通路。ERK在正常心肌细胞中低表达,当受到I/R或者H/R的刺激时,ERK被激活并表达上调[11]。近年来研究显示,ERK信号通路在心肌I/R或者H/R中主要是发挥保护作用[12]。作为心肌保护重要的信号传导机制,很多研究已证实RISK信号通路在缺血预适应或后适应抗心肌缺血/再灌注损伤中的作用[12]。也有研究报道,药理性后适应(如七氟醚、阿片受体激动剂等)可通过激动PI3K-Akt或ERK1/2发挥心肌保护作用[13, 14]。然而,离体心脏灌流实验研究报道,S1P受体激动剂FTY720k可激活Akt,促进LVDP恢复,但并没有缓解心肌损害,减少梗死面积[15]。本研究发现,S1P在保护缺氧/复氧损伤心肌细胞的同时,亦可提高p-Akt和p-ERK1/2水平,而应用LY294002阻断PI3K/Akt信号通路或者PD98059阻断ERK1/2信号通路,均可明显抑制S1P对心肌细胞的保护作用,表现为细胞存活率下降,MDA含量增加,细胞培养液中T-SOD和Mn-SOD的活性降低,细胞内钙离子的浓度增加,细胞凋亡率增加。
综上所述,S1P对缺氧/复氧诱导的H9c2细胞损伤的保护作用与激活RISK信号通路有关。关于S1P对其通路上下游蛋白的影响,本实验未进行验证,仍需进一步的研究。
| [1] | Cross T G, Scheel-Toellner D, Henriquez N V, et al. Serine/threonine protein kinases and apoptosis[J]. Exp Cell Res, 2000, 256(1):34-41. |
| [2] | Hausenloy D J, Yellon D M. New directions for protecting the heart against ischaemia reperfusion injury:targeting the reperfusion injury salvage kinase (RISK)-pathway[J]. Cardiovasc Res, 2004, 61(3):448-60. |
| [3] | Cohen M V, Downey J M. Ischemic postconditioning:from receptor to end-effector[J]. Antioxid Redox Signal, 2011, 14(5):821-31. |
| [4] | Yatomi Y, Ohmori T, Rile G, et al. Sphingosine1-phosphate as a major bioactive lysophospholipid that is released from platelets and interacts with endothelial cells[J]. Blood, 2000, 96(10):3431-8. |
| [5] | 张丽志, 苏 健, 温 克. 1-磷酸鞘氨醇对过氧化氢所致微血管通透性增高的影响[J].中国现代应用药学, 2013, 30(1):6-9. Zhang L Z, Su J, Wen K. Effect of sphingosine 1-phosphate on the increased microvessel permeability induced by H2O2[J]. Chin J Mod Appl Pharm, 2013, 30(1):6-9. |
| [6] | 贺 苗, 赵 杰, 苏 健, 等. 1-磷酸鞘氨醇后适应对大鼠心肌缺血/再灌注损伤的保护作用[J]. 中国药理学通报, 2013, 29(10):1369-73. He M, Zhao J, Su J, et al. Protective effect of sphingosine 1-phosphate postconditioning on myocardial ischemia reperfusion injury in rats[J]. Chin Phamacol Bull, 2013, 29(10):1369-73. |
| [7] | 郑新彬, 温 克, 高卫真, 等. 1-磷酸鞘氨醇后适应对H9c2心肌细胞缺氧/复氧损伤的保护作用[J]. 中国现代应用药学, 2014, 31(1):1-5. Zheng X B, Wen K, Gao W Z, et al. Protective effects of sphingosine-1-phosphate postconditioning on hypoxia/reoxygenation injury in rat H9c2 cardiomyocytes[J]. Chin J Mod Appl Pharm, 2014, 31(1):1-5. |
| [8] | Kaminski K A, Bonda T A, Korecki J, et al. Oxidative stress and neutrophil activation--the two keystones of ischemia/reperfusion injury[J]. Int J Cardiol, 2002, 86(1):41-59. |
| [9] | Li Y, Huang T T, Carlson E J, et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase[J]. Nat Genet, 1995, 11(4):376-81. |
| [10] | Liu X, Guo Q L, Zhang Z, et al. Effect of emulsified isoflurane on apoptosis of anoxia-reoxygenation neonatal rat cardiomyocytes[J]. Asian Pac J Trop Med, 2013, 6(12):977-81. |
| [11] | Li DY, Tao L, Liu H, et al. Role of ERKI/2 in the anti-apoptotic and cardioprotective effects of nitric oxide after myocardial ischemia and reperfusion[J]. Apoptosis, 2006, 11(6):923-30. |
| [12] | Hausenloy D J, Yellon D M. Survival kinases in ischemic preconditioning and postconditioning[J]. Cardiovasc Res, 2006, 70(2):240-53. |
| [13] | Fang N X, Yao Y T, Shi C X, et al. Attenuation of ischemia-reperfusion injury by sevoflurane postconditioning involves protein kinase B and glycogen synthase kinase 3 beta activation in isolated rat hearts[J]. Mol Biol Rep, 2010, 37(8):3763-9. |
| [14] | Tong G, Sun Z, Wei X, et al. U50, 488H postconditioning reduces apoptosis after myocardial ischemia and reperfusion[J]. Life Sci, 2011, 88(1-2):31-8. |
| [15] | Hofmann U, Burkard N, Vogt C, et al. Protective effects of sphingosine-1-phosphate receptor agonist treatment after myocardial ischaemia-reperfusion[J]. Cardiovasc Res, 2009, 83(2):285-93. |